
NITROGEN
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
18 |
|
H |
2 |
|
|
|
|
|
|
|
|
|
|
13 |
14 |
15 |
16 |
17 |
He |
|
Li |
Be |
|
|
|
|
|
|
|
|
|
|
B |
C |
N |
O |
F |
Ne |
|
Na |
Mg |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
Al |
Si |
P |
S |
Cl |
Ar |
|
K |
Ca |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
Ga |
Ge |
As |
Se |
Br |
Kr |
|
Rb |
Sr |
Y |
Zr |
Nb |
Mo |
Tc |
Ru |
Rh |
Pd |
Ag |
Cd |
In |
Sn |
Sb |
Te |
I |
Xe |
|
Cs |
Ba |
La |
Hf |
Ta |
W |
Re |
Os |
Ir |
Pt |
Au |
Hg |
Tl |
Pb |
Bi |
Po |
At |
Rn |
|
Fr |
Ra |
Ac |
Rf |
Bh |
Sg |
Hs |
Mt |
? |
? |
? |
? |
|
? |
|
? |
|
? |
|
|
|
|
Ce |
Pr |
Nd |
Pm |
Sm |
Eu |
Gd |
Tb |
Dy |
Ho |
Er |
Tm |
Yb |
Lu |
|
|
|
|
|
Th |
Pa |
U |
Np |
Pu |
Am |
Cm |
Bk |
Cf |
Es |
Fm |
Md |
No |
Lr |
|
N, atomnr. 7, molvekt 14,00674 g, elektronkonfigurasjon: (He)+2s2-2p3, smeltepunkt -209,86 °C, kokepunkt -195,8 °C, tetthet 1,2506 g/l (0,808 g/cm3 ved kokepunktet). Nitrogen hører til gruppe 15 (hovedgruppe V eller 5) (også kjent som 'pniktogenene') i det periodiske systemet, og har (1981) 12 kjente isotoper og isomerer. Naturlig nitrogen er en blanding av to isotoper, 99,63 atom-% 14N og resten 15N.
HISTORIE
Den svenske kjemikeren Carl Wilhelm Scheele fant sannsynligvis i 1769, og iallfall før 1772 ut at luft kunne deles i to bestanddeler, en som hadde evnen til å nære ilden og en som ikke hadde det. Den første kalte han "ildluft," og den andre, som for det meste var nitrogen, "forpestet luft." Denne oppdagelsen ble imidlertid ikke offentliggjort før den engelske botanikeren Daniel Rutherford i 1772 kom til lignende resultater. Han fant ut at det var en del av luften man verken kunne brenne noe i eller puste i. Han kalte den "mephitic (d.v.s. forpestet) air."
Det var kjemipioneren Antoine Lavoisier, senere giljotinert under den franske revolusjonen, som først erkjente at denne kvelende gassen var et grunnstoff. Han kalte den først "mofette" - kvelende luft - men forandret dette til "azote," av gresk 'azotikos' = uten liv. Denne betegnelsen har vært brukt i fransk inntil nylig, til tross for at det var en franskmann som foreslo det mest brukte navnet internasjonalt, "nitrogen," da man var blitt klar over sammenhengen med salpeter og salpetersyre. Betegnelsen er sammensatt av gresk 'nitron' (fra egyptisk 'ntry') = salpeter, og 'genein' = danne.
I Norden har betegnelsene "kvelstoff" (da. og no.) og "kväve" (sv.) vært vanlig inntil de siste årene. På tysk har gassen hett "Stickstoff" - 'kvelende stoff.'
Nitrogen spilte en rolle i den relativt flamboyante historien om flogiston. I kjemiens barndom trodde mange at ild var et eget stoff, kalt flogiston, som fantes i brennbare ting og forsvant fra dem når de brant. Av den grunn har også nitrogen vært kalt "avflogistonisert luft." Se under oksygen for mer om dette,.
GEOLOGI
Molekylært nitrogen er hovedbestanddelen av luft, og utgjør 78,09 % av volumet og 75,51 % av massen av jordatmosfæren. Av den øvre, faste jordskorpens masse utgjør den 0,03 %, og er nr. 16 på hyppighetsstatistikken der. Sjøvann inneholder opptil 0,00003 % nitrogen, og der er nitrogenet nr. 15 i hyppighet.
Det er mye nitrogen i Jordas indre, og store mengder slippes årlig ut gjennom vulkaner. Det er ikke reaktivt nok til å danne større mengder av hydrotermale mineraler i forbindelse med den vulkanske aktiviteten, men det er kjent nitrider av titan, krom, jern, kvikksølv og silisium. Nitrogen som bindes i mineraler skyldes først og fremst biologisk aktivitet, men nitrater kan også dannes som forvitringsmineraler utfra naturlige nitrogenoksyder i lufta, f.eks. etter tordenvær. Siden de fleste nitrogenholdige mineraler er lett løselige i vann trengs det uvanlige omstendigheter, ørkner eller underjordiske saltleier, for at de skal kunne bevares i særlig grad.
Nitrogen er (1977) en hovedkomponent av 50 kjente mineraler, hvorav 26 ammoniumsalter, 10 nitrater, 6 nitrider, 5 organiske stoffer, et organometallisk stoff, et cyanid og et tiocyanat. De grunnstoffene nitrogenet forekommer oftest sammen med i mineraler er hydrogen og oksygen med 43 av de 50 mineralene hver. Deretter følger svovel med 14, karbon med 10, fosfor 9, magnesium og kalium 7, natrium 6, klor og jern 5, silisium 4, kobber 3, bor, fluor, aluminium, kalsium og kvikksølv 2 og titan, krom, kobolt, nikkel, molybden, barium og uran med 1 hver.
To nitrater er de eneste nitrogenmineralene som forekommer i noen større skala. Kjent fra oldtiden er salpeter, KNO3, et glassklart, rombisk mineral som finnes sporadisk som forvitringsmineral og som bestanddel av noen organiske avsetninger. Chilesalpeter, NaNO3, er et glassklart trigonalt mineral som er en hovedkomponent av caliche, et jordliknende produkt som finnes i store mengder i de høytliggende ørkenstrøkene i Chile.
Det er lite vits i å utvinne ren nitrogengass fra annet enn luft, men også mineraler som salpeter og chilisalpeter har vært utnyttet for nitrogeninnholdet.
KJEMI
Nitrogen er ved normale betingelser en fargeløs, luktfri gass. Den er meget lite reaktiv ved romtemperatur, men kan reagere med forskjellige stoffer ved oppvarming. Særlig de elektropositivere metallene danner lett nitrider ved slike betingelser. Nitrogen løses i vann, men noe mindre lett enn oksygen. Luft utkokt fra sjøvann inneholder ca. 65 volum-% nitrogen. Det er nitrogenmolekyler som gir nordlyset de oransjerøde, blågrønne, blåfiolette og dypfiolette fargene.
Nitrogen har 5 valenselektroner i det ytterste skallet og kan dermed enklest danne ioniske forbindelser med oksydasjonstrinn -3 og +5. Nitrogenatomet danner gjerne kovalente bindinger ved å dele 3 av valenseletronene med andre atomer. Det er et av de mest elektronegative grunnstoffene, bare oksygen og fluor er mer elektronegative, men vanligvis opptrer nitrogen som toatomige molekyler med en trippelbinding som er svært stabil, og dette gjør gassen svært reaksjonstreg, det trengs vanligvis sterk oppvarming og andre drastiske virkemidler for at den skal reagere med andre grunnstoffer og reagenser, og nitrogengass er mye brukt som vernende atmosfære for å beskytte reaktive substanser mot luft. Frie nitrogenatomer som lages ved å utsette gassen for sterke elektriske utladninger er derimot svært reaktive. (Nativt nitrogen.)
Nitrogen kan reagere med hydrogen ved en temperatur på 400-550 grader ved 100-1000 atmosfærers trykk i nærvær av en effektiv katalysator. En annen metode med historisk betydning er å bruke nativt nitrogen fra elektriske utladninger. Produktet er ammoniakk, NH3, en kovalent forbindelse hvor tre elektronpar deles med hydrogenatomene som hvert bidrar med sitt eget. Siden det siste elektronparet også trenger plass, blir molekylet pyramideformet, som metanmolekylet (CH4), men ikke like symmetrisk. Dette siste frie elektronparet har stor kjemisk betydning, siden det gir molekylet polaritet og det kan dannes hydrogenbindinger med nabomolekyler, på samme måte som i vann. Ammoniakk er også et godt løsningsmiddel for polare og ioniske stoffer. Spesielt har løsninger av alkalimetallene i flytende ammoniakk mange interessante egenskaper. På samme måte som hydratene i vann dannes det lett ammoniakater med ioner som er løst i ammoniakk, hvor ammoniakkmolekylene er elektrostatisk bundet til ionet og kan inngå som 'ammoniakat-ammoniakk' i en krystallstruktur.
I den organiske kjemien dannes aminer ved at ett eller flere av hydrogenatomene i ammoniakken er substituert med karbonholdige molekyldeler slik at det dannes aminer. Det gir molekylet polaritet slik at det kan dannes hydrogenbindinger med hydrogenatomer på det samme eller andre molekyler, noe som har betydning for molekylstrukturen og løseligheten i vann og danner angrepspunkt for mange kjemiske reaksjoner, og det kan også oppta et proton og altså fungere som en base og gi molekylet en positiv elektrisk ladning. Når ammoniakk opptar et proton får det samme bindingsstruktur som metan og er helt symmetrisk. Denne positivt ladde strukturen er svært stabil, og ladningen er fordelt over hele molekylet. Ionet kalles ammonium (NH4+) og opptrer i tallrike ioniske forbindelser. Særlig usubstituerte ammoniumioner imiterer alkaliionene, de danner fargeløse, lett vannløselige salter med høyt smeltepunkt og har mange egenskaper til felles med dem. Men ammoniakk er ikke noen sterk base, og ammoniumsalter med sterke syrer reagerer surt i løsning. Ammoniakk kan også reagere som en syre overfor sterkt elektropositive reagenser og danne ioniske amider, NH2- eller NH2-, og nitrider, N3-.
Ammoniakk er forøvrig nokså lite reaktivt, og må oppvarmes til nærmere 1000 grader for å brenne i luft. Men det kan oksyderes med klor: 4 NH3 + Cl2 = 2 NH4Cl + N2H4. Dette sistnevnte produktet er en fargeløs væske som kalles hydrazin. Industrielt brukes mest Raschig-syntesen med hypokloritt: 2 NH3 + NaOCl = NaCl + H2O + N2H4. Hydrazinet er ustabilt termodynamisk og disproporsjonerer til ammoniakk og nitrogengass. Det reagerer også kraftig med oksygen og brukes som brennstoff, bl.a. i raketter. Det har også en høy dielektrisitetskonstant og er et glimrende løsningsmiddel for polare substanser. Hydrazin har to frie elektronpar og reagerer i vannløsning som ammoniakk basisk til hydrazoniumioner, N2H5+ eller N2H62+. Førstnevnte danner salter som er stabile i vann, mens de sistnevnte hydrolyserer sterkt, men kan krystalliseres ut fra en løsning med stort overskudd av syren. I basisk løsning er hydrazin et sterkt reduksjonsmiddel.
Med mikrobølgeutladninger i gassformig hydrazin fås en blanding av ammoniakk og diazen, H-N=N-H, et krokete molekyl som har en cis- (\_/) og en transform (\/\) og er ustabilt over -180 °C. Ammoniakk reagerer med sølvzeolitter til Ag+-komplekser med triazan, N3H5, og syklotriazan, N3H3. Også et par andre ustabile nitrogenhydrider, N4H4 og N4H2, er kjent.
Ved reaksjon mellom natriumamid og lystgass kan det fås natriumazid: NaNH2 + N2O = H2O + NaN3. Tilsettes natriumazidet svovelsyre kan det destilleres av hydrazosyre, HN3, en fargeløs, flyktig væske med skarp lukt. Dette er et kovalent molekyl med en struktur som er en mellomting mellom H-N=N+=N- og H-N--N+
ºN. I syren ligger strukturen nærmere sistnevnte, slik at avstanden mellom nitrogenatomene er forskjellig, men i azidionet er avstanden den samme, og strukturen ligger mellom den kovalente N-=N+=N- og de delvis ioniske NºN+N2- og N2-N+ºN. Både syren og azidene av tyngre metaller er eksplosive, mens azidene av alkalimetallene og de lettere jordalkalimetallene kan varmes opp og dekomponere til metall og nitrogen uten å detonere.Ioniske nitrider kan lages ved sterk oppvarming av alkali- og jordalkalimetaller samt noen få andre, f.eks. sink, med nitrogen, eller ved moderat oppvarming av metallamider. Støkiometrien svarer godt til de vanlige valenstallene med -3 som oksydasjonstrinn for nitrogen. De ioniske nitridene dekomponerer raskt i vann med metallhydroksyder og ammoniakk som resultat.
Nitridene av de fleste overgangsmetallene følger støkiometrien noenlunde, men inneholder gjerne et lite overskudd av nitrogen. De har metallglans og er kjemisk inerte, ekstremt harde stoffer med høyt smeltepunkt, f.eks. smelter vanadiumnitrid, VN, ved 2570 °C og har en hardhet på mellom 9 og 10 på Mohs skala. De fremstilles gjerne ved å oppvarme metallet med ammoniakk til 1100-1200 grader. Krystallstrukturen er vanligvis lik eller likner strukturen av metallet, og med nitrogenatomene i mellomrommene i strukturen.
Bornitrid kan være enda hardere enn vanadiumnitrid, nesten 10, og sublimerer på over 3000 grader. Men det er et kovalent nitrid med en elektronstruktur svært lik diamantstrukturen. Det er en glatt, hvit substans som kan lages ved å varme opp bor med ammoniakk. Som diamant har den en heksagonal modifikasjon som er stabil ved normal temperatur og trykk, men i motsetning til grafitten er den fargeløs og elektrisk isolerende. Den må oppvarmes til 1800 grader under 85000 atmosfærers trykk for å gå over til den harde kubiske. Bornitridet hydrolyserer sakte i vann.
Aluminium reagerer direkte med nitrogen ved oppvarming, men gallium, indium og thallium danner nitrider bare ved omveier. Alle er harde og stabile som bornitridet. De er elektrisk isolerende i motsetning til de tilsvarende forbindelsene med fosfor, arsen, antimon og vismut, og har en heksagonal wurtzitt-struktur hvor det ene atomslaget hver er omgitt av 4 av det andre.
Kovalente karbonnitrider som C3N4 og C4N3 kan ifølge teoretiske betraktninger være hardere enn diamant og ha andre ekstreme egenskaper. Derfor har det på 1990-tallet vært gjort mange forsøk på å fremstille dem. Metodene har vært ekstreme, f.eks. bombardering av karbontarget med nitridioner eller atomisk nitrogen, laserbeskytning av karbontarget i nitrogen- eller ammoniakkatmosfære m.m. Det fortelles at man har klart å lage tynne filmer av karbonnitrider uten spesifisert sammensetning. Rapportene tyder på at egenskapene kan være usedvanlige, men analysen er ikke kommet så veldig langt ennå (2000).
Karbon kan brenne i nitrogenatmosfære ved sterk oppheting og danner da bl.a. cyanogen, N
º C-Cº N. En enklere fremstillingsmåte er å oksydere blåsyre, HCN, over en katalysator, f.eks. sølv. Cyanogen er en brennbar gass som i støkiometrisk blanding med oksygen kan gi en flammetemperatur på over 5000 K. Liksom ammoniakken imiterer alkalimetallene imiterer cyanogen halogenene i mange reaksjoner. Den kan reduseres til blåsyre som danner cyanider med mange kationer, og cyanidene har mange egenskaper til felles med halogenidene. Men blåsyren er en svak syre, og cyanidene hydrolyserer lett i vann til blåsyre og hydroksyder.Blåsyre er også en fargeløs gass, og både blåsyre og vannløselige cyanider er vanligvis svært giftige. I gasskammer skjer gjerne forgiftningen ved at man løser cyanider i vann. Men cyanid er en meget god kompleksdanner og danner komplekser som er stabile nok til at de ikke avgir cyanidioner, f.eks. brukes heksacyanoferrater, [Fe(CN)6]3-4- som tilsetningsstoffer i mat. Organiske estre av blåsyre kalles nitriler og er ikke giftige. De kan best dannes ved å oksydere aminer, og ved reduksjon av nitriler kan det dannes aminer, f.eks. etylamin <-> metylnitril, C2H5NH2 <-> CH3CN.
Som halogenene disproporsjonerer gjerne cyanogen i basisk løsning: (CN)2 + 2OH- = CN- + OCN- + H2O. Dette gir et cyanidion og et cyanation, tilsvarende kloridionet og hypoklorittionet ved disproporsjonering av klorgass. Cyanat er ustabilt i vannløsning (OCN- + 2H2O = NH3 + HCO3-), men danner mange stabile komplekser. Ved syretilsetning til cyanater kan det dannes cyansyre, som kan binde hydrogenet til den ene eller andre enden av ionet og danner en ustabil og useparerbar blanding av H-O-C
º N og H-N=C=O, sistnevnte kalles også isocyansyre. Organiske estre av cyansyre består bare av isocyanet.Hvis man heller en løsning av kvikksølv(II)nitrat i etanol, faller det ut et hvitt, krystallinsk, pulver som er kvikksølv(II)fulminat, Hg(ONC)2. Den tilsvarende syren kalles knallsyre, H-O-N
º C, med en trippelbinding som tilsvarer trippelbindingen i karbonmonoksyd. Navnet henspiller på at kvikksølv(II)fulminatet er et slagfølsomt sprengstoff som særlig har vært brukt i fenghetter og også har vært kjent som knallkvikksølv.Tilsvarende cyanatene kan et tiocyanat eller rodanid, SCN-, lages ved å smelte alkalicyanider med svovel. Ved syretilsetning dannes tiocyansyre eller rodansyre som blir en blanding av HSCN og HNCS på samme måte som cyansyren. Ved oksydasjon av tiocyansyre dannes gassformig rodan eller tiocyanogen, (SCN)2, som ved romtemperatur raskt omdannes til en mursteinsrød polymer. Tiocyanat er også en meget god kompleksdanner og brukes til påvisning av jern ved de rødfargede kompleksene [FeSCN]+ og [Fe(SCN)2]2+. Det finnes også selen- og tellurforbindelser som tilsvarer tiocyanogen og tiocyanatene.
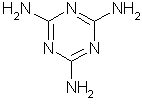
Ved sterk oppheting av kalsiumkarbid i nitrogen dannes kalsiumcyanamid, CaNCN. Ved moderat surgjøring fås cyanamid, H2NCN, som formelt er et amid av cyansyre. I basisk løsning ved 80 °C dannes en dimer, dicyandiamid, (H2N)2C=NCN, og med mer drastiske metoder kan det dannes en interessant ringformet og teknisk viktig trimer, melamin.
Cyanhalogenider kan dannes ved reaksjon mellom blåsyre og halogen. De kan di- og trimeriseres på tilsvarende måte som cyanamid og brukes i industriell syntese. Ved reaksjon mellom f.eks. cyanbromid og natriumazid dannes lett en annen binær karbonm-nitrogenforbindelse, cyanazid, NCN3.
Aldehyder og ketoner reagerer i svakt basisk miljø med blåsyre til cyanhydriner, f.eks. CH3CHO + HCN = CH3-CH(OH)-CN. Cyanhydrinene er nyttige i syntesen fordi de lett lar seg omdanne til syrer eller estere med vann eller en alkohol i surt miljø. F.eks. gir benzaldehyd et cyanhydrin som med vann og saltsyre gir mandelsyre, C6H5CH(OH)COOH, og acetoncyanhydrin gir med metanol og svovelsyre et metyl-2-hydroksy-2-metylpropionat, CH3C(OH)(CH3)COOCH3, som svovelsyren trekker et vannmolekyl ut av og omdanner til metylmetakrylat, CH2=C(CH3)COOCH3, som kan polymeriseres til pleksiglass.
I den organiske kjemien har karbon-nitrogenforbindelser stor betydning. Aminer er molekyler hvor et eller flere av hydrogenene på ammoniakken er substituert med et organisk radikal, f.eks. etylamin, C2H5NH2. Tradisjonelt kalles det iminer hvis to av hydrogenene er substituert, dette kalles også binære aminer. De vanlige aminene kalles primære, mens det kalles tertiære aminer hvis alle tre hydrogenene er substituert. Aminer som substitueres på nitrogenet navngis gjerne med N- og den substituerende gruppen, f.eks. er fenylamin eller anilin C6H5NH2, mens C6H5NHCH3 er N-metylanilin og C6H5N(CH3)C2H5 er N,N-metyletylanilin. Aminer har gjerne en gulaktig farge, som kan forsterkes eller modifiseres av andre grupper i molekylet. De har ofte en karakteristisk fiskelukt.
Nitrogen kan også inngå i ringstrukturer, som kalles heterosykliske hvis ikke alle bestanddelene av ringskjelettet er karbon. Ringnitrogenene kan ha et hydrogenatom bundet hvis det bare inngår enkeltbindinger med naboatomene, men de kan også inngå dobbeltbindinger med naboatomene, som i benzen, og mangler da normalt hydrogen. Men aminer er vanligvis basiske og opptar gjerne protoner på samme måte som ammoniakk. Aminene er de eneste vanlige basiske funksjonelle gruppene i den organiske kjemien og spiller derfor en uhyre viktig rolle. Men et iminhydrogen kan være surt hvis molekylet kan stabiliseres ved at nitrogenatomet inngår en dobbeltbinding med et av naboatomene, f.eks. hvis det er bare det som mangler for at ringen skal få en benzenstruktur, som er spesielt stabil.
Ammoniakk eller aminer kan reagere med organiske syrer ved vannavspaltning til amider, den organiske karboksylsyregruppen -COOH mister en OH og aminet en H i form av et vannmolekyl og det dannes en -CO-NH-kjede, f.eks. danner etylamin og eddiksyre N-etyleddiksyreamid, CH3CONHC2H5. Aminosyrer er molekyler som inneholder både en aminogruppe og en syregruppe, og de kan danne lange kjeder ved at det dannes slike amidbindinger. Dette har stor betydning i biokjemien fordi alle proteiner er bygd opp av slike kjeder av aminosyrer.
Aldehyder og ketoner reagerer under visse betingelser med hydroksylamin, NH2OH, til oksimer, f.eks. med aceton dannes dimetyloksim: (CH3)2CO + NH2OH = (CH3)2C=N-OH + H2O. Oksimer omarrangeres til amider når de behandles med svovelsyre: (CH3)2CNOH -> CH3CONHCH3 (såkalt Beckmann-omordning), d.v.s. oksygenatomet flytter over fra nitrogenet til karbonet og den ene metylgruppen flytter fra karbonet til nitrogenet.
Som ammoniakk danner aminer mange komplekser med ioner og andre polare enheter. Komplekser mellom metallioner og grupper på 4 aminer eller molekyler som inneholder 4 aminogrupper som kan koordineres rundt metallionet er spesielt stabile og kan stabilisere høye oksydasjonstrinn som vanligvis er vanskelige å oppnå hos metallet. Porfyrinforbindelsene i biokjemien, f.eks. klorofyllet i plantene som er sentralt i fotosyntesen og hemet i det oksygentransporterende hemoglobinet i blodet, er eksempler på dette.
Hvis et primært aromatisk amin som f.eks. anilin tilsettes natriumnitritt i kald, sur løsning, frigjøres salpetersyrling som reagerer med anilinet: C6H5NH + HNO2 + H+ = C6H5N=N+ + 2 H2O. Resultatet kalles et diazoniumion. Det danner salter med mange anioner og har mange interessante syntetiske reaksjoner. Særlig viktige er reaksjonene med andre aromatiske aminer eller fenolationer, f.eks.: C6H5N=N+ + C6H4(NH2)2 = C6H5N=NC6H3(NH2)2 + H+. Gruppen -N=N- kalles azogruppen (fra det franske azote som var et tidlig navn på nitrogen) og forbindelser som inneholder denne gruppen kalles azoforbindelser. Alle er sterkt fargede, og når de inneholder grupper som gjør dem vannløselige, slik som amino- og hydroksylgruppene eller en sulfogruppe, kan de brukes som fargestoffer. Det er kjent en myriade slike azofargestoffer, det som er nevnt over heter krysoidin og farger brunrødt. Ofte foreligger de som salter av alkalimetaller eller klorider. Azogruppen er fargesenteret, men nyansene påvirkes av den øvrige sammensetningen av molekylet. Gule, oransje, røde, brune, svarte og blå varianter forekommer.
Det eksisterer også et nitrid av silisium, Si3N4, et gråhvitt pulver som smelter ved 1900 °C. Det finnes to germaniumnitrider, Ge3N4 og Ge3N2, det første fås som et hvitt til lysebrunt pulver som dekomponerer ved 450 °C, det andre som svarte krystaller som sublimerer ved 650 °C.
Det finnes fosfornitrider med sammensetning PN, P3N5 og P4N6. PN er et av de vanligste molekylene i interstellare skyer. Det kan lages et antimonnitrid, SbN, et gult pulver som dekomponerer ved oppvarming. Et vismutnitrid, BiN, er eksplosivt.
Ved reaksjon mellom fosforpentaklorid og ammoniumklorid kan det fås fosfornitriddiklorider, (PNCl2)n, ring- eller kjedeformede molekyler hvor kloratomene er bundet til fosforatomene. De likner gummi i egenskapene, særlig hvis n er stor, og tåler oppvarming til 500 °C, men hydrolyserer lett ved påvirkning av vann.
Nitrogen har en rikholdig flora av oksyder, med formelle oksydasjonstrinn fra +1 i N2O til +5 i N2O5. Men de formelle oksydasjonstallene sier ikke så mye om den egentlige strukturen av forbindelsene, som kan være forbløffende eksotisk. De fleste er gasser, og spiller viktige roller i atmosfæriske fotokjemiske prosesser, som bl.a. danner smog, og de er sterke drivhusgasser.
Lystgass, N2O, også kalt lattergass, nitrogenoksydul eller mer moderne dinitrogenoksyd eller nitrogen(I)oksyd, er en fargeløs gass med svakt søtaktig lukt som er nokså kjemisk stabil og ikke reagerer verken med halogener, alkalimetaller eller oson ved romtemperatur, men den virker mildt oksyderende og kan avgi oksygenet til substanser som er lette å oksydere, f.eks. brenner svovel, fosfor og karbon nesten like godt i lystgass som i oksygen. Blandinger med hydrogen eller ammoniakk er eksplosive. Den kan lages ved å varme opp ammoniumnitrat til 250-260 °C: NH4NO3 = N2O + 2H2O. Rask oppvarming eller oppvarming til over 300 grader kan føre til kraftige eksplosjoner. Lystgassmolekylet er lineært og bindingsstrukturen er en mellomting mellom N=N=O og N
ºN-O, hvor det midtre nitrogenatomet har en positiv ladning og det andre har noe under en halv negativ ladning og oksygenatomet noe over en halv. Ladningen er ikke fullstendig kvantifisert i slike kovalente molekyler som dette. Elektronene beveger seg over hele molekylet og fordeler seg slik som det passer energimessig best for dem. Puster man inn små mengder lystgass får man en slags rus med krampaktig lattermildhet. Større mengder virker bedøvende.Nitrogenmonoksyd, NO, eller nitrogenoksyd, er en fargeløs gass, men intenst blå i flytende eller fast form. Den har en merkelig bindingsstruktur, hvor tre delte elektronpar danner en trippelbinding tilsvarende den i nitrogengass og karbonmonoksyd, fordelt på 3 sp2-hybride molekylorbitaler, mens hvert av atomene har et udelt elektronpar i p-atomorbitaler i diametralt motsatt retning av molekylorbitalene. Dermed blir det et valenselektron til overs på oksygenatomet, og siden de bindende orbitalene, går dette elektronet inn i en antibindende orbital, hvor bølgefunksjonen er omtrent proporsjonal med differansen mellom bølgefunksjonene av et tilsvarende elektron i disse atomene, i stedet for summen, som i de bindende orbitalene. Disse antibindende orbitalene er også felles, men de virker frastøtende i stedet for tiltrekkende på atomene, og forekommer derfor sjelden i molekyler, her er tiltrekningskraften i trippelbindingen sterk nok til å overvinne frastøtningen, og molekylet er merkelig stabilt og reagerer forholdsvis tregt med andre stoffer. Med tre elektronpar i bindende orbitaler og ett i en antibindende, kan nitrogenmonoksydmolekylet sies å ha en "to-og-en-halv-binding".
Nitrogenmonoksyd er ustabilt overfor spalting til bestanddelene, men ved normal temperatur går spaltningen meget sakte. Spaltningen er reversibel, og NO kan derfor også lages ved sterk oppvarming av bestanddelene. Dette skjer f.eks. i forbrenningsmotorer, og i luft oksyderes NO raskt til det giftige dioksydet, NO2, noe som er viktig for luftkvaliteten på steder med mange forbrenningsmotorer. Det uparede elektronet kan lett avgis slik at det dannes et nitrosyl- eller nitrosoniumion, NO+, som har samme elektronstruktur som nitrogengass, karbonmonoksyd og cyanidionet. Det kan danne salter med oksosyrer, f.eks. nitrosylperklorat, NOClO4. Men nitrosylhalogenidene er mest kovalente, f.eks. nitrosylkloridet, O=N-Cl. Nitrosylionet danner mange kovalente komplekser med overgangsmetallene. Men det er jern(II)komplekset av nøytralt NO, [Fe(H2O)5(NO)]2+, som dannes ved å redusere salpetersyre med Fe2+ og brukes til å påvise salpetersyre og nitrat. Det kan også skje at den antibindende orbitalen fylles ved å oppta et elektron til, slik at det dannes et oksonitrat(I)-ion, [N=O]-, som er stabilt nok til å danne salter med alkalimetaller. NO-molekylet er paramagnetisk siden det inneholder et uparet elektron, men frosset NO er bare svakt paramagnetisk siden molekylet der i stor utstrekning opptrer som en dimer, N2O2. NO brukes i organismen som et forbløffende allsidig signalstoff, som nevrotransmitter har det særlig stor betydning for ereksjonen.
Nitrogenseskvioksyd eller dinitrogentrioksyd eller nitrogentrioksyd, N2O3, er en svakt blålig gass eller en intenst blå væske med kokepunkt +3,5 °C. Væsken er et av de få stoffer som er flytende over et større temperaturområde enn vann, siden frysepunktet er -103 °C. I væsken skjer en viss grad av selv-ionisering til nitrosyl- og nitrittioner. Molekylet er også polart, og sammensatt av et nitrosyl- og et nitrittion med en kovalent N-N-binding hvor det ledige elektronparet på nitrogenet i nitrittionet deles mellom de to nitrogenatomene. Rent N2O3 fås bare i fast form (blekblå), over frysepunktet inneholder den alltid mer eller mindre NO og NO2 på grunn av likevekten N2O3 <> NO + NO2, som ved romtemperatur er forskjøvet nokså langt til høyre. Likevekten innstiller seg svært raskt, og både det rene seskvioksydet og gassblandingen løser seg i vann til salpetersyrling, HNO2, og i baser til nitritt, NO2-.
Nitrogendioksyd, NO2, er et fargeløst fast stoff, smeltepunkt -11,2 °C, en gul væske, kokepunkt +21,2 °C eller en brun, giftig gass med karakteristisk lukt. I molekylet ligger nitrogenatomet i midten, og det er en vinkel på 134 grader mellom oksygenatomene. Hvert av oksygenatomene har to egne elektronpar, et som deles fullstendig med nitrogenatomet og et par som delvis deles, men oppholder seg mest hos oksygenet. I tillegg til de nevnte elektronene har nitrogenatomet også et ekstra elektron, som tilbringer mest tid hos nitrogenet, men også fordeler seg til en viss grad over oksygenatomene. Dette uparede elektronet gjør molekylet paramagnetisk. Det fører også til at det lett dimeriseres til dinitrogentetroksyd, N2O4, som er årsak til fargeforandringene ved nedkjøling, siden dimeren er fargeløs. N-N-bindingen i dimeren er svak, siden bindingselektronet fortsatt fordeles over hele molekylet. Monomeren tar lett opp et elektron og danne nitrittion, men kan også miste det uparede elektronet og danne nitronium- eller nitrylion, som har samme elektronstruktur som karbondioksyd og kan danne salter med oksosyrer. Dimeren kan selvioniseres til nitrosyl- og nitrationer eller nitryl- og nitrittioner. Derfor er det et godt løsningsmiddel for polare stoffer. Blandet med et organisk løsningsmiddel kan den være svært reaktiv og løser også ganske edle metaller. Nitrogendioksyd kan ses som en brun avgassing når metaller løses i salpetersyre. Det er meget lett løselig i vann og danner også salpetersyre eller nitrat når det løses i vannet.
Dinitrogenpentoksyd eller nitrogenpentoksyd, N2O5, er bygd opp på samme måte som dinitrogentetroksyd, men med en oksygenbro mellom nitrogendioksydenhetene som ikke helt danner kovalente bindinger med dem, de er delvis ioniske, og molekylet kan delvis sies å være et nitrylnitrat. Det er et hvitt, krystallinsk stoff med smeltepunkt +30 °C. Det er ustabilt og kan eksplodere. I litt fuktig luft trekker det til seg vann og danner salpetersyre.
Mange gassfasereaksjoner spalter N2O5 til nitrogendioksyd og nitrogentrioksyd, NO3, som raskt forbrukes ved forskjellige oksydasjonsprosesser. Ved nedbrytning av oson med N2O5 som katalysator, eksisterer trioksydet lenge nok til at det kan registreres spektroskopisk.
Andre nitrogen-oksygenforbindelser er azidene av nitrosyl- og nitrylkationene, med summarisk formel N4O og N4O2.
Ved reduksjon av nitrater eller nitritter med f.eks. svoveldioksyd eller tinn kan man få hydroksylamin, NH2OH, et hvitt, krystallinsk stoff med smeltepunkt 33,05 °C og kokepunkt 56,5 °C. Det er ustabilt ved romtemperatur og kan eksplodere ved oppvarming, men holder seg stabilt ved en temperatur under 0 °C. Som ammoniakk og hydrazin kan hydroksylaminet oppta protoner på det ubundne elektronparet på nitrogenet og fungere som en base. Det er kjent mange salter, ofte med betydelig høyere smeltepunkt, bedre stabilitet og større vannløselighet enn hydroksylaminet. Både hydroksylaminet og saltene er sterke reduksjonsmidler og meget giftige. Som hydrazin adderes hydroksylamin lett til dobbeltbindinger i organiske forbindelser, noe som kan utnyttes i organisk syntese.
Salpetersyrling, HNO2, kan lages ved å redusere bariumnitrat til nitritt med f.eks. karbon eller omdanne det til nitritt ved oppvarming, og behandle nitrittet med svovelsyre slik at bariumsulfat felles. Salpetersyrlingen er en svak syre som ikke eksisterer som væske, men kan fås som gass. I gassfasen innstiller det seg raskt en likevekt mellom salpetersyrling og gassene vanndamp, nitrogenmonoksyd og nitrogendioksyd. I vannløsning er den ustabil og dekonponerer raskt ved oppvarming til salpetersyre, vann og nitrogenmonoksyd. Saltene kalles nitritter, og både syren og nitrittene er giftige, men nitrittene er gjerne mer stabile både i løsning og ellers. De fleste er lett vannløselige. Nitrittionet er en god kompleksdanner, og det finnes mange nitrittokomplekser med ioner av overgangsmetaller. Nitrittionet er en mellomting mellom O-N=O og O=N-O, med en halv negativ ladning på hvert av oksygenatomene. Den nøytrale syren lages av ionet med hydrogen enten på nitrogenet i midten eller et av oksygenatomene.
Det kan lages et gult peroksonitration, -OONO, av superoksydionet, O2-, og nitrogenmonoksyd i vannløsning ved pH 12-13. Ionet er stabilt i flere timer i 0,1 M base.
Salpetersyre, HNO3, fremstilles industrielt ved Ostwald-prosessen, hvor ammoniakk oksyderes til nitrogenmonoksyd med luft ved 800 °C av en platinakatalysator. Etter avkjøling oksyderes monoksydet med luft til dioksyd som løses i vann og disproporsjonerer til salpetersyre og nitrogenmonoksyd, som unnslipper og kan oksyderes igjen. Salpetersyren kan også renfremstilles ved å destillere den av en blanding av natriumnitrat og svovelsyre. Den er ofte gul på grunn av innhold av NO2. "Rykende salpetersyre" er en løsning av NO2 i salpetersyre. En løsning av salpetersyre i vann kan kokes inn til en azeotrop blanding som inneholder 68,2 vekt-% salpetersyre og koker ved 120,5 °C. Det er denne blandingen som kalles konsentrert salpetersyre. Salpetersyre kan fryses til krystallinske hydrater med 1 eller 3 molekyler vann, men det dannes ikke noen ortosalpetersyre, H3NO4. Vannfri salpetersyre er amfoter og reagerer basisk overfor sterkere syrer som flussyre, perklorsyre og svovelsyre: HNO3 + H+ = H2O + NO2+. Samme reaksjon gir en svak grad av autoprotolyse i ren vannfri salpetersyre.
I vannløsning er Salpetersyre en sterk syre, som også er et kraftig oksydasjonsmiddel. Bare gull, platina, iridium og rhodium angripes ikke av salpetersyre, som kan skille rent gull ut av legeringer med f.eks. sølv, og derfor ofte er kalt "skillevann" eller "skjedevann" fra tysk "Scheidewasser". En blanding av 1 volumdel salpetersyre og 3 deler saltsyre kalles kongevann og løser selv de edleste metallene. Det blir gjerne rødfarget av nitrosylklorid. Aluminium, krom og jern passiveres av konsentrert salpetersyre fordi det danner seg et tynt, beskyttende oksydlag, men de kan løses av fortynnet salpetersyre. Ved oppløsning av metaller reduseres gjerne noe av syren til nitrogenmono- eller dioksyd, men noen elektropositive metaller, f.eks. sink, kan redusere noe av syren helt ned til ammoniakk. Nærvær av dioksyd øker reaksjonshastigheten, så rykende salpetersyre brukes gjerne for å få rask reaksjon, men hvis gassen utvikles under reaksjonen går den fortere av seg selv.
Saltene av salpetersyre kalles nitrater. Alle uorganiske nitrater er vannløselige og fargeløse hvis de ikke farges av kationet. Nitrater av noen organiske baser er tungtløselige. Nitratene har lett for å dekomponere ved oppvarming. De krystalliserer gjerne med krystallvann. Vannfrie nitrater er ofte lett løselige i organiske løsningsmidler og kan i høy grad regnes som kovalente. Organiske estere av salpetersyre kalles også nitrater. De kan fremstilles av salpetersyre og alkoholer ved å fjerne vann med svovelsyre. En blanding av 2 volumdeler svovelsyre og 1 volumdel salpetersyre kalles nitrersyre, og reagerer også med aromatiske organiske forbindelser til nitroforbindelser ved at det tas et hydrogenatom fra benzenringen og OH fra syren som fjernes som vann og det bindes en nitrogruppe, -NO2, til molekylet. Både nitrat-estere og nitroforbindelser er oftest gulfargede, og noen av dem er brukbare som fargestoff.
Peroksosalpetersyre, HOONO2, er ustabil, men kan fås ved destillasjon fra salpetersyre og 90 % hydrogenperoksyd i argonstrøm.
Svovel reagerer med flytende ammoniakk til et gult tetrasvoveltetranitrid, N4S4, som har samme molekylstruktur som As4S4, men med omvendt plassering av atomene. Det kan også lages et grått dinitrogenpentasulfid, N2S5, en ustabil væske som fryser ved +10-11 °C.
Av nitritt- og bisulfidioner kan det lages et hydroksylamin-N,N-disulfonation, HON(SO3)22-, eller ON(SO3)23- i base. Kaliumsaltet, fremys salt, er dimorft, med en gul, svakt diamagnetisk monoklin versjon og en oransjebrun, triklin form som er paramagnetisk i likhet med ionet og saltene av store kationer.
Fluor reagerer med ammoniakk med kobberkatalysator til en blanding av nitrogenfluorider. Nitrogentrifluorid, NF3, er en ureaktiv, fargeløs gass. Salter av et tetrafluorammoniumion kan fås med trifluoridet, fluor og en sterk lewissyre som bortrifluorid, f.eks. NF4BF4. Tetrafluorhydrazin, N2F4, er en reaktiv gass som kan fremstilles rent ved å oppvarme NF3 med kobber. Den dissosieres lett i reaktive difluoraminradikaler som reagerer som typiske frie radikaler. Difluirdiazen, N2F2, er en reaktiv gass fremstilles rent ved elektrolyse av ammoniumfluorid. Klor reagerer med ammoniumklorid i svakt sur løsning til et triklorid, NCl3, eller med ammoniakk til kloramin, NH2Cl, som er seige, gule, eksplosive væsker. Også fluoramin, NH2F, og -imin, NHF2, kan fremstilles, med liknende egenskaper. Med brom fås tribromid, NBr3, som likner kloridet, og med jod en slags jodnitrider som er kjededannende blandprodukter av trijodid og ammoniakk og er faste, svarte til mørkerøde og sterkt eksplosive stoffer.
Analyse:
Nitrat i løsning kan påvises ved jernnitrosylprøven. Hvis løsningen ikke inneholder karbonat eller sulfid tilsettes 0,5 ml konsentrert svovelsyre forsiktig til 1 ml av løsningen. En mettet løsning av jernsulfat dryppes forsiktig ned i prøven, hold reagensglasset på skrå og la dråpene renne nedover veggen. Etter et par minutter er nitrat påvist hvis det dukker opp en brun ring av jernnitrosyl. Hvis løsningen inneholder karbonat eller sulfid tilsettes 3M svovelsyre dråpevis til gassutviklingen opphører før analysen. Bromid, jodid, kromat og bikromat kan forstyrre, men kan felles ut med sølvacetat eller -sulfat.
Ammonium kan påvises ved oppvarming med sterk lut. Det drives av ammoniakkgass som har en karakteristisk lukt og farger lakmuspapir blått.
Cyanider frigjør blåsyre ved pådrypning av svovelsyre. Blåsyren lukter meget sterkt av bitre mandler og kan registreres også i meget små (ufarlige) mengder. Sørg bare for å ikke pøse på med syre, da kan det gå deg ille... Vær oppmerksom at det ikke er alle som kan oppfatte mandellukten.
Mange organiske nitrogenholdige forbindelser har karakteristisk lukt som gir sikker påvisning. F.eks. er aminer kjent for sin fiskelukt. Organiske forbindelser med gule, røde og brune farger inneholder ofte nitrogen, og kan analyseres ved absorpsjonsspektroskopi.
For proteinanalyse er det viktig å vite hvilke aminosyrer de består av, hvor mye det er av hver og rekkefølgen av dem i proteinkjeden. En enkel måte å bestemme de to første på er ved papirkromatografi. Filterpapir består av ren cellulose med ca. 20 % absorbert vann. Man setter papirstykket skrått ned i en skål med et egnet organisk løsningsmiddel som fenol eller butanol. Løsningsmiddelet begynner å migrere oppover papiret p.g.a. hårrørseffekten. Nederst på papiret drypper man en dråpe av en aminosyreblanding (resultatet av en fullstendig proteinhydrolyse med syrekoking). Aminosyrene vil også begynne å vandre oppover mens de kontinuerlig fordeles mellom det absorberte vannet i papiret og det organiske løsningsmidlet. De mest vannløselige aminosyrene vil tilbringe mer tid i den stasjonære vannfasen og mindre i den migrerende organiske og vil derfor ikke vandre så langt som de mindre vannløselige aminosyrene. Etter en passende tidsperiode tas papiret ut av skålen, tilførselen av organisk løsningsmiddel holder opp og bevegelsen stanser. Ved å spraye papiret lett med en basisk løsning av ninhydrin, en forbindelse som gir en sterk fargevirkning med aminosyrer, ser man hvor langt de forskjellige aminosyrene har vandret og kan identifisere dem ved å sammenlikne med standarder. For best mulig oppløsning er det en fordel å ha papirstrimmelen så lang som mulig. Størrelsen på flekkene sier noe om hvor mye det er av de enkelte aminosyrene. Denne metoden ble brukt av pionerene innen proteinanalyse. Idag analyseres proteiner i automatisk utstyr basert på ionebytterkromatografi.
Å bestemme rekkefølgen av aminosyrene i proteinet er en mer komplisert affære. Det finnes enkelte kjemikalier som 2,4-dinitrofluorbenzen eller 1-dimetylaminonaftalen-5-sulfonylklorid (DANSYL-klorid) som fester seg på amino-enden av peptidkjeden med en binding som ikke påvirkes av senere hydrolyse slik at ende-aminosyren kan bestemmes. Enzymet karboksypeptidase spalter av aminosyrer fra den andre enden, slik at hvis man lar det virke på et protein en tid vil man finne større mengder av aminosyren ved karboksyl-enden enn av de andre. Fenylisotiocyanat fester seg også til aminoenden, og ved behandling med fortynnet saltsyre tar den med seg den siste aminosyren og lar de andre være i fred slik at samme prosedyre kan repeteres med resten av kjeden. (Edman-metoden.) Med automatiserte sekvenatorer er det idag mulig å koble av litt over 100 aminosyrer (hver avkobling tar 2 timer) med denne metoden for separat analyse før feilkildene blir for store. Derfor er det aktuelt å spalte et protein i relativt korte peptider og prøve denne eller andre metoder på dem. Til dette bruk har man f.eks. N-bromsuccinimid, som spalter proteiner ved tyrosin, og en del enzymer som har andre preferanser. De korte peptidene separeres så ved kromatografiske metoder før sekvenseringen begynner.
Fremstilling:
Det er neppe aktuelt å fremstille nitrogen på annen måte enn ved destillasjon av luft. Nokså rent nitrogen kan fremstilles i skolelaboratoriet eller hjemme på kjøkkenet ved å legge et stykke hvitt fosfor i en liten porselenskål, legge skålen i en bolle med vann slik at den flyter, tenne på fosforet og raskt sette en klokke over når fosforet har begynt å brenne. Det dannes en tykk, hvit røyk av fosforpentoksyd som etter en stund klarner fordi den løses i vannet. Tilbake har du ca. 98,8 % nitrogen, ca. 1,18 % argon og små mengder av andre bestanddeler.
Demonstrasjonsforsøk:
Løs kobberspon i konsentrert salpetersyre ved å helle syren over sponene i et begerglass. Observer gassutviklingen, spesielt de brune dampene av nitrogendioksyd: Cu + 4 H+ + 2 NO3- = Cu2+ + 2 H2O + 2 NO2. Regn ut hvor mye konsentrert salpetersyre du trenger for å omdanne alt kobberet til kobbernitrat hvis det er 68,2 vektprosent ren salpetersyre i den og atomvektene for hydrogen, nitrogen, oksygen og kobber er henholdsvis 1,0079, 14,0067, 15,99944 og 63,546.
Løs kobber(II)sulfat i vann og tilsett langsomt en 6 M ammoniakkløsning under omrøring. Først danner det seg en et blekblått, geléaktig bunnfall av kobber(II)hydroksyd, deretter løses det igjen til en mørkeblå løsning av tetramminkobber(II)sulfat, Cu(NH3)4SO4.
Gjør forsøket som er nevnt under fremstillingsavsnittet ovenfor. Observer at vannet stiger i klokken og at en brennende treflis slukker når den føres inn i klokken.
Slipp et stykke glødende trekull ned i rykende salpetersyre (d.v.s. nitrogendioksyd løst i salpetersyre) og se hva som skjer. OBS! Gjøres i avtrekk, med beskyttelseshansker.
Varm opp litt salpeter i to reagensrør til saltet smelter og begynner å boble. Slipp et stykke trekull i det ene og et stykke svovel i det andre og se hva som skjer. OBS! Gjøres i avtrekk, med beskyttelseshansker.
Dypp litt ullgarn i konsentrert salpetersyre og se at den farges gul. Drypp en dråpe konsentrert salpetersyre på fingeren og se at den farges gul. Hva er skjedd?
Legg litt magnesiumspon på en asbestplate og utsett det for sterk varme. Det brenner til et pulver som er mer eller mindre gulfarget. Avkjøl pulveret og hell vann over det. Hva lukter det og hvorfor?
Løs litt jernklorid, kobbersulfat og sinksulfat i hvert sitt av tre reagensrør. Tilsett en fortynnet løsning av kaliumferrocyanid, K4Fe(CN)6, i hvert rør og observer forandringene.
Hell noen krystaller ammoniumdikromat, (NH4)2Cr2O7, i et reagensglass og varm det opp i avtrekk og med beskyttelseshansker. Observer hva som skjer. Forsøket kalles også "det kjemiske juletre".
Løs 5 g sølvnitrat i 10 ml konsentrert ammoniakkløsning, tilsett 7 g natriumkarbonat og 5 g gummi arabicum i 12 ml destillert vann. Oppvarm blandingen til den får en brunsvart farge. Dypp en penn e.l. i blandingen og skriv, f.eks. på tøy. Stryk over skriften med et varmt strykejern. Den går ikke vekk samme hva du prøver med.
Legg noen krystaller ammoniumnitrat i et reagensrør og varm forsiktig opp ved svak varme. Snus inn gassen, merker du noe? NH4NO3 = N2O + 2H2O. Vær forsiktig ved oppvarmingen, ammoniumnitratet kan eksplodere ved sterk varme.
Knekk et egg og hell hviten over i et begerglass. Tilsett 10 ml konsentrert saltsyre og kok i en halvtime med et urglass som lokk og kokesteiner for å hindre sprut. Sett et filterpapir skrått ned i en skål med fenol eller butanol og drypp en dråpe av den utkokte eggehviten på filterpapiret like over væskeflaten. La dråpen trekke oppover papiret en stund før du tar opp papiret og sprayer det med en basisk løsning av ninhydrin for å fremkalle kromatogrammet. Flekken har delt seg i flere flekker fordi de forskjellige aminosyrene vandrer i løsningsmidlet med forskjellig hastighet. Hvis du vil identifisere aminosyrene kan du dryppe på standardløsninger med kjent aminosyresammensetning samtidig som du drypper på dråpen fra hviteprøven, eller bruke flere skåler og standardløsninger av enkelte aminosyrer.
Noen viktige forbindelser er:
Ammoniakk, en fargeløs gass med en karakteristisk lukt. Tetthet 0,771 g/l, sm.p. -77,7 °C og kok.p. -33,35 °C. Ammoniakk er løselig i vann i rent uhyggelige mengder, og reagerer basisk: NH3 + H2O = NH4+ + OH-. I en mettet vannløsning utgjør ammoniakken nærmere halve massen av løsningen. Den store løseligheten kan forklares ved at begge molekylene er polare, noe som også forklarer at ammoniakk selv er et utmerket løsningsmiddel. Ioner som løses i ammoniakk omgis av ammoniakkmolekyler og danner ammoniakater, tilsvarende hydratene i vannløsning. Når ammoniakk inngår kovalente forbindelser med karbon får vi aminer, som gir organiske forbindelser de basiske og polare karakterer som ammoniakk har.
Salpetersyre, en fargeløs væske med stikkende lukt. Tetthet 1,5027 g/cm3, sm.p. -42 °C, kok.p. 83 °C. Salpetersyre er en av de tre klassiske sterke syrene. Blandbar med vann i alle forhold. Både oksyderende og sure egenskaper, de oksyderende mest fremtredende i høy konsentrasjon. Disse egenskapene setter den istand til å løse de fleste substanser, og i blanding (1:3) med saltsyre kan den tilogmed løse gull.
Kaliumnitrat, kjent fra oldtiden som salpeter, (lat. sal petrae = klippesalt, fordi man fant det krystallisert på kaliumrike bergarter etter regntiden.) Fargeløse krystaller. Tetthet 2,109 g/cm3. sm.p. 334 °C. Avgir oksygen ved 400 °C. Løses lett i varmt vann, tungt i kaldt. Til forskjell fra natriumnitratet trekker dette ikke til seg vann fra luften, noe som har fått betydelige konsekvenser for menneskehetens historie.
Ammoniumklorid, kjent fra oldtiden som salmiakk, (lat. sal ammoniacum = salt fra Ammon, d.v.s. fra Siwa-oasen i Egypt hvor naboene til Amons berømte orakeltempel hadde som erverv å selge salmiakk utvunnet av kamelmøkk.) Fargeløse krystaller. Tetthet 1,527 g/cm3. Fordamper uten å smelte(sublimerer) ved 340 °C. Løses lett i vann.
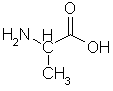
Alanin (1-aminopropionsyre.) Opptrer i to stereokjemiske varianter, hvorav den ene, den høyredreiende, er en av de 20 aminosyrene som alle proteiner bygges av. Hvite nålformede krystaller. Tetthet 1,4 g/cm3. Dekomponerer ved 300 °C. Løses i vann, ikke i eter, knapt i alkohol.
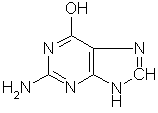
Guanin. Nåle-eller plateformede krystaller som dekomponerer når de oppvarmes til 360 °C. Uløselig i vann. Lite løselig i alkohol og eter. Guanin er en av de fire nukleotidbasene som danner grunnlaget for oppbygningen av nukleinsyrene, DNA og RNA. Navnet kommer av guano (fra quechua: huanu = skitt), store avleiringer av fugleskitt funnet i søramerika og brukt som gjødsel. Det er rikelig av guanin i guano, og det finnes også i reptilenes hud og i fiskeskjell, som får glansen fra krystaller av guanin.
BIOLOGI
Nitrogen er et av livets basisstoffer, og regnes for å utgjøre gjennomsnittlig ca. 16 % av all biomasse. Ingen levende organismer kan klare seg uten nitrogen. Det er en hovedbestanddel av proteiner og av arvestoffet, og spiller viktige roller i alle kjemiske livsprosesser. Tilførsel er derfor et problem som alle levende organismer må løse. For dyrene er det lettest. Aminosyrer fra proteiner 'importert' fra andre organismer danner utgangspunkt for proteinsyntesen. De samme aminosyrene brukes også til syntese av andre nødvendige nitrogenforbindelser, f.eks. nukleotidbasene som inngår i arvestoffet. Men p.g.a. mangelfull evne til å syntetisere aminosyrer er også dyrene avhengige av denne importen.
Plantene må oppta nitrogenet fra jorda som uorganisk ammonium eller nitrat, og gjøre resten av jobben selv. Kildene til dette nitrogenet er for en stor del forråtningsprodukter etter kadavre eller døde planterester. Men også det store forrådet av nitrogen i lufta kan utnyttes. Nitrogenoksyder som dannes etter lynutladninger og skylles ned med regnet gir et ikke uvesentlig bidrag. Det finnes også bakterier som er i stand til å 'fiksere' luftnitrogen til ammoniakk og nitrat som plantene kan utnytte. Noen planter, f.eks. erteplantene, har utviklet symbiotiske forhold til slike bakterier.
Biomasse består for en stor del av protein, og de fleste dyr, særlig de kjøttetende, inntar mer nitrogen enn de trenger. Overflødige aminosyrer blir gjerne deaminert og går som regel inn i energistoffskiftet. Det fraseparerte nitrogenet skilles ut i form av urinstoff [(NH2)2CO] eller andre egnede substanser. En liten andel nitrogen unngår også opptak i tarmen, og blir skilt ut gjennom avføringen. Sammenfatningsvis har vi altså i naturen en syklus av opptak og utskillelse, gjæring og forråtning av nitrogenforbindelser. Denne kalles gjerne nitrogenkretsløpet.
Nitrogen er biologisk aktivt i svært mange forbindelser, og mange av funksjonene er essensielle for opprettholdelsen av livet. De viktigste er proteinene og nukleinsyrene. Proteiner består av kjeder av aminosyrer og spiller en mengde forskjellige roller i organismen. Generelt sett er det bare 20 aminosyrer å velge mellom, hver med sine trebokstavers koder i DNA. Illustrasjonen nedenfor viser strukturen, navnet, de tre- og enbokstavskodene som er konvensjonelle å bruke når man skal beskrive lengre sekvenser av aminosyrer i proteiner og peptider, samt DNA-kodene. I tillegg til de 61 DNA-kodene på tegningene kommer tre stoppkoder, TAA, TAG og TGA. Dessuten brukes Asx og B som konvensjonell bokstavkode for asparaginsyre eller asparagin når man ikke vil spesifisere akkurat hvilken, og det samme gjelder Glx og Z for glutaminsyre eller glutamin.
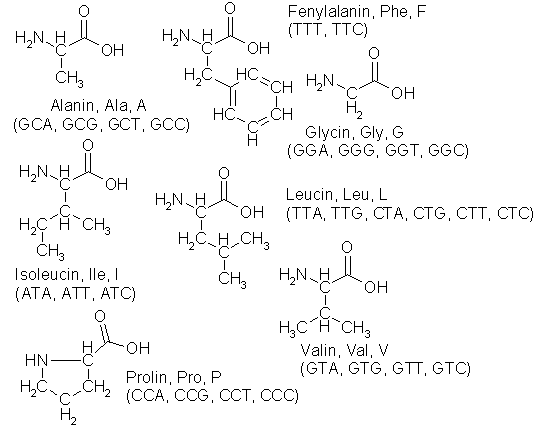
Mye av vitsen med aminosyrene er at sidegrenene har forskjellige egenskaper som er avgjørende for oppbygningen og funksjonene til proteinene de er bestanddeler av. De upolare aminosyrene glycin, alanin, valin, leucin, isoleucin, prolin og fenylalanin gjør proteinet vannfrastøtende og fettiltrekkende der hvor de forekommer på overflaten, og har stor betydning for formen og den tredimensjonale oppbygningen av proteinet. Glycin utgjør 1/3 av aminosyrene i kollagen, et seigt bindevevsprotein, og er den eneste som får plass inne i de stramme kveilene det er bygd opp av. Fritt glycin er også et av utgangspunktene for produksjon av porfyriner, det metallbindende molekylet i hemoglobin og klorofyll. Størstedelen av resten av kollagenet består av prolin og hydroksylert prolin.
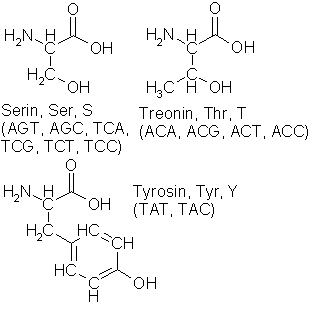
De andre aminosyrene har polare grupper på sidegrenene og virker vanntiltrekkende og fettavstøtende hvis de forekommer på overflaten, noe de vanligvis gjør. Serin og treonin har alkoholgrupper på sidegrenene og tyrosin har en fenolgruppe. Serinet har særlig viktige funksjoner i fosfoproteiner hvor fosfatgruppene forestres til OH-gruppene i serinet, og i glykoproteiner hvor karbohydrater bindes til disse OH-gruppene. Det inngår også i noen fosfolipider hvor det går med til syntesen av sfingosin, som har flere viktige funksjoner i nervesystemets kjemi. Treonin binder også gjerne karbohydrater i glykoproteiner. Som serin foreligger den ofte fosforylert i andre proteiner. Tyrosin er som fri aminosyre utgangspunkt for produksjon av en rekke viktige kjemikalier, bl.a. flere av de viktigste nevrotransmitterne og pigmentstoffet melanin. Albinisme skyldes at kroppen mangler enzymet tyrosinase som omdanner tyrosin til melanin. De tre aromatiske aminosyrene er fenylalanin, tyrosin og tryptofan. Sistnevnte har en purinliknende struktur i sidegrenen og gir den fra seg når det skal lages forbindelser med slik struktur.
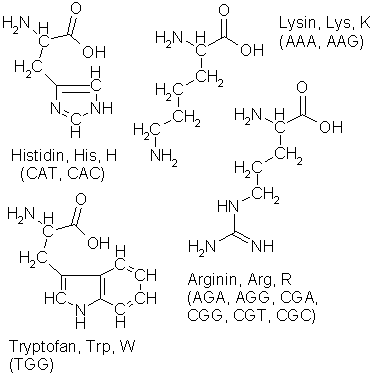
De fleste aminosyrer er uladde, men de basiske lysin, arginin og histidin er positivt ladet og de sure asparaginsyre og glutaminsyre er negativt ladet ved normal pH i kroppsvæsker. Denne ladningen spiller en viktig rolle i mange biokjemiske prosesser. Lysin brukes i likhet med cystein til å danne tverrforbindelser mellom peptidkjeder for å strukturere proteinet og gi det styrke. I elastin, et elastisk protein som bygger mange viktige strukturer i kroppen, kobles 4 lysiner i fire forskjellige kjeder sammen til desmosin eller isodesmosin. Den lange sidekjeden i lysin er også nyttig for å koble til aktive grupper i noen enzymer, de aktive grupper har gjerne en karboksylgruppe, gjerne også på en lang sidekjede, den bindes med en amidbinding til aminogruppen i lysinet og enzymet får en lang aktiv (prostetisk) gruppe med god bevegelighet og rekkevidde. Arginin avgir gruppen -NH-C(:NH)-NH2 når det skal lages urinstoff. Den heterosykliske ringen i histidin kan avgis for produksjon av flere viktige stoffer, og ved dekarboksylering kan den frie aminosyren omdannes til histamin, som spiller en viktig rolle når kroppen reagerer på skader, men også er aktivt i forbindelse med allergi.
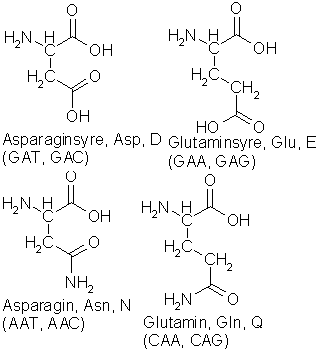
Som fri aminosyre er asparaginsyre utgangspunkt for produksjon av pyrimidinbasene thymin, cytosin og uracil, og er med på å gjendanne arginin når den er brukt til å produsere urinstoff. Glutaminsyre finnes i muskelvev og bidrar til å gi kjøttet den karakteristiske smaken. Natriumsaltet utnyttes også som smaksforsterker. Som fri aminosyre brukes den til produksjon av flere forskjellige andre aminosyrer, samt nevrotransmitteren
g-aminobutyrat (GABA) eller 4-aminosmørsyre. Asparagin binder karbohydrater i noen glykoproteiner og finnes i store mengder i noen planter, bl.a. asparges. Glutamin kan avgi aminogrupper i biokjemiske synteser og lager tverrforbindelser med lysin i proteinet fibrin når blodet skal klumpe seg.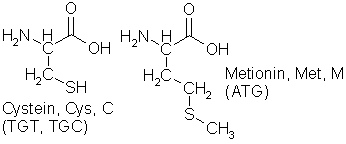
Cystein har som hovedoppgave å lage tverrforbindelser. Disse er ikke så sterke som de til lysin og glutamin, men har stor betydningen for den tredimensjonale strukturen til proteinet, den er også mye mindre krevende å lage og bryte ved en enkel redoksprosess. Metionin har som hovedoppgave å avgi metylgrupper i syntesen. Den frie aminosyren brukes også av mange organismer som startpunkt i proteinsyntesen.
Det er karakteristisk for proteiner at de har en veldefinert tredimensjonal struktur. En utstrukket eller tilfeldig sammenfoldet peptidkjede har ingen biologisk funksjon. En fundamental struktur er
a-spiralen, med 3,6 aminosyrer pr. omdreining og en avstand på 1,5 Å langs spiralaksen mellom hver aminosyre. Den stabiliseres av hydrogenbindinger mellom NH- og CO-gruppene i peptidbindingene. En slik a-spiral kan danne fibre alene eller flettes sammen i kabler, og den er også et svært vanlig strukturelement i proteiner med mindre regelmessig struktur. En annen vanlig periodisk struktur er b-skiktet, hvor aminosyrekjeden er nesten helt rettet ut, med 3,5 Å mellom hver aminosyre, og det kan dannes skikt av slike kjeder som stabiliseres av hydrogenbindinger mellom NH-grupper i en streng og CO-grupper i neste. Her vender annenhver aminosyre NH- og CO-gruppene sine mot en av nabostrengene og annenhver aminosyre mot den andre. Det finnes enkelte proteiner som så å si bare består av ark på ark av slike b-skikt, men viktigere er det at skikt på 2-3 strenger eller deromkring er et hyppig strukturelement i mange proteiner med komplisert struktur. De kan også være koblet til a-spiraler. Som nevnt er disulfidbroer mellom cysteiner viktig for strukturen av proteinet, liksom de sterke koblingene mellom lysin og glutamin. De sistnevnte dannes bare når proteinet allerede stort sett er ferdig konfigurert, men disulfidbroene dannes tidlig og er viktige for selve konfigureringsprosessen. Vanligvis er det den termodynamisk mest stabile konfigurasjonen som er den biologisk aktive, slik at det egentlig er aminosyrerekkefølgen som bestemmer konfigurasjonen og den stort sett dannes av seg selv etter proteinsyntesen.En tredje viktig periodisk struktur er kollagenspiralen. Alle flercellede organismer inneholder bindevevsproteinet kollagen, som i pattedyr utgjør mer enn en fjerdedel av alt protein. Kollagenet er den viktigste fiberstrukturen i hud, bein, brusk, sener, blodårer og tenner. Det bidrar også til å dirigere cellene i veksten og holde dem sammen i atskilte enheter og finnes i nesten alle organer. Det er uløselig i vann og danner fibre med høy strekkfasthet. Karakteristisk er også innholdet av noen modifiserte aminosyrer, hydroksyprolin og hydroksylysin. Både i bein og andre strukturer blir kollagenet seigere og hardere med tiden ved at det dannes tverrforbindelser. Aminogruppene i lysin oksyderes til aldehyder som så begår aldolkondensasjon med hverandre. Noen ganger kan disse aldolene også reagere med histidin fra andre nabogreiner. Prosessen tar noen tid, og unge individer av de fleste dyr er merkbart mykere og mindre seige enn eldre i konsistensen. Kollagen er svært motstandsdyktig mot enzymangrep, men enkelte bakterier inneholder enzymer, kollagenaser, som spalter kollagen i småstykker og hjelper dem til å trenge dypt inn i det infiserte vevet. Noen mikroparasitter bruker også slike enzymer til å trenge inn gjennom huden, mens rumpetroll, insektlarver og andre organismer som ødelegger vev under utviklingen produserer svært spesialiserte kollagenaser.
Elastin er et annet fiberprotein som utgjør hovedbestanddelen av kroppens elastiske fibre. Det kan strekkes til flere ganger sin opprinnelige lengde og vender raskt tilbake til utgangstilstanden når det slippes igjen. Mesteparten av alt bindevev inneholder elastin sammen med kollagen og polysakkarider. Store mengder er det i blodårer, særlig i aorta like ved hjertet, og i leddbåndene. Gressetere har leddbånd i nakken som er spesielt rike på elastin.
Muskler består av parallelle fibre, noen smale og noen brede. De brede består for det meste av proteinet myosin, de smale av proteinene aktin, tropomyosin og troponin. Den ene enden av aktinfibrene er festet til vegger av alfa-aktinin og fibrene strekker seg ut i to retninger fra veggene mens myosinfibrene ligger fritt mellom aktinfibrene. Det er når de myosinfibrene glir inn mellom aktinfibrene at muskelen trekker seg sammen. Myosinet har enzymvirkning og fungerer som en ATPase, d.v.s. de hydrolyserer ATP slik at energien frigjøres. Det er bygd opp som en lang alfa-dobbeltspiral med et hode i enden på hver av enkeltspiralene. Til hvert av hodene er det festet to mindre kjeder. Enzymaktiviteten sitter i hodene og det er også de som binder seg til aktinet i de smale fibrene. Når myosinhodet har bundet ATP mister det kontakten med aktinet og ligger skrått i forhold til aktinkjeden. Men etter hydrolysen har det skiftet retning og står vinkelrett på aktinkjeden. Hydrolyseproduktene (ADP og fosfat), er fremdeles festet til hodet, men hindrer ikke at det bindes til aktin lenger. Når myosinhodet er bundet til aktinkjeden igjen, frigjøres produktene, og energien fra hydrolysen gjør hodet istand til å vri seg på skrå igjen slik at myosinfiberen trekkes inn mellom aktinkjedene, og så kan et nytt ATP bindes og det begynner igjen. Muskelbruk er den mest energikrevende av alle biologiske prosesser, og et menneske som er i hardt fysisk arbeid bruker mer enn 80 % av sine energiressurser til muskelsammentrekningene. Alle andre livsprosesser må nøye seg med de øvrige knappe 20.
ATP-innholdet i muskler holder bare til en brøkdel av et sekunds arbeid. Derfor inneholder musklene til virveldyr et reservoar av fosfokreatin, hvor fosfatgruppen er bundet enda løsere enn i ATP og kan overføres til det ADP som er igjen etter ATPene av enzymet kreatinkinase. Noen virvelløse dyr bruker den liknende forbindelsen fosfoarginin i stedet. Dermed kan man arbeide intenst i et 20-talls sekunder eller mer. Ikke få sprintere og mellomdistanseløpere spiser kreatin, selv om det ikke er bevist at det hjelper noe. Men når fosfokreatinet er i ferd med å brukes opp synker ATP-konsentrasjonen og konsentrasjonen av ADP og AMP (adenosinmonofosfat, som dannes når to ADP slås sammen og gir ett ATP og ett AMP) samt fritt fosfat, stiger. Dette er et signal til å starte opp sukkerforbrenningen og øke oksygeninntaket. Rødt kjøtt er farget av myoglobin, som binder oksygen, og cytokrom, som katalyserer oksydasjonen, og er mer aerobt enn det hvite kjøttet, som inneholder mindre av disse proteinene.
Også andre celler med bevegelige strukturer som f.eks. hvite blodlegemer, flimmerhåret i tarmene og fosterceller på vandring til sine bestemmelsessteder bruker aktin og myosin. Aktinet i primitive encellede dyr som slimsopper er også forbløffende likt muskelaktinet hos virveldyrene, så dette proteinet er tydeligvis svært motstandsdyktig mot evolusjon. Aktinet utgjør en vesentlig andel av proteinet i alle dyreceller og spiller en viktig rolle for strukturstabiliteten foruten at de gjør cellen i stand til å utføre bevegelser, enten ved hjelp av myosin eller ved at aktintråder festes til yttermembranene og andre strukturer i cellen og løsnes igjen i en syklus. Planter har ikke muskler, men de bruker aktin til å forme celler i vekst. Prokaryotene, de kjerneløse cellene, har ikke aktin eller myosin.
En annen type tråder som spiller en liknende rolle er såkalte mikrotubuler, som består av proteinene alfa- og beta-tubulin. De har en diameter på ca. 240 Å, betydelig mer enn aktintrådene (70 Å). De er også hule, og er bygd opp som en tett spiral av avvekslende alfa- og betaenheter. Mikrotubuler er viktige for celledelingen, siden de brukes til å dra de kopierte kromosomene fra hverandre, men også i andre tilfelle der indre bestanddeler av cellen trenger å flyttes brukes mikrotubuler, f.eks. ved en del kjemiske produksjonsprosesser der det først lages en sekk kjemikalier som så skal slippes ut i omgivelsene. Mikrotubuler er også hovedbestanddelen av cilier og flageller hos kjerneceller, hårliknende utvekster som brukes av mange celler til diverse formål. Ciliene er en slags årer som beveger en væskestrøm forbi en celle og bl.a. vifter urenheter ut av lungene. Flageller brukes av frie celler som spermier og protozoer til fremdriftsmiddel.
Membranproteiner ligger nedsenket i cellevegger og andre membraner i cellene. De er globulære proteiner og konstruert slik at når de er riktig sammenfoldet vil den delen som er inne i membranen ha en stor del upolare, vannavstøtende aminosyrer på overflaten, mens den delen som skal stikke ut, enten på den ene eller begge sider av membranen, vil ha en stor del polare, vanntiltrekkende aminosyrer. Hvis proteinet kommer ut av stilling og får litt av den vannavstøtende delen ut i vannet eller omvendt, vil den på grunn av frastøtingen automatisk regulere seg på plass igjen. Membranproteiner kan danne åpning mot omverdenen, kan pumpe molekyler eller ioner ut og inn av cellen, kan reagere på fysiske impulser eller bestemte molekyler i omgivelsene, kan overføre energi eller ha enzymfunksjon. Mange av dem er glykoproteiner, hvor aminosyrene serin, treonin eller asparagin er bundet til et eller flere sukkermolekyler, vanligvis glykosidene N-acetylglukosamin eller N-acetylgalaktosamin. Sukkermolekylene befinner seg alltid på den ytre overflaten og hjelper proteinene til å holde seg på plass med sin sterke tiltrekning til vannet i omgivelsene. De spiller også sannsynligvis en viss rolle for immunsystemets gjenkjennelsesfunksjoner ettersom det er mulig å oppnå vide variasjoner i sammensetningen av sukkerkjedene.
En type celler som kommuniserer på en mer indirekte måte er nervecellene. De leder elektriske signaler gjennom nevronene sine og overfører signalet gjennom synapser med andre nerveceller i endene av nevronene, eller til andre celler, f.eks. muskelceller, eller de kan motta signaler fra sanseceller. En impuls overføres fra en nervecelle til en annen ved at visse ioneporter i en synapse utsettes for en transmittersubstans, som kan være forskjellige ladde molekyler, ofte acetylcholin, CH3-COO-CH2-CH2-N+-(CH3)3. Acetylcholinet produseres i nervecellene og lagres i sekker eller vesikler, som åpner seg mot omverdenen når det ankommer en nerveimpuls. Hvis tilstrekkelig mange acetylcholinmolekyler passerer det 500 Å store mellomrommet mellom nerveutløperne og binder seg til mottakercellens reseptorer, settes en ny impuls i gang og føres videre. Enzymet acetylcholinesterase hydrolyserer siden det bundne acetylcholinet, slik at prosessen kan gjentas.
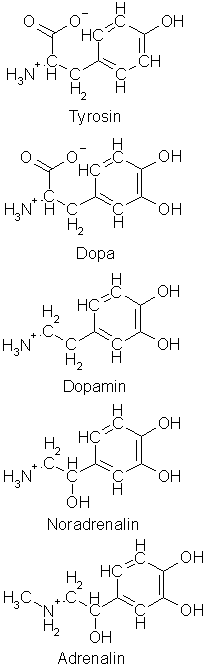
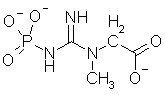
En rekke andre ladde og oftest nitrogenholdige forbindelser brukes også som nevrotransmittere. En rekke av dem lages i kroppen med aminosyren tyrosin, som utgangspunkt og kalles katecholaminer. Tyrosinet hydroksyleres til dopa, som i sin tur dekarboksyleres til dopamin, som hydroksyleres til noradrenalin, en nevrotransmitter i det sympatiske nervesystemet som virker på de musklene som trekker sammen blodårene og dermed øker blodtrykket. Noradrenalin er også et hormon som produseres i binyrene og øker hjertefrekvensen, utvider luftrørene i lungene og gjør arm- og beinmusklene sterkere under stressituasjoner. Mangel på noradrenalin har sammenheng med depresjon, og depresjoner kan derfor ofte lettes ved å tilføre medisiner som øker tilgjengeligheten noradrenalin og serotonin, en annen viktig nevrotransmitter. Noradrenalin metyleres til adrenalin, et annet hormon som produseres i binyrene og får de perifere blodårene til å trekke seg sammen, blodtrykket til å øke og hjerteslagene til å bli kraftigere. Katecholaminer inaktiveres ved metylering av ring-hydroksylgruppen i posisjon 3, eller deaminering til aldehyder.
Forskjellige nevrotransmittere kan ha forskjellig virkning i synapsene. Mottakernevronet kan ha en rekke forskjellige kanaler som kan åpnes eller lukkes av et nevrotransmittermolekyl og la ioner som klorid, kalium, natrium og kalsium slippe gjennom. Nerveceller og andre celler med spesialiserte funksjoner kan ha sine egne reseptorer som er følsomme for spesielle nevrotransmittere. Så godt som alle medisiner som brukes i psykiatri og nevrologi virker ved å blokkere eller forbedre virkningen av en eller flere nevrotransmittere, og det samme gjelder de narkotiske stoffene. Betablokkere senker blodtrykket ved å blokkere visse reseptorer i hjertemuskulaturen.
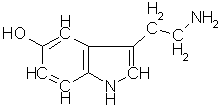
Serotonin er en nevrotransmitter som lages ved å dekarboksylere aminosyren treonin. Den har spesielt viktige oppgaver i hjernen og serotoninmangel kan føre til depresjoner og Parkinsons sykdom, mens for høyt serotoninnivå kan føre til schizofreni. Serotonin virker også hormonelt ved å trekke sammen de perifere blodårene. Blodplater som levrer seg avgir serotonin og bidrar dermed både til å stanse blødningen og dempe smertene.
Mange peptider fungerer som nevrotransmittere, spesielt i hjernen. Gode eksempler er enkefalinene, som begge består av fem aminosyrer, tyrosin-glycin-glycin-fenylalanin og så methionin i den ene og leucin i den andre. Begge virker som opiater, d.v.s. at de overfører impulser til spesielle reseptorer i synapsene som får organismen til å føle velvære.
Vasopressin er et komplisert molekyl som fungerer både som hormon og nevrotransmitter. Som hormon produseres det av hypofysen og øker blodtrykket ved å trekke sammen blodårene og øker også nyrenes evne til å gjenoppta vann. Som nevrotransmitter brukes det i hjernen, og spiller trolig en rolle i hukommelsesfunksjonene.
Gamma-aminosmørsyre, NH2-(CH2)3-COOH, fremstilles ved dekarboksylering av aminosyren glutaminsyre, NH2-CH(CH2-CH2-COOH)COOH. Den virker som en signaldempende eller hemmende nevrotransmitter ved at den lar flere kaliumioner slippe gjennom mottakermembranen.
På 1990-tallet ble det oppdaget at det uorganiske nitrogenmonoksydet (NO) også er en viktig nevrotransmitter, som har spesiell betydning for den seksuelle ereksjonsfunksjonen, men også ser ut til å spille en rolle ved de forandringene som skjer med synapsene i hjernen under læring. Molekylet er reaktivt og har kort levetid i organismen, så det trenger ikke ryddes vekk aktivt slik som de andre nevrotransmitterne. Det virker ved at det går inn i mottakernevronet gjennom et membranprotein og stimulerer enzymet guanylatsyklase til å produsere en kaskade av cAMP, som forsterker signalet.
Molekylet spiller også forbløffende mange andre roller som signalstoff i organismen. Det virker på blodtrykket, regulerer blodstrømmen og trombedannelsen og er viktig for immunforsvaret og betennelsesreaksjonene. Louis J. Ignarro, Robert F. Furchgott og Ferid Murad fikk nobelprisen i 1998 for oppdagelsen av NO som signalstoff i blodomløpet.
Foruten de strukturelle proteinene og membranproteinene finnes en god del plasmaproteiner som flyter fritt i plasmaet. En klasse av dem er de globulære eller kuleformede proteinene, som har forskjellige funksjoner, men en spesielt viktig gruppe er immunoglobulinene, også kalt antistoffer. De lages av dyr til forsvar mot fremmede makromolekyler, som f.eks. proteiner, polysakkarider og nukleinsyrer. Slike fremmede stoffer kalles antigener og for hvert antigen som påtreffes i kroppen lages et spesifikt antistoff mot det molekylet. Små fremmede molekyler fører ikke til noen slik reaksjon, slike molekyler er ofte noe kroppen kan nyttiggjøre seg og går direkte inn i stoffskiftet.
Antistoffer lages i plasmaceller, som er omdannede B-lymfocytter. Fra den tidligste begynnelsen av et dyrs liv produseres alle mulige kombinasjoner, men de B-lymfocyttene som påtreffer antigener før de er modne dør. Dermed elimineres de lymfocyttene som produserer antistoffer for dyrets egne makromolekyler. Når de er modne blir de derimot stimulert av å treffe et antigen, de blir til plasmaceller som produserer store mengder immunoglobulin og begynner å dele seg. Det er fem typer immunoglobulin, som alle produseres av de samme cellene og skiller seg fra hverandre med forskjellige konstante deler. Den ene, immunoglobulin M, produseres mest de to første ukene etter en infeksjon, deretter overtar immunoglobulin G (også kalt gammaglobulin). Immunoglobin A skilles ut i spytt, tårer og tarm- og lungeslimhinnesekreter og danner det ytterste forsvaret mot fremmedstoffene. Immunoglobulin D (175 kD) er det ikke kjent hva som er vitsen med og det siste, immunoglobin E (200 kD) ser ut til bare å være til bry, siden det spiller en hovedrolle i allergireaksjoner.
En rekke andre bestanddeler inngår også i immunsystemet. B-lymfocyttene er avhengig av samarbeide med en rekke andre celler for å fungere, og er ikke virksomme mot virus når de ligger skjult i kroppens egne celler. Men virusene legger ofte igjen proteindekselet sitt på utsiden når de går inn i cellen, og dette benyttes av en underart av en annen lymfocytt, T-cellene, som har reseptorer på overflaten som produseres på omtrent samme måte som antistoffene og derfor er like variable. Disse cellene kan ødelegge de av kroppens egne celler som har slike virusrester på overflaten.
Disse T-cellene har også reseptorer som passer til en tredje type variabelt protein, nemlig hovedhistokompatibilitetskompleks-proteinene, eller MHC blant venner. Disse proteinene sitter på overflaten av alle kroppens celler og er like for alle cellene i en organisme, men vanligvis forskjellige fra individ til individ. De tjener som kjennemerke for kroppens egne celler, og transplantert vev hvor MHC-proteinene er for forskjellige fra kroppens egne blir betraktet som fremmed og angrepet av immunsystemet. Det er flere forskjellige typer eller klasser av MHC-proteiner. Hos nære slektninger er de som regel ganske like (men ikke alltid), og transplantasjoner mellom nære slektninger vil derfor oftere være vellykket enn ellers.
Hemoglobin er et middel som virveldyrene bruker til å kompensere for den dårlige løseligheten av oksygen i vann. En liter blod uten hemoglobin kan løse 5 ml oksygengass, men med hemoglobinet frakter den en kvart liter! Myoglobinet, som finnes i musklene, fungerer som et reserveforråd av oksygen og hjelper til med å transportere oksygenet rundt i musklene. Begge er proteiner, av den globulære typen, men til oksygentransporten har de knyttet et annet molekyl (prostetisk gruppe), nemlig hem, et porfyrinderivat som inneholder sykliske aminer med sure hydrogener som kan binde et metallatom, i dette tilfellet jern, som gir både blodet og musklene (kjøttet) den røde fargen:

Porfyrinet er et plant molekyl med mange dobbeltbindinger som har sterk resonansstabilisering, særlig når den har bundet metall. Når jernet i midten er toverdig kan det også binde et oksygenmolekyl. Jernet kan også oksyderes til treverdig, men fungerer da ikke som oksygenbærer. Jernet er kompleksbundet til de 4 nitrogenatomene. I kompleksforbindelser har jern 6 posisjoner hvor det kan danne bindinger med andre atomer. Den femte, utenfor porfyrinplanet, opptas av et nitrogenatom på aminosyren histidin i proteinet. Den sjette, på motsatt side, står fri til det ene atomet i oksygenmolekylet. Det henger et annet histidin like over denne plassen, som bidrar til å hindre at to hem-grupper kan møtes, noe som er en forutsetning for at jernet skal oksyderes, og for å vanskeliggjøre binding av andre molekyler som skader oksygenopptaket, som karbonmonoksyd, karbontetraklorid og DDT, for eksempel. Hemet og andre porfyriner (som klorofyll) lages av aminosyren glycin og ravsyre, et av mellomproduktene i sukkermetabolismen. Når et rødt blodlegeme dør blir hemet i hemoglobin spaltet og rullet opp til en kjede av pyrrolringer, jernatomet fraktes til ferritinproteiner som lagrer jern, mens det spaltede hemet omdannes til bilirubin som kan utskilles, fortrinnsvis gjennom gallen. Et blåmerke etter slag består av blod fra de årene som ble sprengt av slaget. Neste gang du slår deg kan du studere de gradvise overgangene fra hem via mellomformen, det grønne biliverdinet, til det rødbrune/gulbrune bilirubinet.
Hemet brukes også i myoglobin, som lagrer oksygen i musklene, og i cytokrom-proteinene, en mangfoldig klasse proteiner som brukes av alle åndende organismer til å overføre oksydasjonspotensiale fra oksygenmolekyler til de substansene som skal nedbrytes i forbrenningen.
Enzymer er spesielle proteiner som er spesialbygd til å utføre eller katalysere bestemte kjemiske reaksjoner som er nødvendig for de levende organismene. Få kjemiske reaksjoner i biologiske systemer går uten enzymenes katalytiske hjelp, de har enorme katalytiske evner og kan akselerere en reaksjon med en faktor på flere millioner. Enzymene virker ved at de binder et eksemplar av det molekylet de skal virke på (substratet) i en posisjon på enzymmolekylet som er bygd spesielt for å gi plass til akkurat et slikt substratmolekyl og binde det med forholdsvis svake krefter, som hydrogenbindinger og elektrostatisk tiltrekning til reaksjonen er over. Ofte er ikke de vanlige funksjonelle gruppene til aminosyrene som enzymproteinet er bygd av nok til å få istand den nødvendige reaksjonen, og mange enzymer er derfor modifisert med en såkalt prostetisk gruppe eller er avhengig av et lite molekyl, et såkalt koenzym, som det virker sammen med under reaksjonen. Koenzymet blir gjerne forandret under reaksjonens løp, ofte oksydert eller redusert, og blir siden reparert et annet sted i cellen for å komme tilbake til den virksomme formen igjen. Enzymnavn slutter vanligvis på -ase. Resten av navnet tas gjerne fra substratmolekylet, f.eks. er ATPase et enzym som gjør noe med ATP, og ofte tas det også med noe om hva enzymet gjør, f.eks. er mutaser enzymer som flytter en atomgruppe på et molekyl og kinaser er enzymer som flytter en fosfatgruppe fra et molekyl til et annet. Hypoxantinguaninfosforibosyltransferase er som navnet enkelt sier et enzym som overfører en fosforibosylgruppe til hypoxantin eller guanin (for å danne nukleotidene inosinfosfat og guanosinfosfat).
Noen enzymer og andre proteiner lages bare i et inaktivt forstadium og aktiviseres etter behov, f.eks. ved å splitte peptidkjeden på et bestemt punkt eller andre modifikasjoner. Eksempler er bukspyttkjertelens og magesekkens enzymer som hydrolyserer protein i fordøyelsen og bare er aktive når det er mat til stede, de som får blod til å levre seg ved kontakt med luft, de hormonene som er bygd opp av peptider og bare brukes til spesielle formål, samt strukturbyggende proteiner som transporteres til "byggeplassen" i en uvirksom, men vannløselig form. Mange enzymer reguleres f.eks. ved at sluttproduktet i en syntese inaktiverer det enzymet som katalyserer et av de tidligere syntesetrinnene eller ved at det lages visse molekyler som inaktiverer dem, enten ved å konkurrere ut substratet eller ved å binde seg til et spesielt inhibisjonssted på molekylet. Enzymer opptrer også som kroppens banksystem, ved at de konverterer forskjellige typer energi til kroppens energivaluta, ATP, med en høy grad av effektivitet.
Koenzym A brukes av flere enzymer til å overføre acetylgrupper eller andre beslektede grupper ved mange reaksjoner i biologisk syntese og spiller en særlig viktig rolle i forbrenningen. Det likner ATP til et visst punkt:
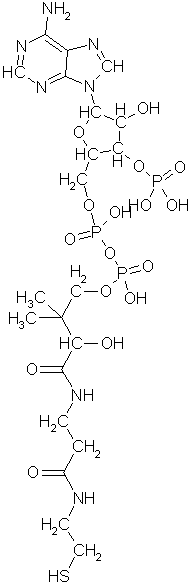
Merkaptangruppen nederst på molekylet er stedet hvor acetyl- og de andre gruppene bindes for senere overføring. Molekylet er satt sammen av tre deler, den øverst på figuren stammer fra ATP, den nederste fra 2-aminoetantiol, mens den i midten stammer fra pantotensyre, CH2OHC(CH3)2CHOHCONHCH2CH2COOH (eller N-(2-karboksyetyl)-2,4-dihydroksy-3,3-dimetylsmørsyreamid om du foretrekker det). Pantotensyre hører til en gruppe forbindelser som dyrekropper ikke er noe spesielt flinke til å lage selv og derfor må tilføres utenfra. Nesten alle er vesentlige råstoffer for koenzymer til viktige enzymer. Med et fellesnavn kalles de vitaminer, fordi man opprinnelig trodde at alle inneholdt nitrogen, og fikk tidlig bokstavbetegnelser. De deles gjerne inn i de fettløselige A, D, E, F, K, og vannløselige B, C, H, P, PP, T. B er siden skilt ut i en rekke vidt forskjellige stoffer, som ikke fikk sine egne bokstaver, men bare nummersubskripter på B'en. Pantotensyre regnes gjerne for å høre til dette B-komplekset. Som vitaminer regnes alle livsnødvendige stoffer som ikke primært brukes som energikilde og som er essensiell for organismen, d.v.s. at den ikke kan danne det selv eller ikke kan danne det i tilstrekkelige mengder. Det som er vitamin for en organisme kan ofte være likegyldig for en annen. F.eks. er paraaminobenzosyre vitamin for en del bakterier, som kan bygge vårt vitamin folsyre ut fra den, derfor har sulfanilamid eller paraaminobenzosulfonsyre vært brukt mot bakterieinfeksjoner. Til tross for navnet inneholder ikke alle vitaminer nitrogen. Stort sett er det bare B-komplekset som er nitrogenholdig.
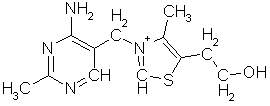
Vitamin B1 eller tiamin fosforyleres i kroppen (i OH-gruppen) til tiaminpyrofosfat, hjelper enzymene pyruvatdehydrogease til å bidra til produksjonen av koenzym A,
a -ketoglutaratdehydrogenase til å bidra i sukkerforbrenningen og transketolase til å omdanne sukkermolekyler som brukes til forbrenning eller nukleotidbygging eller liknende. Mangel fører til beri-beri, som karakteriseres ved smerter i bein og armer, muskelsvakhet og uregelmessigheter i følsomheten i huden. Hjertet kan være forstørret og ha svekket pumpefunksjon. Beri-beri har vært et stort problem i Asia fordi ris er en dårlig tiaminkilde, spesielt ved bruk av polert ris, siden det meste av det tiaminet som finnes i risen sitter i skallet.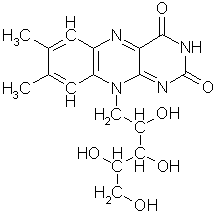
Vitamin B2 eller riboflavin består av en flavin-trippelring + en utrullet riboseenhet. I kroppen omdannes det til flavin-adenin-dinukleotid (FAD) ved at et molekyl adenosindifosfat fosforyleres inn på OH-gruppen nederst på tegningen. FAD brukes av en rekke enzymer til redoksreaksjoner i forbrenningsprosessene, og kan også være innblandet i syntese av umettede fettsyrer i noen organismer. Oksydasjon skjer ved at nitrogenet øverst på midtringen og nederst på uracilringen til høyre begge tar opp et hydrogenatom mens dobbeltbindingene til nabokarbonene blir enkle. Dermed dannes FADH2, som kan utføre en reduksjon ved å avgi hydrogenene igjen. Kroppen bruker også riboflavin til å lage flavin-mononukleotid (FMN), ved å koble en enkel fosfatgruppe på den nederste OH-gruppen. FMN virker på samme måte som FAD, og brukes av et enzym i respirasjonsprosessen.
Vitamin B12 eller kobalamin har den samme plane, pyrrolbaserte grunnstrukturen som hemet i hemoglobin, men er en smule mer komplisert:

Den plane porfyrinliknende strukturen i midten kalles corrin og binder et koboltatom der hemet har et atom jern. På den ene siden av ringplanet er koboltatomet koordinert til et karbon i sukkerdelen av et nukleosid, adenosin (den eneste metall-karbonbindingen som er kjent i et biologisk molekyl). På den andre siden koordineres det til et nitrogen i nukleotidet dimetylbenzimidazidolfosfat som er bundet til ringen med en amidbinding. Det er også mange andre amidgrupper på ringen. Den aktive formen som er vist her har kobolt i oksydasjonstrinn +1. Koboltatomet kan også ha trinnene +2 og +3. I den sistnevnte, som er den vanlige inaktive formen er et hydroksylion koordinert til koboltatomet i stedet for den frie adenosingruppen. Forskjellige flavoproteiner katalyserer overgangen mellom de forskjellige trinnene. Kobalamin brukes av forskjellige enzymer som omarrangerer karbonskjelettet i forskjellige molekyler og dessuten de som binder metylgrupper til substratet. Når de er i aktivitet brytes Co-C-bindingen i kobalaminet og en metylgruppe eller et karbonatom på substratet bindes der i stedet. Ved omarrangeringer spaltes gjerne substratmolekylet slik at den delen som er bundet til koboltatomet kan flyttes til et annet sted på molekylet. Mange enzymer som katalyserer syntese og nedbrytning av aminosyrer har kobalamin som prostetisk gruppe.
Som vitamin B13 regnes gjerne orotinsyre:
Denne brukes i kroppen til å lage uracil-nukleotider. Den lages også av asparaginsyre, og kan vanskelig regnes for essensiell, som de regulære vitaminene.
Vitamin B14 eller xantopterin kan i kroppen omdannes til folsyre, se nedenfor. Xantopterinet er dobbeltringen til venstre på illustrasjonen.
Et antatt vitamin er pangaminsyre eller N,N-dimetylglycin, (CH3)2NCH2COOH, som betegnes vitamin B15 og har vært antatt å spille en rolle ved produksjon av aminosyrer og i glukoseforbrenningen og muligens kan fungere som antioksydant, kan senke blodkolesterolet og forbedre blodsirkulasjonen, men ingen slik virkning er fastslått.
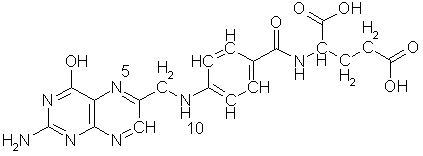
Folsyre eller pteroylmonoglutaminsyre eller vitamin Bc omdannes i kroppen til tetrahydrofolsyre eller folinsyre ved at de fire atomene lengst til høyre i den midterste av de tre ringene på tegningen tilføres hydrogen mens dobbeltbindingene reduseres til enkle. Dette koenzymet brukes av mange enzymer til å overføre grupper med ett karbonatom på nitrogenet i posisjon 5 og/eller 10 som er markert på tegningen. Gruppene som kan fraktes er metyl, -CH3, metylen, -CH2-, formyl, -CHO, formimin, -CH:NH eller metenyl -CH=. Blant produktene er aminosyrene metionin og glycin, purinbaser og thymin, og koenzymet brukes også til å frakte vekk slike smågrupper ved nedbrytning av forskjellige stoffer.
Til B-komplekset regnes også gjerne cholin, (CH3)3N+CH2CH2OH, som inngår i membrandannende fosfoglyserider (se under lipidkapitlet) og i den universale nevrotransmitteren acetylcholin. Men cholin kan også dannes i kroppen av aminosyren serin, iallfall for fosfoglyserider, ved dekarboksylering og metylering. Forbruket som nevrotransmitter er heller ikke stort, siden molekylet ustanselig resirkuleres i synapsene.
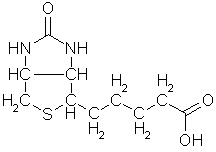
Biotin eller vitamin H regnes også til B-komplekset. Det brukes som prostetisk gruppe av mange aminosyrer til å frakte aktivert karbondioksyd som er fjernet fra dekarboksylerte molekyler og/eller skal brukes til karboksylering av andre molekyler. Karboksylgruppen i biotinet bindes med en amidbinding til aminosyren lysin i enzymet og binder karbondioksydet som en karboksylgruppe på nitrogenet øverst til venstre på tegningen. Slik karboksylering/dekarboksylering er bl.a. viktig i sukkerforbrenningen, fotosyntesen, fettsyresyntesen, produksjon av ribose utfra heksoser og mange andre livsviktige funksjoner.
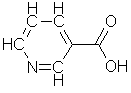
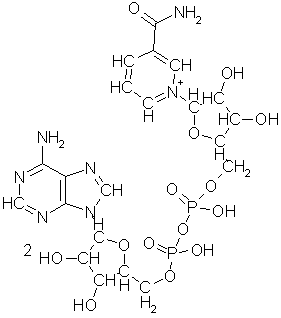
Nikotinsyre eller niacin kalles også vitamin PP og regnes for å høre til B-komplekset. Det omdannes i kroppen til nikotinamid (eller nikotinsyreamid) og hektes på en ribosefosfatenhet i ringnitrogenet og denne bindes til et adenosinmonofosfat gjennom fosfatgruppene slik at resultatet er nikotinamid-dinukleotid, som vist til høyre, blant venner kjent som NAD. Sammen med varianten nikotinamid-dinukleotidfosfat eller NADP, som har en ekstra fosfatgruppe bundet til adeninribosen i posisjon 2 (markert på figuren), er NAD universal-redoksreagensen i livsprosessene. I formen på tegningen er ringnitrogenet i nikotinamidet positivt ladet og kan derfor opptre som fireverdig. Denne formen betegnes NAD+. Ladningen destabiliserer molekylet, selv om det er ganske stabilt på grunn av benzenringresonansen. Derfor kan det lett oppta et ekstra hydrogen i den motsatte posisjonen av ringen selv det fører til at den mister resonansstabiliseringen og bare har en dobbeltbinding på hver side som vist på tegningen til venstre her. Denne reduserte formen betegnes NADH. Tilsvarende NADP+ og NADPH for den ekstra fosforylerte formen. De brukes i en rekke reaksjoner under sukkerforbrenningen og en mengde andre reaksjoner som er for tallrike til å oppregnes her. Som de andre redoksmidlene eller antioksydantene i kroppen er de viktige for å nøytralisere giftige eller kreftfremkallende stoffer vi får i oss i vår forurensede hverdag.
Karnitin, (CH3)3N+CH2CHOHCH2COOH, eller vitamin T, brukes til å frakte fettsyrer til oksydasjon i mitokondriene og sannsynligvis til å frakte acetyl-koenzym A ut fra mitokondriene til fettsyresyntese ved å binde dem til OH-gruppen.
Arbeidstegningen for oppbygningen av alle disse proteinene ligger i cellekjernene, eller frittsvømmende i plasmaet i de cellene som ikke har noen kjerne, i form av nukleinsyrer. I kromosomene er nukleinsyre (latin nucleus = kjerne), DNA (deoksyribonukleinsyre), viklet opp på basiske proteiner som kalles histoner og har holdt seg forbløffende uforandret gjennom livets utviklingshistorie, en av de 5 histontypene i erter skiller seg fra det samme histonet i kveg på bare 2 av de 102 aminosyrene. Nukleinsyren og histonet sammen kalles kromatin, og fordeler seg i klumper som kalles nukleosomer. Nukleosomene er igjen stablet til kromosomer på en måte som ikke er helt godt kjent, muligens som en spiral rundt en sentral proteinkjerne. Dette arrangementet brukes av alle kjente kjerneceller.
Nukleinsyrer består av lange kjeder av nukleotider. Et nukleotid består av en sukkerart, ribose eller deoksyribose, koblet sammen med en fosfatgruppe forestret i 5-posisjonene, og med en heterosyklisk nitrogenbase koblet til posisjon 1. En sammensetning av bare base og sukker kalles nukleosid. Når nukleotidene kobles sammen til nukleinsyrer forestres OH-gruppen i 3-posisjonen i sukkeret med fosfatgruppen i det neste nukleotidet. Kjeden har altså to forskjellige ender, en hvor det sitter en fosfatgruppe på et sukker i 5-posisjonen og en hvor en OH-gruppe i 3-posisjonen til et sukker er fri.
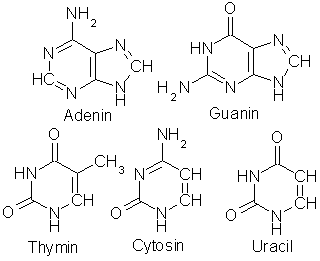
Det er basene som er det variable og informasjonsbærende elementet i nukleinsyrene. Alle er nitrogenholdige. I DNA er det bare fire forskjellige, to purinliknende, adenin og guanin, og to pyrimidinliknende, thymin og cytosin. RNA er en annen slags nukleinsyre (ribonukleinsyre), som inneholder ribose i stedet for deoksyribose og bruker uracil i stedet for thymin. I hver base er det den nederste imingruppen på tegningen som er koblet til sukkermolekylet. Nukleosider som er bygd opp av base og ribose heter adenosin, guanidin, thymidin, cytidin og uridin, og navnet på nukleotidene som også inneholder fosfat fås bare ved å legge til leddet -fosfat, adenosinfosfat, guanidinfosfat o.s.v. I DNA er nukleosidene sammensatt av base og dekosyribose og heter deoksyadenosin, deoksyguanosin, deoksythymidin og deoksycytidin, og de fosforylerte nukleotidene heter deoksyadenosinfosfat, deoksyguanosinfosfat o.s.v. Men når nukleotidene er koblet sammen til nukleinsyrer betegner man dem gjerne med forbokstavene til basene, A, G, T og C i DNA og A, G, U og C i RNA. I en nukleinsyrekjede er endepunktene forskjellige. Når man regner opp en sekvens av nukleotider i en nukleinsyre begynner man alltid fra fosfatenden av nukleinsyrekjeden, fordi det er denne retningen DNA bygges opp i under celledelingen og den samme retningen bygges proteinene opp i under proteinsyntesen.
I kromosomene ligger DNAet alltid sammenkoblet i en dobbeltspiral med en annen streng DNA som har en komplementær sekvens av nukleotider, der hvor det ene DNAet har A, G, T og C, har det andre henholdsvis T, C, A og G. Derfor passer de nøyaktig inn i hverandre og kan fungere som mal og støttepunkt for hverandre. To av disse komplementære basene som passer inn i hverandre på hver sin komplementære DNA-streng kalles et basepar. I dobbeltspiralen er de to enkeltstrengene koblet motsatt vei, d.v.s. at i begge endepunktene slutter den ene med en OH-gruppe i 3-posisjonen på deoksyribosen mens den andre slutter med en fosfatgruppe på 5-karbonet i deoksyribosen.
Når en celle deler seg trenger begge dattercellene en kopi av DNAet, og derfor vikles det opp under celledelingen, de to strengene skilles fra hverandre og et enzymkompleks syntetiserer to nye DNA-strenger som er komplementære med hver av de to andre. Polymerisering av DNA skjer automatisk i en vannløsning som inneholder en enkel DNA-streng, et DNA-polymerase-enzym og et godt utvalg frie nukleotider. Disse råvarenukleotidene er trifosfater, og energien som fås ved å spalte av to fosfatgrupper fungerer som drivkraft for reaksjonen.
Det finnes endonukleaser som kan finne og starte reparasjon av mange typer skader på arvestoffet. Så lenge bare den ene strengen av DNA er skadd er det enkelt å reparere på grunnlag av den andre. Men hvis begge basene i et basepar ødelegges er det verre, for en celle kan ikke gå inn i en annen celle og hente informasjon fra det uskadde DNAet der. Det kan også hende at skadene er så omfattende at de vanlige reparasjonsmekanismene bare fungerer så noenlunde. Heldigvis har DNAet mange ikke-kodende sekvenser som kan skades uten at det gjør noe. Koden er dessuten slik at flere liknende koder står for den samme aminosyren, så et basepar kan forandres uten at det nødvendigvis betyr noe for proteinsyntesen. Hvis et gen likevel skulle bli ødelagt betyr det ikke noe for de andre genene, for alle er markert med sine egne start- og stoppkoder. Endelig fungerer mange av aminosyrene i de fleste proteiner bare som fyllmateriale, så hvis en enkelt aminosyre byttes ut, betyr det ikke nødvendigvis noe for funksjonene til proteinet, og hvis det betyr noe likevel, fører det ikke nødvendigvis til at proteinet fungerer noe særlig dårligere. Det kan til og med føre til at det fungerer bedre.
Hvis et av proteinene som er livsviktig for cellen blir ødelagt, kan cellen dø, slik at det ikke betyr noe for resten av kroppen. Hvis et av proteinene som ligger i cellens overflate blir forandret kan det hende at den oppfattes som fremmed av immunsystemet, slik at det dreper den. Hvis cellen blir mindre funksjonsdyktig av forandringen kan det hende at den blir ødelagt av de belastningene kroppen utsettes for. Hvis ikke noe av dette hjelper, har kroppen fått en genetisk skade som kanskje gjør den merkbart mindre funksjonsdyktig, kanskje ikke. Det skal mye til om en enkelt celle kan gjøre noe for kroppsfunksjonene som helhet. Ved ekstrem uflaks kan det hende at de proteinene som styrer cellens innordning i kroppssystemet skades, slik at den kommer ut av kontroll. Da kan den begynne å dele seg ukontrollert, slik at det oppstår en svulst, som kan være god- eller ondartet. Kroppen vil kunne registrere den som fremmed og forsøke å innkapsle den slik at den blir ufarlig, og klarer kanskje å uskadeliggjøre eller drepe den. Men hvis ikke, kan det føre til at hele kroppen går til grunne.
For hvert av proteinene som kroppen trenger er det et gen i kromosomene som forteller hvordan det skal settes sammen, aminosyre for aminosyre. Signalet til produksjonen kan gis på forskjellige måter, f.eks. kan et hormon eller et stoff som det trengs et protein for å behandle binde seg til et bestemt reguleringsprotein som er laget for å skjerme startsekvensen til genet og løsne det fra genet, en signalsubstans som produseres ved visse kjemiske forhold i cellen kan bindes til en såkalt promotorsekvens som begunstiger proteinproduksjonen, eller et produkt som det nye proteinet lager kan binde seg til regulatorproteinet og få det til å skjerme startsekvensen. Produksjonen av enkelte aminosyrer reguleres ganske finurlig ved at genene for de enzymene som produserer dem har en attenuatorsekvens som består av flere kopier av koden for den aminosyren, og bare når det er så lite av denne aminosyren at produksjonen av denne sekvensen går i stå, fortsetter produksjonen med resten av genet.
Det er RNA som spiller hovedrollen i proteinbyggingen. Denne jobben fordeles på tre typer RNA som kalles budbærer-RNA, overførings-RNA og ribosomer. Et stort enzym som kalles RNA-polymerase og er oppdelt i flere smådeler med forskjellige funksjoner finner fram til den DNA-sekvensen som markerer starten på genet, vikler opp DNAet i en lengde av ca. 10 basepar og begynner å produsere en RNA-kopi av genet. Denne kopien kalles budbærer-RNA.
Denne genmodellen fraktes vanligvis ut av cellekjernen (hvis cellen har en kjerne), gjerne i mer eller mindre sterkt modifisert tilstand. Her bygges proteinene ved hjelp av minst 20 forskjellige molekyler av overførings-RNA. Alle er på 73 til 93 nukleotider og har fire komplementaritets-sekvenser slik at de kan krølles sammen til dobbeltspiraler i fire sekvenser med tre åpne løkker mellom sekvensene. I den midterste løkka står det ut tre baser som er spesielle for hver av variantene av overførings-RNA. Dette er kodeordet som skal passe til et tilsvarende kodeord på budbærer-RNAet. De tre basene på overførings-RNAet kalles antikodonet mens de tre på budbærer-RNAet kalles kodonet. Hvis kodonet f.eks. er UAC er antikodonet AUG. I motsatt ende stikker en løs ende ut som består av sekvensen CCA, og den siste ribosen (som altså er bundet til adenin) har forestret en aminosyre i 3-posisjonen, nemlig den som det aktuelle antikodonet koder for.
En gruppe på minst 20 enzymer som kalles aktiveringsenzymer kobler riktig aminosyre til det riktige overførings-RNAet. Når to aminosyrer er ganske like, som valin og isoleucin (se under) kan enzymet koble feil opptil 1 av bare rundt 3000 ganger, men det sjekker adenylatet for feilkoblinger og kan finne på å bruke særegenheter ved det spesifikke overførings-RNAet til å spalte adenylatet igjen. Mange av aktiveringsenzymene har både syntese- og hydrolysepunkter, i syntesepunktene får bare de aminosyrene som ikke er for store plass, mens i hydrolysepunktene, hvor en adenylatbinding kan brytes, er det bare plass til de aminosyrene som er for små. Når enzymet har lagd et adenylat i syntesepunktet blir det ført inn i hydrolysepunktet for sjekking. Hvis det er for stort til å komme inn der klarer det seg unna hydrolysen og blir ført videre til overførings-RNAet.
Selve proteinbyggingen skjer i ribosomene, som selv består av ca. 55 forskjellige proteiner og 3-4 ganske store RNA-molekyler, som utgjør hoveddelen av massen. Både dette og overførings-RNAet produseres etter modell av DNA-gener på andre stadier av prosessen. Både ribosomgenene og genene til histonene som brukes til å pakke sammen kromosomer er naturlig nok noen av de viktigste genene og befinner seg i spesialiserte regioner på kromosomet hvor de blir gjentatt opptil hundre ganger. I celler med kjerne produseres de også av sine egne RNA-polymeraser.
Ribosomene er satt sammen av to ulike store halvkuler. De har to hulrom hvor et overførings-RNA får plass, og i starten får et spesielt initiator-RNA plass i det ene hulrommet. Nå kommer resten av ribosomet på plass, og i det andre hulrommet på ribosomet, A-(aminoacyl-)punktet, er det plass til et overførings-RNA som passer til den neste koden på budbærer-RNAet. Et protein som kalles "forlengelsesfaktor-Tu" leverer den rette kandidaten til ribosomet. Aminosyrene som henger på overførings-RNAene stikker ut av ribosomet i motsatt ende av budbærer-RNAet, og et enzym som kalles peptidyl-transferase og finnes i ribosomet danner en peptidbinding mellom aminogruppen til den sist ankomne aminosyren og syregruppen til molekylet som er festet i P-punktet og løsner det fra RNAet som er festet der. Et annet protein som kalles forlengelsesfaktor G forskyver ribosomet til det neste ledige kodonet på budbærer-RNAet samtidig som det avkoblede RNA-molekylet forskyves ut av P-punktet og det sist ankomne overførings-RNAet, som er tilkoblet den hittil syntetiserte peptidkjeden, flyttes fra A-punktet til P-punktet. Dermed kan neste runde begynne. Syntesen slutter når ribosomet kommer til en stoppkode som kan være UAA, UGA eller UAG. Normale celler har ikke overførings-RNA som passer til disse kodonene, i stedet er det visse proteiner, frigjøringsfaktorene som binder seg til stoppkodene og frigjør den ferdige peptidkjeden.
Løse nukleotider er ikke bare råstoff for DNA- og RNA-produksjon. Adenosintrifosfat (ATP) spiller en nøkkelrolle i energiomsetningen ved at difosfatversjonen av molekylet tar opp energi fra energiproduserende prosesser ved å binde et tredje fosfatgruppe (fosforylering) og blir tilgjengelig for å avlevere energien igjen ved hydrolyse (defosforylering) hvis det er behov for den der molekylet tilfeldigvis befinner seg. Men mange andre løse nukleotider spiller også viktige roller i kroppskjemien, alle er ribonukleotider og ikke deoksyribonukleotider. Guanosintrifosfat (GTP) dannes ved fosforylering under sukkerforbrenningen i ett av trinnene i sitronsyresyklusen, det forbrukes på tilsvarende måte under nyproduksjon av sukker, glukoneogenese, samt ved sammenkoblingen av de to delene av ribosomene under proteinsyntesen og brukes til signalforsterking ved synsprosessen. Uridintrifosfat (UTP) brukes til aktivering av molekyler som skal bindes til andre molekyler i diverse synteser. Cytidintrifosfat (CTP) brukes til samme formål under syntese av fosfolipider, hovedbestanddelen av celleveggene.
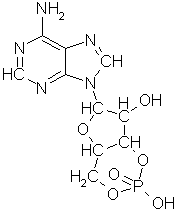
Syklisk adenosinmonofosfat (cAMP) er et interessant modifisert nukleotid som brukes til en rekke viktige funksjoner i kroppen. En av de viktigste er som forsterkning av signalene fra hormoner som ikke trenger inn i cellene. Disse hormonene fester seg til en hormonreseptor som sitter i cellemembranen og stimulerer enzymet adenylatsyklase som sitter på innsiden av membranen slik at det dannes cAMP inne i cellen. For hvert hormonmolekyl dannes det mange cAMP, slik at effekten forsterkes. cAMP virker generelt ved at det binder seg til spesielle enzymer som er inaktive hvis de ikke er bundet til cAMP. cAMP finnes også i bakterier, og har tydeligvis en flere milliarder år lang forhistorie som reguleringsmolekyl. Bakteriene lager cAMP når de har brukt opp glukosen sin og må stimulere syntesen av visse proteiner for å utnytte andre energikilder. Den er altså opprinnelig et sultsignal, og brukes også til å stimulere nedbrytning av lagrede polysakkarider i flercellede organismer (f.eks. glykogen i muskler og lever) når hormoner som glukagon og adrenalin melder at det er behov for energi. Et tilsvarende nukleotid, syklisk guanosinmonofosfat (cGMP), ser ut til å ha liknende funksjoner i synsprosessene.

Det er Sola som gjennom plantenes fotosyntese gir opphav til praktisk talt all tilgjengelig biologisk energi på denne planeten. I grønne planter foregår fotosyntesen i kloroplaster, rundt 5 mikrometer store spesialiserte celledeler som i likhet med mitokondriene har eget DNA og antakelig stammer fra encellede organismer som er blitt inkorporert av plantene en gang i løpet av evolusjonshistorien. Som mitokondriene har de også to omsluttende membraner, en ytre og en indre og et mellomrom mellom dem. I det indre ligger det thylakoide membransystemet, masser av små flattrykte sekker som er stablet oppå hverandre omtrent som i tappene i øyet. Noen steder er det tverrforbindelser mellom to av stablene. Thylakoidene består av omtrent like mye protein som lipid. Nesten halvparten av lipidet er galaktolipid, hvor den vannkjære delen er sukkerarten galaktose. Et kvant lys skinner inn på kloroplasten og treffer en thylakoidsekk hvor den absorberes av et molekyl klorofyll, en porfyrinforbindelse som har stor likhet med hemet i hemoglobin, men metallatomet som holdes fanget i midten er ikke jern, det er magnesium. Klorofyllet som er avbildet her kalles klorofyll a. Det finnes også en type b som bare avviker fra a ved at metylgruppen øverst til høyre på figuren er byttet ut med aldehyd. Forøvrig er det mest upolare grupper som ikke liker seg sammen med vann. Det er to estergrupper, en metylester og en ester av en lang isoprenkjede som gjør molekylet ekstra vannavstøtende. Klorofyllmolekylet har som mange andre molekyler med alternerende dobbelt- og enkeltbindinger sterke absorpsjonsbånd i den synlige delen av lysspekteret, som "tilfeldigvis" også er den delen av sollyset som best trenger gjennom atmosfæredypet. Klorofyll a og b absorberer i hvert sitt område av spekteret, a for en en stor del i det røde og b i det blå, mens det grønne for en stor del er udekket. Derfor ser ting som inneholder klorofyll, som løv, barnåler, kaktusskinn og alger grønne ut hvis de ikke også inneholder andre sterke pigmenter, og klorofyllet har også på norsk vært kalt bladgrønt, en direkte oversettelse av det greske klorofyll. Ekstinksjonskoeffisienten for klorofyllene, et mål for absorpsjonsevnen, er på det maksimale 100000 pr. cm og mol, noe av det høyeste som er målt for en organisk forbindelse.
Cellemembraner består for det meste av fosfolipider, fettmolekyler hvor det er forestret to vanlige fettsyrer til glyserolet, men i stedet for den tredje er det en fosfatgruppe som også har forestret en polar, nitrogenholdig alkohol til seg. Hvis den polare alkoholen er serin, kalles molekylet fosfatidylserin, som kan omdannes til fosfatidyletanolamin ved dekarboksylering og videre til fosfatidylcholin ved metylering. Men fosfatidyletanolamin og fosfatidylcholin kan også lages. Disse fosfolipidene kalles lecitiner. En annen gruppe fosfolipider kalles plasmalogener og skiller seg fra lecitinene ved at de har eterbundet en alkohol med dobbeltbinding i 1,2-posisjonen til 1-posisjonen i glyserolen i stedet for en fettsyre. En tredje type fosfolipider er sfingolipidene, som i stedet for glyserol bruker sfingosin som ryggrad. Sfingosinet har strukturen C13H27CH=CHCH(OH)CH(NH2)CH2OH, med en lang upolar kjede i tillegg til de tre bindingspunktene, hvor det midtre har en aminogruppe i stedet for alkoholgruppen som glyserolen har. Sfingolipidene er knyttet til membranene i nervesystemet. De beslektede gangliosidene er spesielt vanlige i den grå hjernemassen, hvor de utgjør 6 % av alle lipider.
Også noen av de dødeligste giftene vi kjenner er basert på nitrogen. Blåsyre (HCN) og cyanid (kaliumcyanid, KCN), som virker lammende på åndedrettsfunksjonene, er velkjente for de fleste yndere av kriminallitteratur. Alkaloider er fellesnavn på en rekke nitrogenforbindelser som finnes i planter og virker på sentralnervesystemet. Navnet (alkalilignende) henspiller på at de er basiske p.g.a. nitrogeninnholdet. Mange rusmidler, som kokain, morfin, nikotin og koffein, er alkaloider, og mange dødelige gifter, som f.eks. stryknin. Mange andre har nyttige medisinske funksjoner. Også uorganiske nitrogenforbindelser kan være biologisk aktive.
Ammoniakk er giftig både som gass og oppløst i vann, og kan medføre døden ved inntak. Nitritter (salter av salpetersyrling, HNO2) har vært brukt som tilsetning til matvarer, og kan fremkalle kreft.
UTNYTTELSE
Som ventelig når man betrakter nitrogenets biologiske betydning, går den klart største andelen av det nitrogen som omsettes til gjødsel og ernæringsformål. En stor andel går også til forbindelser og preparater til bruk i medisinen. Ca. 16 % av tørrstoffet i all mat er nitrogen, og siden dette nitrogenet direkte eller indirekte tas fra jorda, trengs det tilførsler. Imperier har vokst og falt med gjødselsproduksjon, og kriger har blitt ført om skrinne ørkenområder fulle av nitratavleiringer. På 1800-tallet pløyde makter med store teknologiske muskler mye innsats inn i spørsmålet om hvordan man kunne stjele nitrogen fra luftas tilsynelatende utømmelige forråd til å produsere gjødsel med. Men ikke bare store makter hadde muskler. I en liten bygd kalt Kristiania hadde den begavede og idérike fysikeren Kristian Birkeland, etter mer eller mindre å ha løst nordlysets gåte, hatt et uhell med en elektromagnetisk kanon han hadde forsøkt å prakke på det norske forsvaret. Uhellet overbeviste ham om at en elektrisk lysbue under påvirkning fra et magnetisk vekselfelt kunne spres ut til en flammeskive. I samarbeid med en trinn pengesekk kalt Sam Eyde, bygde han lysbueovner som kunne brenne nitrogen fra luften til oksyder, og Norsk Hydro var (1905) grunnlagt. Birkeland-Eyde-metoden var ikke den første som fikserte luftnitrogen til gjødsel. Kunstig kalsiumkarbamid kom på markedet alt 1901. Og idag er metoden forlatt til fordel for Haber-Bosch-metoden, hvor ammoniakk produseres av grunnstoffene med katalysator. Men en god historie er det.
Som rent grunnstoff har nitrogen to anvendelsesområder. Det ene bygger på at gassen er så inert, og beskytter mot oksydasjon under f.eks. buesveising eller bygging av elektronikkomponenter. Det andre er som kjølemiddel. Flytende nitrogen korroderer ikke, og er lettere å kondensere enn mange andre gasser.
Nitrogenforbindelser har ellers rike og varierte anvendelser. Men de to viktigste anvendelsesområdene utenom gjødsel- og næringsmiddelindustrien er nok farge- og sprengstoffindustriene. I organiske forbindelser gir nitrogrupper (-NO2) gule og oransje farger, azogrupper (-N=N-) gir gule til rødlige toner, helst i samklang med andre grupper. Disse danner grupper av fargestoffer under fellesnavnene nitro- og azofargestoffer. Også andre grupper fargestoffer, som kinolin-, akridin-, oxazin- og indigofargene har virksomme nitrogenatomer.
I likhet med indigo har salpeter, KNO3, vært handelsvare fra oldtiden. Men riktig gjennomslag fikk ikke varen før kineserne avsluttet middelalderen med en riktig dundrende oppfinnelse. Det er de oksyderende egenskapene som gjør nitrater og nitroforbindelser så anvendelige til eksplosiver, hvor poenget er å få en forbrenningsprosess til å løpe løpsk. Krutt må holdes tørt, og fordi man i salpeter hadde et nitrat som ikke trakk fuktighet til seg fra luften var det gjort.
Krutt består av salpeter, svovel og kull. Forbrenning med salpeter som oksygenkilde var kjent av kineserne allerede ved vår tidsregnings begynnelse. Araberne omtalte salpeter som "kinesisk salt" eller "kinesisk snø". På 600-tallet tok det bysantinske riket i bruk en blanding av de tre ovennevnte ingrediensene til å tenne fyr på tyrkiske skip under et angrep på Konstantinopel. Oppfinnelsen var kjent som "gresk ild" og det ble sagt at det var umulig å slukke en brann antent av den. Oppskriften ble bevart i dypeste hemmelighet i flere århundrer. Først på 1300-tallet kom araberne fram til en eksplosiv blanding av de tre bestanddelene (3/4 salpeter, 1/9 svovel og 5/36 trekull), som vi kjenner som krutt, et ord av samme opprinnelse som krydder. Men araberne holdt ikke like godt på hemmeligheten, og allerede i 1339 ble oppfinnelsen tatt i bruk i Europa under forsvaret av den tyske (idag franske) byen Cambrai, i begynnelsen av hundreårskrigene. Artilleriet (et provencalsk ord - 'det som hører til festningsverket') var født. Mye har blitt sprengt vekk fra jordens overflate siden det. Mange tonn fjell. Mangfoldige millioner liv. Kruttet har gått til himmels, etterlatt seg lysende striper og gått av med smell som har spredt knatrende fargeblomster over den mørke himmelen. Imens har grå, eimende røyk drevet i dalene.
Svartkrutt ble sent på 1800-tallet avløst av røyksvakt krutt og senere enda mer moderne eksplosiver til militære og sprengningstekniske formål, men brukes fremdeles i fyrverkeri og i visse leker for barn. "Kruttlapper" inneholder imidlertid ikke krutt, men bl.a. fosfor (s.d.)
De fleste eksplosiver er nitroforbindelser eller nitratestere av forskjellige organiske stoffer. Drivende eksplosiver brukes til fremdrift av prosjektiler og kan bestå av f.eks. svartkrutt eller røyksvakt krutt (nitratestere av cellulose). Brisante eksplosiver brukes til sprengning (sprengstoffer). Dynamitt er klart mest brukt til sivile formål og lages ved å suge opp nitroglyserol og nitroglykol i kollodiumull (et cellulosenitratester med lavere nitreringsgrad).
For militære formål finnes en mengde varianter, mest nitroforbindelser. TNT, trinitrotoluen, er det vanligste. Initierende sprengstoffer brukes i fenghetter og andre anordninger til å bringe de brisante til å eksplodere. De går lett av ved støt og varme og kan bestå av kvikksølvcyanat (knallkvikksølv), Hg(OCN)2, eller blyazid, Pb(N3)2. Såkalte sikkerhetssprengstoffer er oftest ikke karbonholdige og består gjerne av nitrater, klorater og perklorater, men kan også være tilsatt sprengoljene nitroglyserol og nitroglykol.
Organiske sprengstoffer gir bare gassformige forbrenningsprodukter og derfor høyt sprengningstrykk og temperatur. For typiske organiske sprengstoffer kan gassvolumet være 700-900 liter/kg sprengstoff, trykket 50-100 tonn/kvadratcm og temperaturen 3500 til 5200° C.
Cellulose kan som glyserol forestres med salpetersyre til cellulosenitrat eller skytebomull, et sprengstoff som er for kraftig til å brukes i skytevåpen og meget ømfintlig for slag og varme, iallfall i tørr tilstand. Men det kan transporteres hvis det tilsettes 30 % vann. Tørr skytebomull inneholder ideelt 12-14 % nitrogen, men lavnitrert cellulosenitrat med 10 % N er idag et atskillig viktigere produkt. Hvis man knar det i sprit og eter og lar væskene fordampe igjen fås et geléaktig produkt som er lett formbart, men også kan overføres til pulverform, og i den tilstanden er det hovedbestanddelen av såkalt røyksvakt krutt, som er svært mye brukt i ammunisjon m.m. Det såkalte Schultz'ke krutt er et gult, eksplosivt pulver som lages ved nitrering av trestøv eller sagmugg og for en stor del består av cellulosenitrat.
Cellulosenitrat kan også gi opphav til kollodium, et stoff som brukes i medisinen, og knadd med kamfer og alkohol til celluloid, et stoff som først og fremst har vært brukt til fremvisning av mektig kunst i mørke saler. Dessverre går mange eldre slike kunstverk tapt fordi celluloiden med tiden delvis får tilbake skytebomullens egenskaper.
Polyamider er polymerer som kan lages ved oppvarming av toverdige aminer og toverdige organiske syrer. Nylon er sammensatt av 1,6-heksandiamin, H2N(CH2)6NH2, og adipinsyre, HOOC(CH2)4COOH. Hvis det inngår noen treverdige syrer, alkoholer eller aminer i den blandingen som oppvarmes dannes nettverkspolymerer som er harde og seige og som hverken vil smelte eller løse seg opp i noen oppløsningsmidler. Slike stoffer kalles termoplaster og omfatter også andre nettverkspolymerer slik som bakelitt og karbamid- og melaminplaster.
Titannitrid, TiN, blir brukt som beskyttende overflate på finmaskinlagre, valselagre, til foring av reaksjonskar m.m.
Bornitrid, BN, brukes som høytemperatursmøremiddel, varme- og stømisolator, spisser i rakettvåpen m.m.
Galliumnitrid, GaN, og et blandingsnitrid med aluminium, (Ga,Al)N, brukes i lysdioder.
Salpetersyre, HNO3, er en av de mest brukte sterke syrene og et standardmiddel i alle kjemiske laboratorier og kjemisk industri. Brukes mest til å fremstille kunstgjødsel, spreng- og fargestoffer, legemidler, syntetiske fibre, film, lakk, lær, plast m.m., til beising, etsing, som oksydasjonsmiddel, bl.a. i rakettmotorer og til å løse opp malm.
Litiumnitrat, LiNO3, brukes i kjøle- og varmevekslingssystemer, som rødfarge i fyrverkeri, oksydasjonsmiddel i fargefilmsensibilisering og til oksydasjon av spesialdrivstoffer som dekaboran.
Natriumnitrat eller chilesalpeter, NaNO3, brukes som konserveringsmiddel i osteløpe (E251) og har hatt stor betydning som plantegjødning, men har idag mest omfattende bruk som råstoff i kjemisk syntese, ved fremstilling av fargestoffer, eksplosiver, glass, emalje og fyrverkeri, som oksydasjons- og flussmiddel m.m.
Kaliumnitrat brukes som nevnt i krutt og dessuten i plantegjødning, fyrverkeri, glass og emalje og tilsettes til tobakk for å gjøre forbrenningen lettere.
Kalsiumnitrat eller kalksalpeter, Ca(NO3)2, har vært brukt i stor utstrekning som kunstgjødsel og var et av hovedproduktene i den norske industrien. Det har nå mistet noe av betydningen, men det brukes fortsatt en del.
Strontiumnitrat, Sr(NO3)2, brukes som rødfarge i fare- og nødbluss, fyrverkeri og sporlysgranater.
Bariumnitrat, Ba(NO3)2, brukes som grønnfarge i fyrverkeri.
Uranylnitrat, UO2(NO3)2, har vært brukt i fotografien som tonbad, "uranforsterker".
Kobber(II)nitrat-heksahydrat, Cu(NO3)2
× 6H2O, brukes til polering av jern, for å farge kobber svart og sink brunt, til å patinere kobber, i lysømfintlig reproduksjonspapir m.m.Sølvnitrat, AgNO3, er den viktigste sølvforbindelsen og brukes til bortetsing av arrvev eller andre utvekster på huden (i løsning eller tradisjonelt i form av hvite, gjennomskinnelige staver, "helvetesstein"), til forebygging av gonoréinfeksjon i øynene på nyfødte ("dryppert"), mot magekatarr, til fremstilling av permanent blekk, til svartfarging av hår, til galvanisk forsølving, fremstilling av sølvspeil, en rekke sølvpreparater m.m.
Sinknitrat, Zn(NO3)2, brukes til farging av acetatfiber, som katalysator ved polymeriseringsreaksjoner, til å gjøre skjorter strykefrie m.m.
Thallium(I)nitrat, TlNO3, brukes sammen med kaliumklorat og harpiks i grønne signallys.
Natriumnitritt, NaNO2, brukes til fremstilling av azofargestoffer, i rustmidler og som konserveringsmiddel (E250) som også innvirker på smaken og fargen til kjøttet. Kan danne sterkt kreftfremkallende nitrosaminer i kroppen, og bruken har derfor vært noe omdiskutert. Nitrosamindannelsen kan begrenses ved tilsetning av antioksydanter som askorbinsyre, E300 eller askorbat, E301.
Blåsyre, HCN, er en meget brukt giftgass som anvendes i diverse sammenheng, til gasskammerhenrettelser, avlusing av boliger m.m. Den forhandles ofte i metallbeholdere oppsugd i kiselgur.
Natriumcyanid brukes i sølv- og gullutvinning etter cyanidprosessen, til fremstilling av galvaniske bad, særlig for edelmetallsalter, til organiske synteser, til rensing av metaller, for fjerning av hår fra skinn, til insektgift m.m.
Kaliumcyanid, eller cyankalium som det heter i gamle detektivbøker, brukes av de som har funnet seg et skadedyr de vil bekjempe og forøvrig i fotografien og til galvanisk metallbelegning.
Natriumheksacyanoferrat(II), Na4Fe(CN)6.10H2O, brukes til fremstilling av fargestoffer, til metallurgiske og fotografiske formål, i tekstilindustrien, i fargerier og trykkerier, til fremstilling av visse typer spesialpapir og i matvareindustrien (E535) sammen med kalium- (E536) og kalsiumsaltet (E538) som middel mot klumper i sauser og pulverprodukter og fellingsmiddel i svake viner og fruktviner.
Gult og rødt blodlutsalt er h.h.v. Kaliumheksacyanoferrat(II) og kaliumheksacyanoferrat(III) (også kalt h.h.v. kaliumferro- og ferricyanid og h.h.v. ferro- og ferricyankalium). Det gule brukes til fremstilling av berlinerblått, til fotokopiering, i matvarer (E536) m.m. Det røde brukes som mildt oksydasjonsmiddel og ved fotofremkalling.
Kalsiumcyanamid, CaNCN2, er et viktig industriprodukt som brukes til mange synteser i den kjemiske industrien. Det kan enkelt fås ved å oppvarme kalsiumkarbid med nitrogen og er utgangsprodukt for fremstilling av cyanider, dicyandiamid og melamin til plastindustrien og sprengstoffet nitroguanidin.
Natriumtiocyanat eller natriumrodanid, NaSCN, finner utnyttelse i medisinen, i fargerier, i fotoindustrien, tekstilindustrien m.m.
Kvikksølv(II)rodanid, Hg(SCN)2, blærer seg sterkt opp ved oppvarming og brukes derfor til å lage "faraoslanger", et moromiddel som må brukes med en viss forsiktighet på grunn av kvikksølvdamper, helst utendørs.
Urinstoff, karbamid eller urea, (NH2)2CO, har utstrakt bruk som nitrogengjødsel, til fôr og i polymerkjemien til fremstilling av bl.a. kunstharpikser. En tynn urealøsning kan opptas direkte gjennom plantenes bladverk etter påsprøyting, noe som ofte utnyttes ved fruktplantasjer i varmere land. Smaker søtt og brukes derfor også som søtstoff i sukkerfri tyggegummi.
Sinktiokarbamater, Zn(CS2NR2)2, hvor R er en organisk gruppe eller hydrogen, brukes som akselerator ved vulkanisering av gummi. Tilsvarende jern- og mangansalter brukes sammen med sinksaltet som middel mot sopp.
Lystgass eller dinitrogenoksyd, N2O, brukes som bedøvelsesmiddel for kortvarig bruk, f.eks. ved tannbehandling eller fødsler.
Ammoniakk, NH3, har lenge hatt utstrakt bruk som kjølemedium, og ble spesielt aktualisert etter oppdagelsen av at klorfluorkarbonene (KFK) som langt på vei hadde overtatt, var farlige for osonlaget. I vannløsning brukes det som vaskemiddel (salmiakkspiritus). Sprøyting av åkre med fortynnet ammoniakkløsning har blitt en alminnelig gjødslemetode. Nitrerherding av stål gjøres ved å holde stålet oppvarmet til 500-550 °C i ammoniakkstrøm i ett eller flere døgn og fører til at det dannes et tynt, men svært hardt overflatelag av nitrider av jern og andre legeringsmetaller.
Ammoniumkarbonat, (NH4)2CO3, brukes sammen med ammoniumbikarbonat som hevemiddel i bakervarer og i sjokolade, sukkertøy, lutefisk og ved hobbyvinlegging (E503).
Hjortetakksalt til baking er en blanding av ammoniumhydrogenkarbonat, NH4HCO3 og ammoniumkarbamat, NH4COONH2. Det har den fordelen fremfor alkalikarbonater at det forgasses fullstendig ved oppvarming, slik at det ikke blir igjen noe sterkt basisk alkali som gir 'lutsmak' i bakverket. Derimot har det en tendens til å levne en viss salmiakksmak som imidlertid kan utnyttes fordelaktig i noen kombinasjoner.
Ammoniumnitrat, NH4NO3, brukes som sprengstoff og i kunstgjødsel og i lystgassapprater til fremstilling av lystgass.
Ammoniumfosfater, NH4H2PO4 (E342a), (NH4)2HPO4 (E342b) og (NH4)3PO4, brukes i fullgjødsel, som brannbeskyttende midler i tre, papir og tekstil og (de to første) i næringsmidler, bl.a. som pH-regulerende middel i osteproduksjonen.
Ammoniumsulfat, (NH4)2SO4, var det første kunstgjødelet, et biprodukt fra gass- og koksverkene, og er fortsatt mye brukt, gjerne i blanding med ammoniumnitrat og andre gjødningsstoffer.
Ammoniumklorid eller salmiakk, NH4Cl, brukes til rensing av loddeflater, til batterielektrolytt og til slimløsende medikamenter, f.eks. salmiakkpastiller (E510).
Ammoniumperklorat, NH4ClO4, brukes i sprengstoff og som oksydasjonsmiddel i rakettmotorer.
Nitrogentrifluorid, NF3, kan sammen med hydrogen gi en sveiseflamme på 4-5000 °C og sveise metaller med svært høyt smeltepunkt.
En rekke nitrogenholdige organiske bruksstoffer er nevnt under karbon.
Hovedkilder:
Prof.dr.phil. Haakon Haraldsen (Asch.konv.leks.5.utg.b.14)
CRC Handbook of Chemistry anf Physics, 57th ed. 1976-77.
Sienko & Plane, Chemical Principles & Properties, McGraw-Hill, 1974.
F. Albert Cotton og Geoffrey Wilkinson, Advanced Inorganic Chemistry, John Wiley & Sons, 1988.
Kice & Marvell, Modern Principles of Organic Chemistry, Collier-MacMillan, 1974.
Moe & Munksgaard, Elementær Biokemi, Nyt Nordisk Forlag, 1986.
Orla Zinck og Torben Hallas-Møller, E-nummerboken, Ex Libris forlag A.S., 1994, overs. Gunnar Bureid.
Iwan Bolin, Kjemien i det praktiske liv, Cappelen, 1932.
:-) LEF