KARBON
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
18 |
|
H |
2 |
|
|
|
|
|
|
|
|
|
|
13 |
14 |
15 |
16 |
17 |
He |
|
Li |
Be |
|
|
|
|
|
|
|
|
|
|
B |
C |
N |
O |
F |
Ne |
|
Na |
Mg |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
Al |
Si |
P |
S |
Cl |
Ar |
|
K |
Ca |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
Ga |
Ge |
As |
Se |
Br |
Kr |
|
Rb |
Sr |
Y |
Zr |
Nb |
Mo |
Tc |
Ru |
Rh |
Pd |
Ag |
Cd |
In |
Sn |
Sb |
Te |
I |
Xe |
|
Cs |
Ba |
La |
Hf |
Ta |
W |
Re |
Os |
Ir |
Pt |
Au |
Hg |
Tl |
Pb |
Bi |
Po |
At |
Rn |
|
Fr |
Ra |
Ac |
Rf |
Db |
Sg |
Bh |
Hs |
Mt |
? |
? |
? |
|
? |
|
? |
|
? |
|
|
|
Ce |
Pr |
Nd |
Pm |
Sm |
Eu |
Gd |
Tb |
Dy |
Ho |
Er |
Tm |
Yb |
Lu |
|
|
|
|
Th |
Pa |
U |
Np |
Pu |
Am |
Cm |
Bk |
Cf |
Es |
Fm |
Md |
No |
Lr |
|
C, atomnr. 6, molvekt
12,011 g, elektronkonfigurasjon: (He)+2s2-2p2, grafitt sublimerer ved 3367 °C
(må ha over hundre atmosfærers trykk for å kunne smelte), diamant smelter ved
ca. 3550 °C, som er rekord for grunnstoffer, og koker ved 4827 °C, tetthet
grafitt 2,25 g/cm3 (20 °C), diamant 3,514 g/cm3 (20 °C).
Amorft karbon ca. 1,9 g/cm3. Grafitt har vanligvis en ganske god
varmeledningsevne på mellom 0,8 og 2,2 W/cm/K ved romtemperatur, avhengig av
retning (på langs eller tvers av strukturskiktene) og fremstillingsmåten. Til
sammenlikning har aluminium 2,37 W/cm/K og jern 0,804. Amorft karbon (sot) har
derimot en meget dårlig varmeledningsevne, mens diamant med 23,2 W/cm/K ved
romtemperatur leder varme bedre enn noe annet kjent stoff. Diamant har også den
laveste molare entropien, 2,4 J/mol/K av alle grunnstoffer. På tvers av
strukturskiktene er grafitt en dårlig elektrisk leder (halvleder) med en
resistivitet ved 0 °C på 1375 mikrohm-cm, mens på langs er den 65 mikrohm-cm,
og leder altså strøm like godt som de sjeldne jordmetallene. Diamant er derimot
en isolator. Karbon har også meget dårlige magnetiske egenskaper og er bare
uhyre svakt diamagnetisk med en magnetiserbarhet på -6 cgs-enheter. Av
grunnstoffer i fast form er det bare kobber, yttrium og en modifikasjon av arsen
som har det verre. De sterkeste synlige spektrallinjene til karbon er i fiolett
med 3921 og 4267 Å og i rødt med 6578, men det er noen svakere i grønt på 5145,
gult på 5890 og rødt på 6583 og mange sterke på begge sider av det synlige
området. Som diamant er karbon det absolutt hardeste av alle grunnstoffer med
en Mohs hardhet på 10,0 mens grafitt med hardhet på 0,5 - 1 er et av de
bløteste faste stoffene, litt hardere enn voks.
Karbon har (1981) 8 kjente og 4 postulerte
isotoper og isomerer, hvorav to, 12 og 13, er stabile og forekommer i naturen
sammen med den radioaktive C 14, som dannes ved flere naturlige (og kunstige)
kjernekjemiske prosesser. C 14 har en halveringstid på 5730 år, de andre har
noen få minutter eller kortere. C 12 danner grunnlaget for den moderne
atomvektskalaen, da atomvekten til denne isotopen i 1961 ble definert som 12,0.
Tidligere var utgangspunktet naturlig oksygen som ble satt til 16,0. Men da
isotopsammensetningen til det naturlige oksygenet kan variere litt, fikk man ikke
noen entydig skala når målenøyaktigheten ble stor nok. Derfor bestemte man seg
for å gå ut fra en enkelt isotop.
Radioaktiv datering med
C 14 er mulig for karbonholdige substanser som er yngre enn ca. 100000 år, og
ganske nøyaktig for ting som er 500-25000 år gamle, noe som jo omfatter det
meste av arkeologenes virkefelt. Karbon 14 produseres stadig i atmosfæren
p.g.a. hurtige nøytroner som dannes når kosmisk stråling smadrer luftatomer.
Når slike nøytroner treffer nitrogenkjerner har de nok energi til at det kan
bli støtt ut et proton: 14N + 1n = 14C + 1H.
Dette radioaktive karbonet opptas av levende organismer til de dør og omdannes
så sakte tilbake til nitrogen med en halveringstid på 5730 år. Den kosmiske
strålingen er forholdsvis konstant og C 14-produksjonen varierer forholdsvis
lite. De variasjonene som eksisterer kan i noen grad elimineres ved å justere C
14-skalaen i forhold til årringskronologi, årstidssedimenter og andre metoder.
I moderne tid har C 14-produksjonen økt som følge av nøytroner fra kjernekraft
og prøvesprengninger, noe som også må tas i betraktning. Mye C 14 ble frigjort
i atmosfæren da grafittmoderatoren i Tsjernobyl-reaktoren brant. Det var dannet
der ved at C 13, som utgjorde 1,11 % av grafitten, opptok nøytroner. Karbon har
en meget lav absorpsjonsevne for termiske nøytroner på 0,0034 b, og egner seg
derfor glimrende som moderator i atomreaktorer, hvor det er nøytronene som skal
gjøre arbeidet. Bare oksygen av alle grunnstoffene ligger lavere.
HISTORIE
Det var en dårlig dag. Det var en dag som egnet seg til å gjemme seg, til å
klumpe seg sammen til en bunt av engstelig kjøtt og blod og søke ly og trøst i
hverandres varme. Men likevel var han her ute nå, hvorfor han var det visste
han vel ikke helt selv. Javel, de hadde sett noen av de store svarte fuglene
kretse over noe som det kunne gå an å spise tidlig om morgenen, og han hadde
tenkt at hvis han turde gå og hente det ville han gjøre det stort og bli hilst
med beundring og takknemlighet av vennene sine, som før. Det hadde sett helt
fint ut i været da, men de hadde visst hva som ville komme, han også, det var
noe med det tunge og klamme, og med lufta som liksom ikke *ville* ned i lungene.
Nå lå han her ute, med
knærne krøllet tett sammen under seg og med armene og hendene hardt klamrende
som en spinkel beskyttelse over hodet og ansiktet. For han hadde sett det, det
var like innpå ham, stort og nært og farlig, det som hadde vært langt borte og
farlig og som de hadde sett så mange ganger på så mange andre dårlige dager som
denne. Det hvite, blå lyset, blinket som ble fort borte og den sterke stemmen
som kunne rope mer enn noe han visste om og som var sint, sint, sint, sint,
sint, sint, sint, sint, sint - og farlig.
Det sluttet plutselig å
regne. Snart ble det lysere. Han så opp. Treet - for et grufullt syn! - var
omspunnet av gule flammetunger som slikket oppover det og fikk det til å visne
og skrumpe inn mens han så på og bli til en svart og død rest av et tre som de
hadde sett mange ganger før, et tre som aldri mer ville blomstre. Så tok han
hendene og armene vernende over ansiktet igjen, for han kjente at det kom
varme, en sviende varme som var sterkere enn noen varme han hadde kjent. Det
var stort og lysende gult og varmt, faktisk større og gulere og varmere enn det
store lyset som kom når det var dag og som noen ganger ikke kom og som på noen
dager var lengre borte enn på andre dager. Han tok hendene bort fra ansiktet
igjen. Rynken på pannen hans var dypere.
Like ved ham var et
levende tre i ferd med å bli drept av den sinte fra himmelen som kom med
flammer, og han satt stivt og sammenkrøket og stille, men han så med åpnede
øyne. Han reiste seg, langsomt, og sto på to. Så gikk han et ustødig skritt
forover og et til. Han strakte ut hånden. En kvist like foran ham brant lystig
med blafrende gule flammer i det saftige løvet. Han strakk ut hånden og brøt
den av. Den fortsatte å brenne mens han hadde den i hånden, han tok den andre
hånden mot flammene og kjente hvor varme de var og skar redde og spente og
frydefulle grimaser. Det sto et annet tre like i nærheten. Han tok kvisten og
satte den borttil det treet og det begynte straks å brenne, de gule flammene
spredde seg i løvverket og lot etter seg noen svarte, sotete, tørre kvister.
Han lo og skrek og hoppet og veivet med den brennende kvisten som han hadde i
hånden, for han kunne gjøre et levende tre til en svart og død rest som aldri
mer ville blomstre! Så kastet han kvisten ned i det høye gresset.
Over skyene som sakte
trakk seg tilbake, over røyken som sto opp fra de brennende trærne, over han
som løp i vill panikk hjem til frendene i det trygge lyet og over den rasende
gressbrannen som bredte seg som en brølende bøffelflokk utover den vide sletten
hang en gul kule og ga lys og varme og liv til alle de små vesnene som holdt på
med sine mer eller mindre kloke ting nede på planeten. Atomene i dypet av dens
indre var løsgjorte fra elektronene sine, og energitettheten var så stor at de
stadig kolliderte og inngikk kjernekjemiske reaksjoner med hverandre. I en
kjede av slike reaksjoner drev kjerner med seks positive ladninger med å ta opp
fire protoner ett og ett og spalte av heliumkjerner slik at det ble produsert
energi nok til å holde kula med lys, varme og indre trykk i alle de
årmilliarder den var tilmålt å leve. Og da dagene ble til netter kom det fram
stjerner som var fjernere kuler av samme slag og noen av dem var store og varme
nok til at tre heliumkjerner med to ladninger hver kunne bli til slike kjerner
med seks når de støtte sammen, og etter sine kortere liv støtte de dem ut slik
at andre stjerner kunne bruke dem til å lage lys og varme selv om de ikke var
så store.
Ja, den hang og hang den
der den hang den gule kula, gjennom alle årmilliardene sine, den utvant energi
og holdt seg ved like - den levde. Og alle planetene danset i ring rundt sin
mor, vår Sol, barn av samme stoff som henne selv.
Årmillionene gikk. Alene
roterte den lille planeten rundt i sin bane, som en stein noen har slynget ut i
en kastebane uten å sikte mot noe spesielt, den følger den krumme, ballistiske
banen sakte dreiende om seg selv, kanskje treffer den en gang noe og blir
liggende stille, kanskje ikke. Sol-vinder av ladde partikler og stråling feide
inn over de ytre lagene av den tykke atmosfæren til planeten, nede ved
overflaten var temperaturen passelig til at H2O eksisterte i
flytende fase og dannet svære sjøer, kraftige stormer kastet veldige brottsjøer
over klippene og oppe i skylagene fantes et grunnstoff som kunne knytte stabile
kovalente forbindelser med mange andre. Strålingen og de elektriske utladningene
i stormene spaltet og sprengte istykker molekyler, det ble dannet reaktive
smådeler som forbandt seg med større enheter - straks ble de spaltet igjen, men
noen ganger rakk det voldsomme regnet å skylle dem ned i sjøene først. Vannet
ble stadig skitnere. Grumsete gjørmebølger slo mot kystene.
Så skjedde noe.
Nede i urhavet skjedde
kjemiske og fysiske reaksjoner slik de alltid gjør mellom blandinger av
forskjellige stoffer i vannløsning. Det innstilte seg likevekter som forskjøv
seg når ting endret seg i omgivelsene. Molekyler forandret seg - det betydde at
en enhet av en bestemt substans gikk til grunne mens en ny ble til. Hvert
molekyl av de forskjellige substansene eksisterte så og så lenge, og når
begivenheter i omgivelsene førte til at aktiveringsenergien for en reaksjon med
et av nabomolekylene ble overskredet, gikk de til grunne, de gjorde ikke noe
for å forhindre det - hvorfor skulle de det?
Noen av disse molekylene
var slik innrettet at de hadde høyere aktiveringsenergi for de vanligste reaksjonene
enn de fleste andre, derfor ble det etterhvert flere eksemplarer av disse
molekyltypene enn av de andre. Mange av molekyltypene var løselige i vann og
svømte enkeltvis rundt i verdenshavet hele sin levetid. Andre var uløselige, de
klumpet seg sammen i krystaller eller væskedråper fordi de sparte energi ved at
noen av de vannavstøtende sidene lå inntil molekyler av samme slag og slapp å
avstøte vann. Noen ganger vokste krystallene eller dråpene seg store og fløt
ned eller opp og forsvant fra molekylkretsløpet i havet. Andre ganger vokste de
seg ikke så store og ble værende i suspensjon i vannet fordi strømningene og
molekylbevegelsene påvirket dem mer enn gravitasjonskreftene.
Så hendte det seg at
noen av molekylene ble så store at en del av dem kunne være løselig i vann mens
resten ikke var det, og hvis disse molekylene også hadde høy aktiveringsenergi
for de vanligste reaksjonene nede i havet, kunne det hope seg opp et betydelig
antall av slike molekyler også. De klumpet seg gjerne slik at de vannavstøtende
delene søkte sammen mens de vannløselige delene stakk ut mot vannmolekylene.
Slike klumper var som regel små og ble nok værende i suspensjon i vannet lenge.
Men hva skjedde hvis molekylene var langstrakte, kjedeformet, og bare en ende
av kjeden var løselig i vann? Hvis slike molekyler klumpet seg med de
vannavstøtende spissene mot hverandre ble det gjerne mye sprik mellom de andre
endene slik at det slapp inn vannmolekyler.
En mer stabil struktur
er med kjedene parallelle, alle molekyler som er inne i en slik klynge av
parallelle kjedemolekyler vil være helt beskyttet mot vann. Bare spissene av
molekylet samt de ytterste delene av de ytterste molekylene er i kontakt med
vannet. Opprinnelig vil noen av molekylene ligge den ene veien og noen den andre.
Men etter hvert som det samles flere molekyler vil de som ligger den ene veien
skyves ut fra de som ligger den andre, slik at de blir liggende med de
vannavstøtende spissene mot hverandre. I et slikt dobbeltskikt av
kjedemolekyler er det bare yttersidene av de ytterste molekylene som ikke er
beskyttet mot vannet. Og hvis det er mange nok molekyler kan dobbeltskiktet
krumme seg sammen uten at molekylene spriker for mye og danne en kule, slik at
de ubeskyttede sidene møtes og bare de vannkjære endene av kjedemolekylene er i
kontakt med vann, mens ingen av de vannavstøtende delene er det.
En tilstrekkelig mengde
slike molekyler med en vannkjær og en vannavstøtende ende (amfifile molekyler)
vil derfor alltid danne slike dobbeltveggede kuler når de kommer i vann, og
disse kulene har det fenomenale særtrekket at de har en innside som er
avsondret fra omverdenen. Kulene er på det nærmeste vanntette. Bare andre
vannavstøtende eller amfifile molekyler kan komme inn i dobbeltveggen,
membranen. Hvis de er utsatt for tilstrekkelig mange mekaniske påvirkninger vil
kulene dessuten ha en tendens til å være nokså små. Blir de for store, kan de
lett bli revet i stykker slik at det dannes to eller flere små kuler av den
store, derfor blir de hengende i suspensjon i vannet.
Kulene er svært stabile,
og kunne gjerne leve evig hvis det ikke er store krystaller eller dråper av
vannavstøtende substanser til stede. De smelter lett sammen til større kuler
hvis de tilfeldigvis møtes, men kan rives opp til mindre igjen hvis det er
strømninger i vannet eller andre tilfeldige mekaniske påvirkninger. De gjør
ikke noe for å beskytte sin individualitet. Molekylbestanddelene av dem
tilhører dem ikke mer enn et natrium- eller klorion hører til en bestemt
saltkrystall. De går til grunne på en oljedråpe eller vokskrystall fordi
molekylene fordeler seg som et belegg med de vannavstøtende spissene inn mot
dråpen eller krystallen og de vannkjære ut mot vannet, og de kan også gå til
grunne hvis de vokser seg for store uten å bli revet opp av strømninger eller
liknende.
Det vannfrie miljøet
inne i membranlagene til disse små kulene var nok et fristed for forskjellige
substanser som var mer eller mindre uløselige i vann. Her kunne det samle seg
alskens olje- eller fettaktige stoffer, og rett som det var forekom det at noen
av dem var kjemisk aktive. Under alle de reaksjonene og molekylforvandlingene
som skjedde i urhavet ble det omsatt energi. Spontane prosesser i naturen
(d.v.s. slike som skjer uten at noen påvirker dem) skjer alltid slik at resultatet
har mindre energi enn utgangstilstanden. Det betyr at det alltid frigjøres
energi under prosessen, og denne energien påvirker igjen omgivelsene på diverse
måter. Både inne i og utenfor alle disse små dobbeltveggede blærene skjedde det
stadig forskjellige nye forandringer og reaksjoner som følge av den store eller
lille energimengden som ble frigjort ved de foregående reaksjonene, og dagene
ble til år, og årene ble til årmillioner, og årmillionene hopet seg opp.
De små boblene vedble å
vokse ved at de støtte sammen med andre slike liknende små bobler og ikke
sjelden delte de seg på grunn av en eller annen mekanisk påvirkning når de ble
for store. I det avsondrede lille rommet i de fleste av dem var det nok ganske
kjedsommelig, dødt og stille. Men i noen skjedde forskjellige interessante
kjemiske reaksjoner, avhengig av hva slags stoffer som hadde skjult seg i
membranene eller som hadde kommet inn i kulen siste gangen den delte seg eller
støtte sammen med en annen, og også avhengig av det fysiske og kjemiske miljøet
som kulene tilfeldigvis befant seg i for øyeblikket.
Stundom skjedde det at
energien som ble frigjort i en slik reaksjon førte til en ny reaksjon eller en
hel kjede av reaksjoner. Stundom hendte det at en slik reaksjonskjede og
bestanddelene som deltok i den var av slik art at den kunne gjenta seg hvis det
kom ny energi inn fra omgivelsene, enten i form av lys eller annen fysisk
energi eller i form av en energirik kjemisk substans som kom inn utenfra. Etter
noen få gjentakelser var nok syklusen over på grunn av forskjellige tilfeldige
forstyrrelser som man alltid må regne med i en komplisert reaksjonsblanding i
et energirikt miljø, men hva om reaksjonskjeden og bestanddelene som deltok i
den tilfeldigvis en sjelden gang var av slik art at en gren av kjeden beskyttet
ett eller stundom flere av leddene i kjeden mot forstyrrelser fra omgivelsene?
En slik kjede kunne nok
holde på en stund, og hvis en kjede med molekylforandringer repeteres er det
alltid en sjanse for at det kan oppstå flere kopier av de molekylene som deltar
i kjeden, dersom råvarene er til stede. Dermed finnes det også en sjanse for at
den samme prosessen kan foregå flere steder på en gang, kanskje også i flere
bobler, hvis den første boblen har delt seg av en eller annen grunn. Jo bedre
beskyttet kjeden er mot forstyrrelser, jo lengre holder den på, og jo større
sjanser er det for at akkurat denne kjeden foregår flere steder enn andre
prosesser. Energien som frigjøres ved en slik prosess kan ha diverse virkninger
på miljøet inne i boblen. Den kan gjerne virke ødeleggende, men bobler som
huser ødeleggende prosesser vil raskere gå til grunne enn andre bobler, og
derfor bli mindre tallrike.
En gang kan det kanskje
oppstå en prosess som binder et energirikt molekyl til membranoverflaten og
fører den gjennom membranen slik at det oppstår en mulighet for at det
energirike molekylet kan hjelpe til med å føre prosessen videre, eller det kan
oppstå en prosess som danner et molekyl som bedre kan absorbere energi i form
av lys eller andre ting fra omgivelsene, og derfor i et heldig fall kan hjelpe
til med å føre prosessen videre. Hvis det er mye energi tilgjengelig i
omgivelsene vil prosessen kunne gå lenge før den stopper eller må ta en pause.
Hvis det ikke er så mye, tar det kortere tid før prosessen stopper eller må ta
en pause, men hva om prosessen og de molekylbestanddelene som inngår i den
tilfeldigvis arter seg slik at de fører til at boblen kommer i bevegelse i
forhold til omgivelsene, og dermed kan ankomme til nye områder hvor det er mer
energi å leve av?
De fleste av disse små
boblene drev nok bare og lå der og lot lyset skinne inn gjennom membranen sin
eller forskjellige stoffer tilfeldig drive ut og inn av den, og eventuelle
energikrevende ting som foregikk inne i dem stoppet rett og slett hvis de ytre
energikildene ble borte. De som kunne bruke noe av den energien de utvant til å
binde seg til bestemte energirike molekyler og føre dem inn gjennom membranen
eller til å bevege seg og kanskje registrere når de nærmet seg et område hvor
det var mer energi å høste, hadde derfor forutsetninger for å oppnå merkbart
lengre levetid, og derfor antall, enn de andre. De gjorde noe aktivt for å
overleve, de handlet.
En effektiv
energiproduserende mekanisme baserer seg på å utnytte den energien som fås ved
å addere et vannmolekyl (H-O-H) til en P-O-P-binding i en polyfosforsyrekjede
slik at den spaltes til P-O-H + H-O-P (d.v.s. hydrolyseres) og et
fosforsyremolekyl blir frigjort. For å oppnå en stadig tilgang til energi må
denne prosessen altså gjentas flere ganger, og det kan gjøres ved å hente inn
polyfosforsyrekjeder fra omgivelsene eller ved å hente inn andre forbindelser
som kan brukes til å frigjøre den energien som trengs til å sette sammen en
fosforsyrekjede igjen slik at energien i P-O-P-bindingene siden kan utnyttes
ved avspalting. En fosfatkjede, som er vannløselig, kan ikke komme seg inn
gjennom en vannavstøtende dobbeltmembran alene, men hvis den er bundet til en
langkjedet upolar karbonforbindelse er det ikke noe problem. Fosfolipider er et
eksempel på slike forbindelser, som ikke bare inneholder en fosfatenhet, men
som også er hovedbestanddelen av alle cellemembraner i våre dagers livsformer.
De fleste organismer idag utnytter ikke
fosforsyrer direkte i sin energimessige ernæring, de henter alskens energirike
substanser i sine omgivelser og prosesserer dem. Men i siste trinn omsettes
alltid denne energien til fosforsyrebaserte enheter, en slags energi-valuta som
er gyldig for alle mulige energikrevende prosesser, de forskjellige prosessene
(eller transaksjonene) koster så og så mange enheter av denne energivalutaen.
Det er ingen kjente organismer idag som ikke bruker denne valutaen, den et
gyldig betalingsmiddel i hele dyre- og planteriket, derfor må dette være en
svært tidlig utvikling i livets historie, og hva mer er, alle bruker den i en
spesiell form, en kjede på tre sammenkoblede fosfatmolekyler bundet til ribose,
et femleddet sukkermolekyl, som igjen er bundet til en basisk heterosyklisk
forbindelse av karbon, hydrogen, nitrogen og gjerne også oksygen, av en type
som trolig har blitt produsert i mengder oppe i skyene hvor disse grunnstoffene
dominerte sammensetningen. En slik kombinasjon av fosforsyre og base
sammenbundet med nøytralt sukker fikk gunstige ioniske egenskaper som gjorde at
den fritt kunne frakte energi i vannet inne i cellen, men ikke krysse
cellemembranen. Idag kjenner vi bare 5 slike heterosykliske baser som brukes av
alle biologiske vesener: adenin, C5H5N5,
guanin, C5H5N5O, cytosin, C4H5N2O,
uracil, C4H4N2O2 og thymin, C5H6N2O2,
og generelt er det den første som danner den almengyldige
energitransportvalutaen, men noen av de andre brukes også til energioverføring
i visse prosesser.
Adenin er som formelen
antyder en pentamer (femdobling) av blåsyre, HCN, en gass som det finnes store
mengder av i universet og som det nok var ganske mye av i ur-atmosfæren. Adenin
kan under visse betingelser dannes spontant av blåsyre og det er god grunn til
å anta at det fantes atskillig mer av den enn av de andre basene, slik at det er
naturlig at adeninet dannet grunnlaget for den opprinnelige energienheten,
adenosintrifosfatet. Men de andre basene kan ha blitt dannet av adenin ved
forskjellige prosesser, og det er sannsynlig at de tidlige livsformene brukte
alle om hverandre, og kanskje tilsvarende forbindelser som vi ikke kjenner
idag, de har forholdsvis like egenskaper. Og på samme måte som adenin er en
pentamer av blåsyre, er ribose, det sukkermolekylet som adeninet er koblet
sammen med i nukleosidet adenosin, en pentamer av formaldehyd, CH2O,
en gass som det også finnes store mengder av i universet, og som det sikkert
også fantes ganske mye av i ur-atmosfæren. Det overrasker kanskje ikke at
ribose og andre sukkermolekyler under visse betingelser kan dannes spontant av
formaldehyd.
En slik sammensetning av
base + sukker + fosfat kaller vi nukleotid, og de kan kobles sammen i lange
kjeder via sukker- og fosfatenhetene. Disse lange kjedene kaller vi
nukleinsyrer og de opptrer i alle moderne celler i to forskjellige former, DNA
og RNA, avhengig av hvilken sukkerart som inngår i sammensetningen. RNA er
trolig det opprinnelige arvestoffet, for det er bare den som kan danne kjeder
spontant i et slikt miljø som må ha eksistert i havet på Jorda for over 3
milliarder år siden. Slike nukleinsyrekjeder har bare en fosfatenhet og
inneholder derfor ikke den energirike P-O-P-bindingen. De kan kanskje
opprinnelig ha vært rester fra energitransporten, og tidlige celler har kanskje
funnet en måte å lagre dem i slike kjeder på når det var dårlig med energi å
transportere. Men når slike nukleotidrester etter energitransport ble kjedet
sammen til nukleinsyrer viste det seg å ha vidtrekkende konsekvenser, for det
fantes en annen type slike C-H-N-O-forbindelser som det hadde blitt produsert
mye av oppe i skyene og som under de samme betingelsene lot seg koble sammen i
lange kjeder, nemlig aminosyrene. Som nukleotidene har aminosyrene et basisk
endepunkt, aminogruppen NH2, et nøytralt mellomledd CH(R) og en sur
ende, den organiske syregruppen COOH, og derfor har de som nukleotidene god
bevegelsesfrihet i vannmiljøet inne i cellen, men kan ikke krysse
cellemembranen. Det spesielt interessante ved dem er at det til det nøytrale
mellomleddet kan knyttes et radikal (R), en annen vilkårlig gruppe med så
diverse interessante og anvendelige egenskaper.
For at nukleotider skal
kunne kobles sammen til nukleinsyrekjeder må det fjernes et molekyl vann for
hver nye enhet. Det samme gjelder aminosyrene. Med mye vann rundt seg vil
derfor slike kjeder snarere ha en tendens til å hydrolysere til enkeltdeler enn
å polymerisere til lange kjeder. Hvis en celle av en tidlig livsform derfor
lagret brukte energitransportnukleotider i slike kjeder ville det derfor vært
en fordel om sammenkoblingen foregikk på en dertil tillempet avdeling som
kanskje ikke hadde helt fri tilgang til vann. Hvis det nå tilfeldigvis var
aminosyrer til stede, som er atskillig mindre plasskrevende molekyler enn
nukleotider, ville disse også kunne kobles sammen i den samme prosessen, som på
det stadiet kanskje ikke hadde muligheter til å skjelne mellom de to
molekyltypene eller for så vidt på andre molekyltyper som kunne kobles sammen
på samme måte, f.eks. sukkermolekyler som kan kobles sammen til
polysakkaridkjeder. Idag gjøres slike sammenkoblinger av enzymer i vannmiljø,
men enzymer er proteiner som må lages av DNA, og for å kunne få en idé om
hvordan proteinproduksjonen startet må vi tenke oss en prosess som kunne skje
uten enzymer, men kanskje ved hjelp av andre katalysatorer som forekom naturlig
eller var produsert av cellen.
En primitiv celle vil
kunne produsere flere kopier av de molekylene den trenger til aktivitetene sine
ved at den huser kjemiske prosesser som går i løkke. En slik celle har heller
ikke andre aktiviteter enn det den tilfaldigvis har evnen til å produsere det
molekylære grunnlaget for ved hjelp av prosesser i sitt indre. Slike prosesser
kan som nevnt være utsatt for forskjellige slags forstyrrelser. Selv om de kan
stabiliseres til en viss grad, for eksempel av biprodukter av den samme prosessen
eller andre prosesser, er det ikke garantert at den vil holde det gående
bestandig eller produsere det best egnede produktet ufeilbarlig i hver eneste
syklus. Selve livsformen vil også sannsynligvis eksistere bare i noen få
kopier, siden den deler seg bare hvis den vokser så mye at den blir ustabil, og
det ikke er noen garanti for at alt som trengs for livsoppholdet vil bli
overført til hver av delene.
Slike celler utfører
sine begrensede aktiviteter hvis de kommer over det de trenger for å utføre dem,
og hvis de ikke kommer over det de trenger, utfører de dem ikke. En slik enkel
overlevelsesmaskin har også betraktelig færre krav til næringstilførsel enn en
hvilken som helst moderne selvoppholdende organisme. Hvis en prosess som kan
tilføre energi eller som gir opphav til en aktivitet som fører til at mer
energi kan tilføres, oppstår eller holdes ved like ved at et nytt molekyl
kommer inn i celleveggen eller i cellens indre, vil denne prosessen starte,
eventuelt fortsette hvis et slikt molekyl opptrer på et av disse stedene, ikke
noe magisk ved det. Hva slags molekyl dette er spiller ingen rolle, bare det
kan være til stede i celleveggen eller cellens indre og inneholder de aktive
gruppene som er en forutsetning for prosessen, f.eks. en eller flere amino-,
karboksyl-, hydroksylgrupper eller hva som helst. Molekylet kan være en
substans som er innfanget utenfra, eller det kan ha oppstått inne i cellen,
hvis en av disse aminosyrekjedene som oppstår som et biprodukt av lagringen av
energitransportenhetene tilfeldigvis inneholder de nødvendige aktive gruppene i
sidegrenene vil de gå inn i prosessen.
Men hva om det var mulig
for en celle å oppbevare en konstruksjonstegning for alle eller iallfall de
viktigste molekylene den trenger for livsprosessene sine og dermed kunne lage
et ubegrenset antall nøyaktige kopier av dem bare råmaterialene var til stede?
Hva om de også kunne lage kopier av byggebeskrivelsene, slik at det kunne
dannes en serie celler med de samme egenskapene og livsformen ikke var avhengig
av at bare den ene kopien av seg selv skulle overleve?
DNA/RNA brukes idag som
byggebeskrivelse for proteiner som bygges opp av aminosyrer én for én med et
komplisert system som fungerer nokså likt for alle organismer.
Byggebeskrivelsen baserer seg på den genetiske koden, hvor en gruppe på tre
nukleotider (et kodon) betyr en bestemt aminosyre. Idag er denne koden et rent
symbolsk språk, definisjonen av hvilket kodon som koder for hvilken aminosyre
ligger nedfelt i visse kodingsproteiner som en ny celle må få kopier av før den
kan begynne å bygge proteiner. I prinsippet kan altså hvilket som helst kodon
kode for en hvilken som helst aminosyre, og det forekommer også variasjoner som
er få, men til dels betydningsfulle, f.eks. har mitokondriene til mange flercellede
livsformer en litt annen kode. Men denne kodefriheten er trolig noe som har
utviklet seg fordi det gir en sikrere overføring av informasjon, på samme måte
som vi har utviklet en alfabetisk skrift fra billedspråket. Opprinnelig må vi
anta at de forskjellige aminosyrene på en eller annen måte har 'passet sammen'
med de forskjellige nukleotidsekvensene i en nukleinsyrekjede.
Organismer som før hadde
brukt forskjellige enkle kjemiske stoffer til sine livsfunksjoner, ting som de
hadde måttet lete opp utenfor seg eller måtte vente på at skulle dukke opp
eller fremstilt fra forskjellige råstoffer som var mer eller mindre
tilgjengelige, hadde nå sjansen til å lage proteiner utfra standardiserte
råstoffer som trolig var lettere tilgjengelig med de samme egenskapene og
aktive gruppene som de opprinnelige. Det kan ikke ha vært en bevisst prosess,
bare gradvis og trinn for trinn har antakelig proteinene overtatt de enklere
stoffenes rolle, ennå utføres jo ikke alle livsfunksjoner av proteiner. Men med
dette verktøyet hadde organismene helt nye muligheter, de kunne begynne å
bygge, bygge. Bygge kropper.
Formere seg var
sannsynligvis noe de nye livspartiklene gjorde lenge før de fikk RNA og DNA.
Når de hadde tatt inn mange nok stoffer gjennom membranene sine ble de så store
at kuleformen ble ustabil og delte seg i to eller flere deler, gjerne med
uttømming av noe av innholdet som resultat. Gikk delingen ellers bra kunne de
overlevende delene så fortsette å vokse igjen.
Men nå ble det litt mer
system i det. Ikke bare passet aminosyrene og nukleotidene sammen, men noen av
nukleotidbasene passet også sammen innbyrdes, slik at hvis det bare var disse
basene som ble brukt, kunne det lages kopier av dem ved å innpasse nye
nukleotider en og en ved siden av den gamle nukleinsyrestrengen. På en eller
annen måte vente de proteinbaserte livsformene seg til å overlevere
'arbeidstegningene' for livsfunksjonsmekanismene sine til de neste
generasjonene, en prosess som sikkert ikke gikk glatt i begynnelsen, men de som
lyktes bra med det kunne jo fortsette å benytte seg av de fordelene som
proteinene ga dem, og ble snart de dominerende. Idag er både DNA/RNA-kopiering
og proteintranskripsjon høyt avanserte, kompliserte prosesser, trolig svært
forskjellig fra de første nukleinsyrebaserte organismenes enklere
fremgangsmåter.
Hovedoppgaven for alt
som levde var fortsatt den samme som i den første spede begynnelsen, tross all
prosess-spesialisering og organbygging: å skaffe energi nok til å opprettholde
aktiviteten.
Siden faktisk alle
kjemiske reaksjoner innebærer energiomsetning var det en del å velge mellom.
Men som alltid endte vi på et eller annet tidspunkt opp med noen få, særskilt
effektive varianter. En av de tidligste strategiene lå i å utnytte eksterne
energikilder direkte, f.eks. hadde fotoner av vanlig lys akkurat passe energi
til å sette igang forskjellige reaksjoner. Mange av disse reaksjonene var helt
unyttige eller skadelige for organismenes eksistens, enkelte passet kanskje
akkurat for deres behov, mens andre førte til at det oppsto energirike
forbindelser, som livsformen senere kunne dra energi ut av. Naturligvis var det
de organismene som på en eller annen måte dirigerte lysstrålingen til
fortrinnsvis å danne slike energirike forbindelser som klarte seg best og kom
til å dominere, de som kunne lagre solenergien.
Prosesser som innebærer
oksydasjon eller reduksjon av et grunnstoff (ofte kalt redoksprosesser) kunne
også gi energi i passende mengder for grunnstoffer som hadde flere noenlunde
likeverdige oksydasjonstrinn, f.eks. har jern +2 og +3 som det ikke er så
vanskelig å få det til å veksle mellom. Svovel har -2, +4 og +6 som alle er
ganske stabile, og flere forskjellige slags bakterier baserer ennå idag sin
eksistens på redoksprosesser med jern og svovel. Men det store gjennombruddet
kom da noen levende vesener begynte å bruke to av hovedbestanddelene i
omgivelsene, vann og karbondioksyd til å skaffe seg energirike forbindelser, i
en fotosynteseprosess som vi (dessverre) må kalle karbondioksydassimilasjonen.
Fordelen med dette var at disse alene var alt som trengtes for å danne en av de
nyttigste energiforbindelsene, nemlig sukker: 6 H2O + 6 CO2
= C6H12O6 + 6 O2.
Men den store ulempen
var dette biproduktet som står nevnt sist i likningen der: oksygengassen, en
meget reaktiv gass, som alle branninspektører vet, og derfor svært giftig. Alle
organismer idag utstyrer seg grundig for å beskytte seg mot den, men
opprinnelig var de ikke forberedt. På grunn av den forholdsvis enkle
reaksjonen, de vidt utbredte utgangsstoffene og det anvendelige produktet kan
nok denne reaksjonen ha skjedd mange steder ganske tidlig i livets
utviklingshistorie, men organismene der den skjedde var ikke beskyttet og gikk
nok ganske raskt til grunne. Det kan ha gått lang tid på denne måten, men så på
et eller annet vis må en organisme en gang ha inneholdt stoffer som beskyttet
mot oksygenets giftvirkninger (antioksydanter) samtidig som denne reaksjonen
satte igang inne i den, slik at den overlevde. Denne organismen fikk enorme
fordeler overfor de andre, ikke bare på grunn av de nevnte fordelene med
karbondioksydassimilasjon, men også fordi biproduktet forgiftet alle
konkurrentene unntatt de sannsynligvis temmelig få som også på en eller annen
måte var beskyttet mot det.
Heldigvis for dem
inneholdt urhavet en ypperlig redoksbuffer i form av det toverdige jernet som
var oppløst i vannet. Når jern oksyderes til treverdig er det ikke lenger
løselig i vann og felles ut som et rødt bunnfall vi i vår oksyderende verden
kjenner som rust. Over hele verden befinner det seg et tykt rødt sedimentlag
som opprinnelig har vært avsatt i havet. Det er en av de viktigste jernmalmene
og går under navnet Båndjernformasjonen. De eldste båndene er nesten 2,3
milliarder år gamle og de yngste flere hundre millioner år yngre. Mens denne
sedimentasjonen foregikk må oksygenkonsentrasjonen i atmosfæren og havet ha
vært liten på grunn av det stadige forbruket til jernoksydasjon. Først da
mesteparten av jernet i havet var brukt opp begynte oksygenkonsentrasjonen å
stige kraftig.
Og nå begynte ting å
skje raskt, oksygenet fylte havet og atmosfæren, store branner oppsto overalt,
og snart var det nok ikke mange gjemmesteder igjen for de som ikke hadde
beskyttelsesvern mot oksygenet. De eneste som overlevde denne masseutryddelsen
var de som fant veien til de få slike oksygenfrie gjemmestedene, samt de som
rakk å utvikle en oksydasjonsbeskyttelse før det tok overhånd. Da
oksygenkonsentrasjonen begynte å stige må mange ha dødd ganske raskt. Men noen
var mer seiglivet og mens konsentrasjonen steg overleverte de
overlevelsesmekanismene sine til etterkommerne i stadig mer rendyrket form.
Slik har organismer til alle tider reagert overfor miljøforandringer.
Og dette var en
*skikkelig* miljøforandring. Atmosfærene til protoplanetene hadde alle en
sammensetning som liknet solgassene, med hydrogen som hovedbestanddel, altså et
sterkt reduserende miljø, hydrogen er et av de mest brukte reduksjonsmidlene i
vår jordiske kjemi. Selv om Jorda hadde mistet det meste av ur-atmosfæren sin
tidlig i historien var det ennå rikelig med hydrogen og hydrogenrike
forbindelser som metan (CH4) og ammoniakk (NH3) som
sammen med karbondioksyd (CO2) dannet utgangspunkt for det stadige
regnet av fotokjemiske reaksjonsprodukter som hadde vært til nytte for de
tidligste organismene. Nå brant metanet raskt opp. Ammoniakken holdt seg bedre,
men også den ble langsomt, mest gjennom fotokjemiske prosesser, forvandlet til
nitrogenoksyder og nitrogen. Uratmosfærens gasser, livets utgangspunkt, var nå
borte. Livet kunne ikke oppstå igjen. Gikk det til grunne nå, ville det aldri
komme tilbake. Men det hadde utviklet en seig "livs"-kraft og et
fleksibelt verktøy til å tilpasse seg forandringer i nukleinsyrene.
På ganske kort tid fikk
atmosfæren en sammensetning som likner den vi har idag, med nitrogen, oksygen
og vann som de dominerende bestanddelene. En av konsekvensene av dette var at
atmosfæren ble gjennomsiktig for det vi idag betrakter som synlig lys, nemlig
bølgelengdene mellom ca. 4000 og 7000 Å. At det er disse bølgelengdene øynene
våre oppfatter har nok en sammenheng med at det er de som klarer å trenge
igjennom luftmassene. Hadde det vært andre ville nok synsorganene innrettet seg
annerledes. Men lyset i dette bølgelengdeintervallet har også akkurat passe
energi til å innvirke ikke-destruktivt på enkelte kjemiske reaksjoner, og det
hadde antakelig allerede fra før vært ganske vanlig å bruke dem som energikilde
i karbondioksydassimilasjonen, det som vi kaller fotosyntese. Nå fikk jo
fotosyntesen en veldig stimulans med den økte lystilgangen, og de organismene
som brukte den fikk store fordeler fremfor de andre. Når man bruker lys som
energikilde trenger man jo ikke å bruke energi på stort annet enn å strekke seg
etter lyset og ellers forholde seg ganske rolig. Fotosyntesen ble en stor
suksess og brukes i vår verden idag av nesten hele planteriket.
Når organismene klarte å
tilpasse seg den oksyderende atmosfæren var det på tide også å utnytte
fordelene ved den. Før oksygenet ble tilgjengelig utvant sannsynligvis de
fleste organismene energi de hadde lagret i sukkeret med en prosess som vi
kaller gjæring. Den kopieres idag av gjærsopp, som er en moderne, komplisert
organisme og ikke har noe med de første livsformene å gjøre. Her spaltes
glukosen C6H12O6 gjennom den såkalte glykolysen
til to molekyler pyrodruesyre, CH3COCOOH, med to
energitransportør-enheter (ATP) som resultat. Pyrodruesyren kan så omdannes
videre til det ikke ukjente produktet etanol, som finnes i en del varer vi
bruker en del av, helst om kvelden, og gassen karbondioksyd, som hever et annet
produkt vi også bruker en del av, mest om morgenen.
Men en så reaktiv gass
som oksygen kan gi opphav til mer energi for de som tåler den, og vi som har
vent oss til det høye oksygeninnholdet i atmosfæren utvinner energi av sukkeret
ved en annen prosess som kalles respirasjon eller ånding og starter med den
samme glykolysen, men hvor pyrodruesyren forbrennes av oksygen i en ganske
komplisert viderebearbeiding som går under navnet sitronsyresyklusen. Under
respirasjonen forvandles glukose og oksygen til karbondioksyd og vann i en
reaksjon som summeringsvis er nøyaktig den motsatte av
karbondioksydassimilasjonen. Resultatet er hele 36 ATP-energitransportører,
altså 18 ganger så mye som ved gjæringen og mer enn 12 ganger så mye energigevinst
totalt sett når en trekker fra det som går med i den kompliserte prosessen.
Ikke uventet fikk de organismene som åndet fordeler i konkurransen, og de
oksygenforbrukende organismene har nesten total dominans i verden idag, også de
grønne plantene bruker respirasjon til å forbrenne sukker de lager i
fotosyntesen.
Når respirerende
organismer har problemer med å få nok oksygen griper de forøvrig i sin nød til
en prosess som likner den primitive gjæringen, men etter glykolysen blir
pyrodruesyren omdannet til melkesyre, CH3CHOHCOOH, som har fordelen
fremfor gjæringsproduktene at man får et halvt molekyl oksygen som biprodukt.
Likevel blir det ikke stort mer effektivt enn gjæringen og den som har vært ute
og løpt mer enn man har nok O2-opptak til merker fort at det hoper
seg opp syre, og at prosessen gir mye mindre å sparke fra med enn
oksygenrespirasjonen.
Livet innenfor membranene gikk sin gang. Det
fortsatte med å utøve opprettholdende krefter mot de nedbrytende utenfor. De
levende levde innenfor membranene sine og brukte uavlatelig energi på den evige
kampen for å skaffe seg energi. Utenfor membranene var det en annen verden. De
nedbrytende kreftene hørte hjemme der, men derfra kom også de nyttige fotonene
som kunne skaffe sukker, og det fantes andre ting der også, noen nyttige - noen
farlige. Noen som kunne gi næring og oppbyggelse, noen som kunne rive opp og gi
evig, evig ødeleggelse, d.v.s. det vi kaller død.
Da havet fortsatt var
oksygenfritt svevde det mengdevis av karbon-, hydrogen-, nitrogen- og
oksygenforbindelser der, og mange av dem kunne brukes av de som levde innenfor
membranene sine, enten de aktivt oppsøkte dem eller de passivt ventet på at de
skulle dukke opp. Men etterhvert som de levende organismene vokste og ble flere
begynte de å tære mye på disse stoffene, selv om de stadig ble produsert i
atmosfæren. Og det nye oksyderende miljøet ble katastrofalt ødeleggende for
denne nærings-'suppa'. Svært mange av de nyttige forbindelsene ble ødelagt, og
det ble stor nød og det ble gnidsel, men var det også tenner? Det er ikke
sikkert hvilken av disse krisefaktorene som ble utslagsgivende først, men det
er sikkert at noen fant en løsning på den. For om det var tomt med næringsrike
forbindelser utenfor membranene, var det også andre membraner der ute et sted,
og de skjulte også noe, men hva?
Allerede de første
organismene kunne som nevnt dele seg, spontant, ikke fordi de ville det, men
fordi de ble for store til å holde seg i ett stykke. Men på samme måte kunne
små enheter hvis de møttes smelte sammen til større og dele innholdet mellom
seg. Nå ble denne funksjonen brukt med hensikt av energisultne organismer som
ikke fant nok næring i vannet og hadde begynt å aktivt søke opp andre membraner
for å dra nytte av det som var innenfor der. Når de fant dem kunne de gjerne
dele membran med dem som sine forfedre og smelte sammen med dem og dele
innholdet, men særlig etter at nukleinsyrene var tatt ibruk og sørget for
genetisk variasjon, var det forskjell på sammensetningen av plasmaet innenfor
de forskjellige livsformenes membraner. Ikke alt kunne brukes av alle, noe
kunne til og med være farlig for noen. Noen aktive jegere med fleksible og
bevegelige membraner utviklet derfor en annen strategi. De omsluttet det
stakkars offeret i en fold av seg selv sammen med nedbrytende kjemikalier slik
at de kunne fordøye det og få tak i det nyttige innholdet mens det unyttige
eller kanskje også skadelige kunne bli utstøtt igjen. Så lærte livet å jage og
å flykte.
Det store våpenkappløpet
startet opp, og med den fleksibiliteten og tilpasningsdyktigheten som
nukleinsyrene og proteinene ga dem utviklet etterhvert de fryktsomme
flyktningene og de fryktelige jegerne de utroligste angreps-, forsvars- og
fluktmekanismer og handlingsmønstre - for ikke å nevne alt det som ble biprodukter
av all denne våpenutviklingen.
Det var en nådeløs
verden. Redde protoplasmablærer svømte omkring i verdenshavene og visste ikke
hva som skjulte seg i mørket utenfor. Men ikke alt som svømte i mørket var
fiender. Et av de beste forsvar mot angrep var antall. Så begynte noen å
utvikle følelser for andre individer av sin egen art og søkte sammen i
kolonier. Vennskapet kom inn i verden. Ja, vennskapet behøvde ikke å være bare
mellom artsfrender heller, i såkalt symbiose lever forskjellige arter sammen og
samarbeider, f.eks. om beskyttelse. Og selv om alle cellene tilhørte samme art,
behøvde de ikke være like. I noen kolonier organiserte de seg slik at enkelte
av cellene spesialiserte seg for å ta seg bedre av bestemte oppgaver enn hver
av cellene klarte alene. En gang slo noen celler seg sammen og drev samarbeidet
og spesialiseringen svært langt.
En celle la seg i midten
og skulle være sjef og kommando- og proteinproduksjonssentral for alle de
andre. De andre påtok seg all oksygenomsetning, sukkerproduksjon, motoriske
bevegelsesfunksjoner og andre grunnleggende kjemiske oppgaver som alle celler
til da hadde måttet utføre alene. Det hele ble dernest omsluttet av en membran
slik at kolonien til slutt ble å betrakte som en eneste stor celle, en såkalt
eukaryotisk celle med kjerne, til forskjell fra de eldre prokaryotiske.
Muligens stammer slike eukaryotiske celler fra kolonier av spesialiserte celler
av samme art, men det er også ting som tyder på at de spesialiserte celledelene
eller organellene stammer fra celler av andre arter som vertscellen har
oppslukt for å utnytte spesialiserte funksjoner som den ikke kunne utføre selv.
Men også de eukaryotiske
cellene som helhet visste om vennskap og samarbeid, mange slo seg sammen og
dannet kolonier, og også i disse koloniene kunne det skje en spesialisering av
medlemmene. Snart strakk også her de eukaryotiske cellene samarbeidet lengre
enn prokaryotene. Ved utveksling av signalstoffer kunne de arrangere en mer
koordinert vekst og spesialisering av kolonien. Men da var det en fordel at
alle cellene var enige i hvordan dette skulle gjøres, og derfor startet slike
kolonier ofte med en enkelt celle som delte seg og produserte alle de andre
individene. På denne måten hadde alle kolonimedlemmene oppskriften i sitt indre
på hvordan kolonien skulle bygges, og alle som ble utpekt til å spesialisere
seg visste hva deres oppgaver var. Kolonier med slik koordinering som dette var
ikke lenger å betrakte som en samling av enkeltindivider, men et enkelt individ
selv av en større, mer organisert organisme.
Nå kunne de levende for
alvor begynne å bygge kropper. Og det var ikke måte på hvordan de vokste seg
til. Mens årmillioner gikk svelte de opp i rader, kolonner og masser av
koordinerte celler til de ble som kjemper, som mammuter, ja enda større. Alle
de makroskopiske (d.v.s. ikke mikroskopiske) livsformene vi kjenner er
eukaryotiske, oppbygd av celler med kjerne. Prokaryotene er bakterier og
enkelte andre encellede organismer, hvorav også noen kolonidannende.
De flercellede vesnene
levde og trivdes og vokste, de levde på sollyset, på hverandre, på prokaryoter,
på levninger av døde kropper, det var det de hadde å velge mellom. Som sine
encellede forfedre delte de seg når de ble store nok og ble til nye individer
av samme art som spredde seg og befolket verdenshavene. Siden kroppene deres
hadde spesialiserte organer kunne jo ikke dette skje bare ved simpel kløving på
midten, men en gruppe av mer eller mindre udifferensierte celler måtte velges
ut til å fortsette slekten, skyte knopper og rive seg løs når tiden var inne
til det. Alle cellene i dette avkommet ble jo i prinsippet identiske med
foreldrene, som dermed hadde lagd en klon av seg selv.
Men organismene hadde på
dette tidspunktet opplevd en rekke miljøforandringer hvor mange livsformer som
hadde vært godt tilpasset det gamle miljøet hadde gått til grunne fordi
individene var for like, det var ikke nok genetisk variasjon innen arten til at
noen få med avvikende egenskaper som passet bedre for de nye forholdene klarte
seg og kunne bringe arten videre. Andre arter som på en eller annen måte hadde
utviklet en måte å skaffe seg genetisk variasjon på klarte seg derfor bedre
under slike omveltninger og fikk derfor stor utbredelse. Etter en
klimaforandring hvor leveforholdene blir gunstigere igjen vil det dessuten
alltid være en mengde ledige økologiske nisjer, og de som har mest genetisk
variasjon vil ha lettest for å vinne det kappløpet som oppstår for å fylle
disse nisjene.
En viss genetisk
variasjon vil alltid forekomme, som følge av mutasjoner etter påvirkning av
stråling, kjemikalier og andre ting. Men noen livsformer påskyndet denne
variasjonen, fortrinnsvis i mer kontrollerte former enn de tilfeldige
mutasjonene. En populær måte å gjøre det på var ved at to individer ble tiltrukket
av hverandre og møttes for å utveksle arvestoff med hverandre. Kjærligheten
hadde kommet inn i verden.
Eukaryotene som hadde så
mange høyspesialiserte celler, kunne gjøre det litt annerledes. I kjernene sine
hadde de alle gruppert nukleinsyrekjedene sine i kromosomer, hvor DNA'et var
snodd opp i en dobbeltspiralform. Langs kromosomene lå genene hvor
arbeidstegningene til hele organismen med alle dens egenskaper,
bygningsdetaljer og atferdsmønstre lå innkodet på rekke, en og en. Og dessuten
hvert kromosom forekom i to kopier, slik at det var to versjoner av hvert gen.
Hvis de to versjonene var forskjellige, ble egenskapen som genet kodet for
enten en blanding eller det ene genet fikk fortrinn over det andre på en eller
annen måte. Nå kunne eukaryotene lage en slags celler som var spesialberegnet
på å skaffe genetisk variasjon, og det gjorde de ved å spalte opp disse
dobbeltkromosomene og legge en halvpart i hver, og hvert kromosom ble også
spaltet opp og stokket om slik at det var tilfeldig for hvert gen eller en
gruppe av gener hvilken av de to versjonene som havnet i hvilken halvpart.
Når de hadde laget disse
såkalte kjønnscellene var det så om å gjøre å finne et annet individ av samme
art slik at dets egne kjønnsceller med en tilfeldig halvpart av genmaterialet
kunne komme sammen med motpartens og smelte sammen og bli ett, slik at de halve
arvestoffmengdene kunne bli et hele igjen. Dette var en komplisert operasjon,
og det var mange hindre i veien for at det skulle lykkes. Men som vi alle vet
er belønningen for suksess stor, og livsformene brukte mye energi og fantasi på
å forsere hinderne.
Et av de hindere som lå
i veien for å skaffe mer genetisk variasjon var at det ikke ble noen særlig
variasjonsgevinst når to kjønnsceller fra samme individ smeltet sammen. De
organismene som på en eller annen måte klarte å forhindre dette fikk dermed
bedre variasjon og klarte seg bedre i det lange løp. En meget populær måte å
ordne dette på ble å sørge for at det var to slag kjønnsceller, og at
kjønnsceller av samme slag ikke kunne slå seg sammen og befrukte hverandre.
Dermed ble populasjonen delt i to deler, en gruppe som produserte den ene typen
kjønnsceller og en gruppe som produserte den andre. Vi kunne dermed snakke om
at de forskjellige individene av samme populasjon var av forskjellig kjønn, noe
som skulle vise seg å føre til en rekke forviklinger gjennom tidene.
Men resultatet av en
slik sammensmelting av kjønnsceller var altså alltid en enkelt befruktet celle.
Enkeltceller av høyt spesialiserte og differensierte organismer har som regel
litt problemer med å klare seg på egenhånd. Det samme gjelder forsåvidt de
knoppene som knoppskytende organismer skyter, og det måtte derfor treffes
tiltak for å sørge for dem til de ble i stand til å klare seg selv. Dermed kom omsorgen
inn i verden, og den kunne ta en rekke former, enten det gjaldt å spandere en
plomme til egget før det ble satt i drift eller det gjaldt kontinuerlig indre
og ytre omsorg opptil og tilogmed over pubertetsalderen slik enkelte
pattedyrarter driver med.
Samarbeid var på moten.
Prokaryoter hadde først dannet kolonier og så satt seg sammen til eukaryotiske
kjerneceller. Så hadde eukaryotene dannet kolonier og siden enda mer
koordinerte enheter, flercellede organismer. Nå begynte også enkeltindivider av
slike flercellede vesener å slå seg sammen og agere som koordinerte
makroorganismer. Resultatet ble leddormer, som delte fordøyelseskanal, men
ellers hadde hvert sitt sett av alle nødvendige organer. Siden ble enhetene
tettere sammenknyttet, flere organer ble delt, leddene mer spesialisert og det
oppsto en mengde varianter av dyr med ledd: marker og ormer i alle fasonger,
bløtdyr med indre eller tilbakedannet leddstruktur, krepsdyr, insekter, samt vi
dyr som har hvirvler oppetter ryggen på oss.
En gang for ca. 550 millioner år siden lå verden
under for en usedvanlig langvarig og omfattende istid som slet fjellkjedene ned
til røttene og drepte mesteparten av de livsformene som fantes i havet. Da den
var slutt, begynte et kappløp uten sidestykke i historien. Denne prosessen
danner grensen mellom Jordens urtid og oldtid, skillet mellom
prekambrium-perioden som utgjør hele urtiden, og kambrium, som er den første av
oldtidsperiodene. Prosessen kalles ofte "kambrium-eksplosjonen" eller
"det biologiske big bang". Etter dette tidspunktet har livet stort
sett vært oppdelt i de samme hovedfamiliene som i dag.
Etter slike
masseutsryddelser skjer det alltid slike eksplosive spredninger av varierte
livsformer, fordi under de gunstigere betingelsene opphører den darwinistiske
utvelgelsen, det er bare variasjonen som gjelder, og det er ikke bare de aller
best tilpassede som overlever. Under slike eksplosjoner finnes det ikke
økologiske nisjer, for det er rikelig med plass og mat til alle, nisjene oppstår
først når organismene begynner å konkurrere. Når to eller flere organismer
konkurrerer om de samme ressursene vil det raskt peke seg ut en vinner. Taperne
går enten til grunne eller overlever hvis de har variert nok smak til at ikke
alle variantene konkurrerer med vinneren eller hvis de er i stand til å slå ut
vinneren på et annet geografisk sted med andre betingelser.
Slike masseutryddelser
er også årsak til kjærlighet, for i den eksplosive fasen er selvsagt den
kjønnede formeringen, som innebærer mer variasjon en stor fordel. Derfor vinner
den over den ukjønnede, selv om denne er betraktelig mer ressursbesparende. At
ukjønnet formering er ressurseffektivt ser vi f.eks. på løvetann, som er vidt
berømt for sin formeringsevne. I vår tid er det jo lenge siden siste
masseutryddelse, og kanskje det er derfor våre hageeiere må slåss med slike
plageånder. Vi kan kanskje si at masseutryddelser er hageeierens beste venn.
(Hm, hva var det forresten Robert Oppenheimer drev med på fritida igjen?)
Virkningen av
kambrium-eksplosjonen er spesielt tydelig for oss etterkommere fordi
organismene på denne tiden begynte å bruke kalkskall, slik at levningene, som
før bare besto av bløtdeler, ble atskillig bedre bevart. Dette skjedde
antakelig på grunn av en kjemisk prosess. Det er kjent store avsetninger av
kalk fra denne tiden som ser ut til å være utfelt kjemisk fra oppløst kalk i
havet, enten fordi karbondioksydinnholdet sank (vann som er mettet på
karbondioksyd løser 80 ganger så mye kalsiumkarbonat som rent vann) eller
vannet ble mindre surt på en annen måte (surt vann løser kalkstein, som man
f.eks. ser på bygninger og skulpturer av marmor i sur nedbør).
Under en slik kjemisk
utfellingsprosess kunne det spontant danne seg skall av kalsiumkarbonatkrystaller
rundt mange livsformer, noe som utvilsomt skapte problemer i begynnelsen, men
som alltid, i cellekjernene sine hadde livet verktøyet til å tilpasse seg
forandringene. De som overlevde klarte etterhvert å kontrollere skalldannelsen
og utnytte den til sin fordel, og dyr med kalkskall begynte å vokse i en mengde
fasonger. Da den kjemiske utfellingsprosessen stoppet opp lærte de også å
trekke ut kalsium- og karbonationer (eller i noen tilfeller andre ioner) av
vannet selv.
Skallet ga beskyttelse
mot fiender og støtte til strukturen og var til velsignelse for paleontologene.
Men fiendene ga ikke opp våpenkappløpet i denne panserkrigen, de utviklet
kjever med kvasse, harde kalkkonstruksjoner, og med tid og stunder ga mange som
var for fryktinngytende til å ha noen fiender selv eller som hadde utviklet mer
smidighet og fart, avkall på de mer og mer nytteløse rustningene sine, de
vokste ut av dem, utviklet de nye evnene sine videre og lot rustningene i
høyden være igjen i det indre som strukturbærere og beskyttelse for de mest
ømfintlige organene.
Men nå var det begynt å
bli trangt om plassen i havet, og særlig på bunnen av det, hvor de fastboende
hadde bare to dimensjoner å boltre seg i (generelt sett). Men i fjæresonen
hadde plantene lenge måttet overleve i regelmessige perioder uten vann og de
som klarte seg der kunne også overleve i vasstrukne kyststrekninger med sumper
og myrlendte områder. Bakterier og moser var vel de første som tilpasset seg
livet oppe i lufta, sammen med enkle planteslag vi ikke kjenner idag. Alle
trengte de fuktige omgivelser for å overleve og formere seg. Men fuktige steder
holder seg ikke fuktige bestandig, og for drøye 400 millioner år siden (i
silurtiden) kom vi inn i en periode med mye vulkanisme, jordskorpebevegelser og
flytning av kystlinjer.
Mange kystplanter kom
plutselig bort fra kystene sine og klarte seg bare hvis de mer eller mindre
effektivt kunne søke etter vann, innkapsle det mot fordamping og enten lage et
indre simulert hav til formeringsorganene eller utvikle formeringsorganer som
ikke var avhengige av vann. Da kunne de også klare seg utenfor myrene og
sumpene og begynte å trekke innover det tørre landet, og i den noe fuktigere og
klart roligere perioden som fulgte etter ble landarealene kolonisert i rasende
fart. Og heller ikke de dyrene som levde i fjæra var sene om å tilpasse seg.
Leddyr, mark og insektliknende former fulgte innover i landet og var med på å
kle fjellene.
Og vi virveldyr var
heller ikke sene med å følge med innover. Noen av de fiskene som klarte seg best
i fjæra var de som var utstyrt med ekstra kraftige, ofte kvastformede finner
som ikke bare var greie å luffe rundt i vannet med, men også var sterke nok til
at de kunne ake seg bort til nærmeste pytt med dem hvis de ble overrasket av
lavvannet. Fiskenes gjeller var dårlig egnet til å utvinne oksygen fra lufta
med, og dermed måtte de som strandet på lavvannsterskler greie seg uten oksygen
så lenge som det tok å komme ned i nærmeste pytt, noe som nokså ofte var for
lenge, eller utvikle måter å trekke oksygen fra lufta på, hvor den jo fantes i
rikelig mengde. Luft i tarmen kunne diffundere inn i blodårene omkring, og noen
fisk dannet seg etterhvert en utposning på tarmen bak gjellene som de kunne
trekke litt luft inn i. Slike fisk kaller vi derfor lungefisk. Noen av deres
etterkommere vendte tilbake til dypere vann igjen, men beholdt disse blærene,
for gassen var lettere enn vann og ga oppdrift slik at man kunne bruke energi
på andre ting enn å stadig piske med finnene slik de andre fiskene måtte hvis
de ikke skulle synke ned til næringsfattige dyp med knusende trykk og mørke.
Noen av etterkommerne til disse fiskene går ennå idag opp til overflaten for å
trekke luft og fylle svømmeblærene sine, men andre har en lukket svømmeblære
som de fyller med gasser de utvinner av vannet.
Men lungefiskene klarte
å overleve på land atskillig lengre enn det tok å ake seg til nærmeste pytt nå,
og de ble ikke stående rolig og se på at åsene og fjellene og markene ble
kledt. Akemekanismene ble stadig effektivere ettersom de som eide dem klarte
seg bedre, og om litt resulterte det i et vesen som liknet en salamander, med
brei fiskekjeft, finnehale og fire komiske finner på korte, leddete stilker
hver med en kvast på fem finnestråler som det bare hang noen rester av finnehud
imellom - det første av amfibiene. Vi var krøpet på land, men fortsatt var vi
ikke helblods landdyr, vi la eggene våre i vannet og lot avkommet vokse opp
der, og vi måtte alltid dukke nedi selv med jevne mellomrom for å holde huden
våt. Egentlig var vi ikke mer enn fisk som hadde lært å klare seg på land, vi
hadde gjeller langt opp mot voksen alder og i noen tilfeller mer, vi kunne
aldri bevege oss langt fra åpent vann og vi svømte og boltret oss like godt i
vannet som på land.
Så var det også en
trivelig tid for oss den vi var inne i, for rundt 300 millioner år siden.
Klimaet var fuktig over alt, det vokste store skoger av fuktighetskrevende
trebregner og kjempekråkeføtter og det var sumpete og vått i store strøk. Det
yrte av ting som levde og grodde, og når de var ferdig med det sank de til
bunns sammen med de levendes etterlatenskaper og dannet torvlag i det
oksygenfattige sumpmiljøet. De breie, strie elvene fylte sedimenter over det og
det kom på stadig større dyp og ble utsatt for trykk og varme. Livs-restene som
hovedsakelig besto av de samme grunnstoffene, C H N og O som de levende og som
ur-atmosfæren, ble etterhvert fattigere på de tre siste og rikere på den
første. Mektige lag av kull la seg over hele planeten og ga navn til denne
perioden, karbon-tiden.
Men karbon-tiden varte
ikke evig. Det ble tørrere igjen, store skoger av fuktighetskrevende planter
gikk til grunne - hvis de ikke utviklet vannsøkende evner. De første nåletrærne
opptrådte, med kraftige røtter, og dannet snart vide skogområder, få kvadratmeter
med land var trygge for dem. Vi virveldyr som hadde krøpet opp på land befant
oss også rett som det var i tørkepine, og hvis vi ikke hadde funnet måter å sno
oss på ville vi snart krøpet vårt siste krypesteg. Men som det heldig var
utviklet vi en vanntett hud som ikke trengte å vætes og tykke, vanntette skall
til eggene våre så vi kunne legge dem på land. Vi var krypdyr, og vi krøp over
kontinenter, over fjell og daler. Ingenting stanset oss nå.
Jordens oldtid var over
og vi hadde begynt på middelalderen, koloniseringen av landjorden var fullendt.
Tettheten av livsformer var omtrent like høy som idag. Frøplanter, krypdyr og
tallrike insekter myldret overalt. Det var krypdyrenes glanstid. De dominerte
landjorden og tilpasset seg de nye miljøene overalt hvor de kom og fant
ressurser det gikk an å benytte. Noen svingte seg opp i lufta og fikk vinger,
noen vendte tilbake til havet og fikk finner, noen prøvde seg i kalde områder
eller holdt seg aktive om nettene og de utviklet et indre oppvarmingssystem.
Akkurat dette siste her
skulle vise seg å bli en veldig praktisk ordning som ikke bare kom til nytte i
kulde. Vi varmblodige dyr fant ganske raskt en balanse hvor kroppstemperaturen
var slik at våre kjemiske reaksjoner fungerte best mulig etter forutsetningene.
En ca. 37 grader celsius. Der våre medskapninger sto lenge og varmet og
godgjorde seg i morgensola for å bli kvikke og raske kunne vi snappe opp maten
foran nesene på dem - og gjerne dem selv også om det lå an til det. Derfor
nøyde vi oss ikke med de kjølige stedene vi hadde utviklet oss på, vi trengte
inn på deres enemarker, vi vokste oss store og herjet iblant dem, vi fikk
grufulle tenner og klør og barket sammen i blodsprutende innbyrdes kamper,
marken ristet under oss, som om den skalv av redsel under klovene våre. Vi
danset seierherrenes dans, utøvde de uovervunnes energi. Alle fryktet oss, vi
var dinosaurer - bokstavelig talt. Nok er nok.
Enten det var nedslaget
av en kjempemeteor eller oppåpningen av Atlanterhavet eller hva som helst annet
det var som skjedde, skjedde det iallfall noe som utryddet dinosaurene og
nesten alle de andre store krypdyrene. Sannsynligvis var det et kuldesjokk som
var ansvarlig for det. De store dyrene klarte ikke å få opp varmen og frøs
ihjel. Eggene deres klektes ikke. Utryddelsen ser ut til å ha skjedd veldig
brått, og rammet en mengde skapninger andre steder også, blant annet i havet.
Men ikke alle gikk til grunne.
Av oss landvirveldyr hadde de som på en eller
annen måte var beskyttet mot kulda og som også beskyttet avkommet sitt best
sjanse til å overleve. Etter alt å dømme var det noen mindre dinosaurer som
først utviklet noen underlige forgrenede strukturer til å dekke kroppen sin
med, sannsynligvis ikke som følge av katastrofen, men fordi de allerede tidligere
hadde begynt å oppsøke de mer polare strøk av planeten. De begynte også å ruge
på eggene sine for at de ikke skulle bli kalde og når kyllingene kom sørget de
for mat til de var i stand til å klare seg selv. Disse skapningene hadde klør
som de kunne bruke til å klatre med, bl.a. i trær, dermed var det noen ganger
ønskelig å kaste seg fra et tre til et annet i stedet for å klatre helt ned til
roten av det ene og oppover det andre igjen, og på et eller annet tidspunkt
utviklet noen av disse forgrenede strukturene som vi kaller dun seg til stivere
konstruksjoner av samme slag som vi kaller fjær. Når skapningene strakk ut
armene som fjærene var montert på var det så lett som bare det å seile fra tre
til tre, og etter en god del flere modifikasjoner var disse fuglene klare til å
erobre himmelrommet.
Andre overlevde på andre
måter. Noen av dinosaurenes fjernere slektninger, som også var varmblodige,
hadde utviklet noen andre utvekster som ikke var forgrenede til å dekke kroppen
sin med, og når ungene kom ut av egget ga de dem næring av sin egen kropp via
omdannede svettekjertler på buksiden av kroppen. Noen av slektningene deres
sluttet å danne skall på eggene slik at hviten rant ut når fødselen begynte og
ungen måtte begynne på det selvstendige livet straks den var ute av den trygge
mammahulen. I stedet for skall hadde de et arrangement som kalles morkake og
som transporterte næring direkte fra moren slik at ungene kunne vokse seg
ganske store før de kom ut i verden. Atskillig ubehageligere for moren enn å
legge slike runde, små egg, men mye sikrere for avkommet.
Samtidig hadde allerede
insektene (lenge før fuglene) erobret luftrommet, plantene tok konsekvensen av
det og begynte på omtrent denne tiden å blomstre, og nå for 65 millioner år
siden hadde vi altså, etter at virkningene av den store katastrofen hadde gitt
seg, verden omtrent slik vi kjenner den idag. En riktig koselig verden sett med
våre øyne, hvor solen skinte, løvet grøntes, fugler sang på kvistene, blomster
lyste opp engene, bier summet til og fra og varme vesener elsket og sørget for
ungene sine. Bare noen steder i dunkle skoger lød dype brøl og det glimtet av
hvite tenner i gapende kjefter.
Det hadde vært en dårlig
dag. Over hadde trekronene den ville fektingen og himmelen de uskinnende,
kontrastsvake fargene som betydde at man skulle klamre seg til hverandre og
holde varmen og ikke våge seg ute av syne fra hverandre hvis det var mulig å
unngå det. Likevel hadde hun raskt funnet ut at han var borte. Han var ofte
slik, alltid skulle han ut og gjøre ting på egen hånd så hun ble redd og ikke
visste om han ville komme tilbake. Men aldri før hadde han blitt borte på en
slik dårlig dag som dette. Hun likte så godt å være sammen med ham, han gjorde
alltid så mye rare ting og fikk henne til å le så det kilte og prikket deilig i
hele kroppen. Ingen kunne gjøre så mange rare ting som han. Men en dag ville
han gå bort for å finne noe som skulle imponere alle de andre slik han alltid
på død og liv skulle gjøre og så ville de vente hele dagen og når natten kom ville
de alle sove. Bare hun ville ligge våken og fortsatt vente slik det hadde
skjedd så mange ganger før, bare at nå ville hele den neste dagen gå på samme
måten og den neste natten og dagen også og den neste natten og dagen, og de
andre ville etterhvert bare tenke på ham av og til og riste på hodet med et
rart uttrykk i ansiktet og til slutt glemme ham, men hun ville aldri, aldri
glemme.
Da lød et skrik som fikk
alle til å reise seg brått og se seg rundt, for alle visste hva det betydde,
det betydde at noe nærmet seg. Ingen var så brå som hun og ingen skrek det
ropet som betydde velkommen så høyt som hun gjorde da hun så hvem det var, for
det var ham, han ville komme tilbake denne gangen også og det ville kile i
kroppen og de ville balle seg og ha det moro som de alltid pleide å gjøre på
denne tiden av året. Han hadde noe i hånden. Typisk, alltid hadde han det når
han kom tilbake. Alle stormet ut for å hilse på ham, men stoppet da han skrek
et rop som de alle visste hva betydde, for det betydde fare. Han hadde noe i
hånden. Han løftet det høyt og pekte på det og mumlet noe lavt som alle visste
hva betydde, det betydde at de kunne komme nærmere, men forsiktig. Han tok det
han hadde i hånden ned til munnen og blåste på det, og de så at det begynte å
lyse og det kom rop som alle visste hva betydde, det betydde undring, halvveis
engstelig undring. Så sa han et ord. "Glo," sa han. Ingen visste hva
det betydde. Bare forundret risting på hoder og kløing i hårete skallebrasker.
"Glo, glo, glo, glo, glo, glo, glo, glo, glo, glo, glo," sa han.
Ingen visste hva det betydde, og de klødde seg og ristet på hodene og noen
trakk seg litt engstelig tilbake. Så sa han noe som alle visste hva betydde,
for det betydde misnøye og ergrelse. Han holdt tingen høyt og brøytet seg mellom
dem og gikk borttil noe tørt gress som hadde ligget i ly. Der blåste han på
tingen igjen og satte den borttil gresset. Det som skjedde nå utløste et kor av
mange rop som alle visste hva betydde, men det var ikke så lett å forstå
likevel, for ingen ropte det samme, det luktet nemlig karbonisering i lyet og
det de fikk se var noe som ingen hadde sett i verden før. De ropte skrekk,
angst, gru, forferdelse, avsky, hån og sinne. Bare en av dem var stille, og hun
visste at verden aldri ville bli den samme igjen. For nå visste de hva
"glo" betydde.
Kjødet hadde gytt ord
som tok bolig iblant oss. Og ordet satte seg fast på ting, på handlinger,
beskaffenheter, måter, relasjoner, på venner, elskere og fiender, på jord og
himmel, trær, ild, skyer, lyn, på alt. Det var det som var så fint med dem, de
kunne brukes til alt, det var ikke grenser for hva man kunne sette navn på med
dem. Man kunne sette navn på ting som alle visste hva var, men også på ting som
ingen før hadde sett eller opplevd, og begrepsverdenen ble videre og videre. De
som eide ordet kunne bevege seg utenfor grensene, kunne gjøre ting som ikke var
vanlige, som ikke var normale, som ikke var riktige. De kunne hente glør ut av
ildebranner, hugge egg på flintestykker, opprette vennskap med villdyr, la frø spire
på beskyttede steder, brenne metaller ut av rare steiner, synge, male, hugge i
stein, fortelle fantastiske historier, finne på religioner som påstår at dyrene
og plantene ikke er venner, men slaver, lede flokker uten å bry seg om
individene, drepe fiender som ber om nåde, ja, ingenting var umulig lenger.
Vi var skapningens herrer, vi erobret kontinenter,
fjell og daler, hav og havbunn, luft og lufttomt verdensrom, ingenting kunne
stoppe oss. Vi var skapningenes herrer, vi trengte inn på deres enemarker, vi
var store og herjet iblant dem, vi smidde grufulle våpen og barket sammen i
blodsprutende innbyrdes kamper, marken ristet under oss, som om den skalv av
redsel under hjulene våre. Vi danset seierherrenes dans, utøvde de uovervunnes
energi. Alle fryktet oss, vi var skapningens herrer.
Du holder opp å lese det
du leser på. Du går ut av browseren, avslutter Windows og slår av maskinen. Du
er tørst og sulten etter all lesinga og tar en pizza ut av fryseren og setter
den i mikroen mens du henter en pils fra kjøleskapet. Pizzaen er sviende varm
når du tar den ut, du brant deg litt og fekter med hånden for å lindre. På TVen
går en fotballkamp. Du følger med litt og tenker litt på den dritkjedelige
jobben du skal til intervju på i morgen, litt på Grete, som ikke ville ut med
deg igår, har hun en annen? - litt på bilen som det antakelig er for seint å ta
en skikkelig understellsbehandling på nå, litt på faren din som antakelig hadde
rett da han sa at du skulle ha jobba mer på gymnaset, litt på mora di, som du burde
ha besøkt på sykehuset, på lillesøstra di, som kom innom og vifta med en 1,4 i
molekylærbiologi-I fra universitetet for et par uker siden. Du reiser deg på
stillingen 0-3 til favorittlaget, samler sammen pizzafolien og pilsflaska som
ble tom altfor fort og går ut på kjøkkenet hvor du blir stående og stirre litt
ned i de krombelagte aluminiumsplatene før du raskt finner veien til toalettet
- var det noe galt i pizzaen? Etterpå kryper du til køys og trekker ei dyne
over deg. Så blir du borte, skapningens herre.
Lite aner vel du at de
første herreskapningene kom fra små kuler av lipider i urhavet som begynte å
holde seg ved like ved å utvinne energi. Lite aner du at de kom fra disse aller
første livsmolekylene via fullbefarne prokaryoter og sammensatte eukaryoter som
dannet energi av lys eller jaktet på den som andre hadde lagret, via
flercellede vesener med fordøyelseskanaler som de en gang fant på å dele, via
fisk som førte panserkrig med trilobitter og ammonitter i havet, som kravlet på
land for å jakte på energi som var lagret oppe på det tørre, som utviklet
vanntett hud og eggeskall mot tørke og varmt blod, pels og ammestell mot kulde,
som fant ild og ord og svarte rester av brente trær.
De svarte trerestene
hadde en interessant egenskap. De var sotete. Det ble svarte streker etter dem
når man strøk dem bortover hud eller stein. Snart fant herreskapningene ut at
de sotet bedre ved å brenne treet med minst mulig luft til stede, og de kalte
produktet trekull. De fant ut at det var mange andre ting man kunne brenne
også, og fett, talg, voks, tran og olje brant så kontrollerbart at de kunne
brukes som lyskilder. Og denne lysflammen kunne også sote, den ga et rent, fint
sot som man kunne skrape bort og bruke til å male med og skrive med og mange
andre ting. Også flere ting i verden kunne sote. I det romerske Britannia
pleide de innfødte å grave opp de omvandlede og ganske sotende planterestene
etter amfibienes store æra og bruke dem til å fyre med. De kalte det steinkull
for å skille det fra trekullet, men siden ble det bare dette som kaltes kull.
Mot slutten av middelalderen grep kullfyringsskikken om seg og forårsaket store
ubehag og protester på grunn av røyken. De fleste steder innførte forbud mot
kullfyring, men siden kom industrialismen, og da var det ikke til å stoppe. En
annen ting som på en måte kunne sote var visse grå, bløte mineraler, som siden
oldtiden ble mye brukt til skrive- og tegneverktøy, liksom kullstiftene, og de
gikk ofte under navnet grafitt. En ting som slett ikke kunne sote var noen skinnende
hvite smykkesteiner, klarere enn glass og hardere enn det hardeste stål og
derfor ble kalt diamant.
En av de tingene stein-
eller trekull ble brukt til fra de tidligste tider var å fremstille jern fra
malm. Malmen var ofte i oksydform eller behandlet for å gjøre den til oksyd, og
kullet fungerte som reduksjonsmiddel. Men kullet viste seg å være løselig i
jern, og den mer eller mindre kullrike blandingen kaltes stål. Smedene lærte
seg snart å kontrollere kulltilsetningen for å få stål- og jernarter med
forskjellige egenskaper. Denne kunnskapen gikk i arv gjennom generasjoner av
smeder, men forble ukjent for omverdenen inntil den franske naturforskeren René
Antoine Ferchault de Réaumur (som også er kjent for en temperaturskala) tidlig
på 1700-tallet erklærte at jernmaterialene kunne deles i stål, smijern og
støpejern, og forskjellen kom av innholdet av et svart, brennbart materiale som
han hadde funnet ut var det samme som hovedbestanddelen av trekull.
Den franske kjemikeren
og agronomen Henri-Louis Duhamel de Monceau studerte kort tid senere
trekullprosessen og bestemte seg for at den måtte bestå i at flogiston (et
hypotetisk "ild"-element som var mye på moten i den perioden) ble
konsentrert i trekullet. Når det siden ble brent slapp flogistonet ut igjen og
kom til syne som ild og varme. Den svenske kjemikeren, mineralogen og
redaktøren Torbern Bergman var uenig med Réaumur og mente at det var grafitt
som ga stålet og jernet de karakteristiske egenskapene. Han fastslo også at
grafitt besto av "fiksert luft" (d.v.s. luft som noe hadde brent i
til det ikke klarte å brenne mer) og flogiston. Hans naturaliserte landsmann,
kjemikeren og apotekeren Carl Wilhelm Scheele, støttet delvis denne tesen da
han i 1779 offentliggjorde eksperimenter som viste at grafitt kunne brennes ved
hjelp av salpeter og påsto at den ikke besto av annet enn en stor mengde
flogiston forbundet med "luftsyre".
Men luftsyre var navnet
han brukte på gassen som gjorde vann surt og blakket det hvis det var kalk i
det, og det var den samme gassen som ble dannet når trekull brant - altså måtte
trekull og grafitt bestå av det samme! Men Joseph B. Priestley hadde lenge
gjort eksperimenter med luft, han fant at den ble "skadet" eller
ubrukelig til å puste i (eller med et annet ord "fiksert") hvis han
stengte et kvantum luft inne og lot noe brenne eller puste i det. Men hvis han
satte en grønn plante der inne og lot den få nok lys ble den skadde luften god
som ny igjen. I 1774 fremstilte han som følge av disse eksperimentene oksygen
og tre år senere gjorde Antoine-Henri Lavoisier, den moderne kjemiens far,
eksperimenter med denne gassen som definitivt viste at forbrenning ikke besto i
at flogiston ble fjernet fra det brennbare stoffet (med mindre det hadde
negativ vekt) men i at det forbandt seg med oksygen og dannet oksyder.
"Fiksert luft" var ikke noe annet enn et oksyd av det stoffet som
fantes i trekull og grafitt, og Lavoisier, som var ute etter å revidere kjemien
og lage en ny definisjon på grunnstoffer som substanser man ikke kunne oppløse i
bestanddeler, den samme som vi bruker idag, måtte dermed etter Scheeles
eksperimenter konkludere at trekullet og grafitten inneholdt et slikt
grunnstoff, som han kalte karbon.
Allerede i 1694-95
gjorde florentinerne Giuseppe Averani og Cipriano Antonio Targioni et dyrt
forsøk, sponset av den sikkert angrende storhertugen Cosmus III av Toscana, som
viste at diamanter ikke er like varmebestandige som andre steiner, men
forsvinner uten et spor hvis det blir varmt nok. Den franske, skotskættede
kjemikeren Pierre-Joseph Macquer og noen venner slo i 1771 raust pjaltene sine
sammen og opphetet en feilfri diamant i en smelteovn til den brant med en
tydelig flamme ved 1100 °C. Juvelerene ble skeptiske av disse opplysningene,
for de hadde ofte opphetet diamanter til enda høyere temperaturer for å fjerne
bestemte typer feil. Macquer lot den berømte diamantsliperen Maillard få
sjansen til å vise at han hadde rett og lot ham slippe til i laboratoriet sitt
hvor han pakket tre diamanter inn i kalkstøv og trekullpulver, vætet pakningen
og lot den tørke igjen for å gjøre den tett, og varmet så opp til nærmere 2000
grader. Triumferende (og ikke så lite lettet) kunne han plukke opp de tre
diamantene fra innpakningen igjen.
Macquer lot seg ikke
vippe av pinnen av dette, han antok at det trengtes luft for at diamantene
skulle forsvinne, og de neste to årene slo han seg sammen med Lavoisier og et
par andre i en serie dyre eksperimenter, finansiert av Lavoisier selv, for å
vise at det dreide seg om en forbrenning. Til slutt la de diamantene under en
glassklokke, varmet dem opp med et kjempebrennglass til de brant, samlet
gassene over et kvikksølvspeil, tilsatte kalkvann og fikk et bunnfall av
kalsiumkarbonat som beviste at resultatet var karbondioksyd. Det måtte altså
være karbon i diamanten, og i 1796 veide den engelske kjemikeren Smithson
Tennant like mye diamant og trekull, forbrente dem og viste at de dannet like
mye karbondioksyd, slik at diamanten måtte bestå av rent karbon. I 1799
spanderte den franske aristokraten baron Louis-Bernard Guyton de Morveau, som
hadde unnsluppet revolusjonen og jobbet som kjemiker og advokat, en 907
milligrams diamant og sammen med kollega Louis Clouet laget han stål av
støpejern med den. Stålbiten ligger forhåpentligvis på museum et eller annet sted.
Karbon er tatt fra latin
carbo 'trekull' eldre car-dho, fra indoeuropeisk ker- 'svi, brenne, gløde'.
Samme opprinnelse har gotisk hauri 'kull' som tilsvarer norrønt hyrr 'ild' og
det norske dialektordet hyr 'gnist'. Det har også eksistert en liknende
utvidelse herdh- 'ildsted' i germansk som er overlevert i engelsk hearth.
I Norge ble karbon
inntil 60-tallet kalt kullstoff etter kull, som gjennom norrønt kol og germansk
kula- kommer fra indoeuropeisk g(e)u-lo- 'glødende kull'.
GEOLOGI
Karbon utgjør 0,09 vekts-% av den øvre, faste jordskorpen og ligger på en 12.
plass av de 83 grunnstoffene som har en selvstendig eksistens i naturen. I
sjøvann ligger det oppe på en 10.-plass, med 0,0028 %, vesentlig som karbonat,
og på grunn av karbondioksydinnholdet er det også en av hovedbestanddelene i
atmosfæren, med 0,011 mol-prosent. Bare nitrogen, oksygen og argon utgjør mer
av tørr luft. I universet som helhet utgjør karbon hele 20 masse-% av alt som
ikke er hydrogen og helium, og er nr. 4 også på denne statistikken, det eneste
av de andre som ligger foran er oksygen. Medregnet hydrogen og helium blir
prosenten 0,34. Det kan regnes at alt liv på Jorda inneholder 270 milliarder
tonn karbon. Til sammenlikning inneholder lufta 600 milliarder tonn, havet 27
billioner tonn og jordskorpen 18 billiarder tonn, så det er fortsatt en del å
ta av.
Naturlig karbon består
av de to stabile isotopene 12 og 13, hvorav den første utgjør 98,90 atom-%. Men
den radioaktive C 14 utgjør også en liten del, til tross for den korte halveringstiden
på 5730 år, siden den jevnlig produseres i naturlige kjernereaksjoner og følger
det øvrige karbonet i det omfattende kretsløpet sitt. C 12 dominerer fordi den
er produktet i trippel-alfa-prosessen, som danner grunnlaget for
energiproduksjonen i de fleste av de varmeste og mest hurtigbrennende
stjernene. Trippel-alfa-prosessen består forenklet i at tre alfapartikler (He
4) kolliderer nesten samtidig med C 12 som resultat.
Mer moderate stjerner
som er unge nok til å ha fått med seg tilstrekkelig mye av dette produktet
gjennom råmaterialet de dannes av, for en stor del støv og gasser som er
utstøtt av døde stjerner under stjerneeksplosjoner, bruker C 12 i
"karbon-kjeden", en annen energiproduksjonsprosess hvor det bare er
hydrogen som forbrukes mens C 12 gjendannes i hvert gjennomløp av kjeden.
Reaksjonene i kjeden er som følger:
12C + 1H = 13N
+ energi.
N 13 er radioaktiv og
omdannes til C 13 ved betadesintegrasjon. Dette frigjør også energi.
13C + 1H = 14N
+ energi.
14N + 1H = 15O
+ energi.
O 15 er radioaktiv og
omdannes til N 15 ved betadesintegrasjon.
15N + 1H = 12C
+ 4He + energi.
Alle mellomproduktene
finnes til enhver tid i en viss mengde i stjerner hvor denne prosessen foregår,
og slipper ut hvis stjernene eksploderer eller på annen måte gir fra seg gass
fra tilstrekkelig dype lag. Derfor finnes også C 13 i betydelige mengder i
universet.
Grunnstoffdannelsen i
universet kan også gå videre ved at det i den siste reaksjonen i denne kjeden
dannes O16 i stedet for C 12 + He 4, noe som skjer ofte i litt varmere
stjerner, og denne fortsetter med å oppta protoner, alfapartikler eller andre
smådeler. Karbonkjeden, som er avhengig av karbon for å kunne gå, danner altså
grunnlaget for syntesen av alle de andre tyngre grunnstoffene i universet. Det
er klart at vi har mye å takke karbon for.
Karbon er altså en av
hovedbestanddelene av universet, og i vår Jords opprinnelige atmosfære, som
allerede hadde mistet mye hydrogen og helium, må det ha utgjort over 10
masseprosent - som metan og karbondioksyd, sannsynligvis bare med oksygen foran
seg på skalaen.
I biosfæren, som er
mengden av alt levende som finnes på Jorda, er karbon den viktigste
bestanddelen, om ikke den hyppigste. I en vakker kvinne på 60 kg er det ca. 18
% eller 11 kg karbon. Uansett om hun er vakker eller ikke er det godt å vite en
kald kveld at du har mer enn ti kilo rent kull i senga ved siden av deg! Det er
mest oksygen i henne, hele 65 % eller 39 kg, men hvis du tar bort vannet og
bare regner tørrstoffer blir karbon helt dominerende. Fjerner du skjelettet
også, utgjør karbon over 70 % av det som er igjen. Og hvis hun ikke er vakker,
men derimot svært fet kan faktisk karboninnholdet komme opp i 75 %, fordi fett
er det karbonrikeste av de biologiske materialene.
Også i jordskorpen som
helhet (inkludert biosfæren, lufta og havvannet) ligger karbon høyt oppe med
sin 12.-plass, og av det som regnes som mineraler (faste, naturlig forekommende
substanser med homogen sammensetning) er karbon (1977) en hovedkomponent av så
mange som 201. Av disse er 163 karbonater i forskjellige varianter, 15 er rent
organiske stoffer, 10 er salter av organiske syrer, 5 er forskjellige former av
rent karbon, 4 er karbider, 2 er uorganiske salter utenom karbonater (et cyanid
og et isotiocyanat) mens 1 er et oksyd (blandet silisium-, karbon- og
svoveldioksyd) og 1 er en organometallisk forbindelse, et nikkelporfyrin. Av
grunnstoffer som karbon forekommer sammen med i mineraler er oksygen og
hydrogen de klart vanligste, med h.h.v. 186 og 127 mineraler. Så følger kalsium
med 74, magnesium med 45, natrium med 39, aluminium med 27, jern og svovel med
22, silisium og cerium med 19, fluor, kobber og uran med 16, klor med 14,
kalium og bly med 13, barium med 12, nikkel med 11, nitrogen og lantan med 10,
mangan med 9, sink og yttrium med 8 og strontium med 7. Det kan vel anes en
viss overhyppighet av jordalkalimetaller og sjeldne jordarter her.
Ikke bare skorpen, men
også Jordas indre er rikt på karbon, som altså også resten av universet. Det
meste av det magmaet som kommer opp gjennom vulkanrør enten det baner seg vei
helt opp til overflaten eller blir liggende og størkne langsomt på større eller
mindre dyp, består av silikater, basert på kvarts. Men det er også mye
karbondioksyd inne i Jorda, og en del vulkaner spyr ut karbonatitter, magma som
for det meste består av karbonater. Hovedmineral er for det meste
kalsiumkarbonat, men også magnesium og jern er vanlig og natrium og kalium ikke
sjeldne. Karbonatittene fører dessuten med seg en rekke økonomisk viktige
metaller og mineraler i underordnede, men betydelige mengder, f.eks. jern,
titan, mangan, strontium, kobber, niob, tantal, zirkonium, sjeldne
jordmetaller, thorium, uran, apatitt, flusspatt og vermiculitt. Søvitt er en
karbonatittbergart som først ble funnet ved gården Søve i Fen nær Ulefoss i
Telemark, en av de første oppdagelsene av eruptiv kalkstein, som siden har vist
seg å være ganske vanlig verden over. Finnes her i landet også på Stjernøy ved
Hammerfest og har blitt drevet på niobmineralene koppitt og columbitt i mange
år.
Men karbon forekommer i
naturen ikke bare som homogene mineraler. Karbon er basis for alt liv, og
livets etterlatenskaper og også dets aktiviteter har spilt en markert rolle i
Jordens geologi de siste 3-4 milliarder årene. Livet endret hele
atmosfæresammensetningen da karbondioksydassimilasjonen begynte for drøye 2
milliarder år siden, og skaffet oss den oksyderende atmosfæren vi har idag.
Jernet som var oppløst i havvannet ble oksydert til den uløselige treverdige
formen og feltes ut i tykke, rustrøde lag over hele den daværende havbunnen.
Slike lag er som nevnt viktig jernmalm idag. Også flere andre grunnstoffer ble
oksydert, for eksempel er alle elvesedimenter med uran(IV)oksyd, UO2,
eldre enn 2,3 milliarder år, mens de yngre består av (IV,VI)oksyd, U3O8.
Slike avleiringer er jo lette å datere på grunn av radioaktiviteten.
Livets etterlatenskaper
har også dannet mektige sedimenter, som fikk særlig varig geologisk innflytelse
da organismene begynte å beskytte seg med kalkskall og andre mineralske
konstruksjoner. Det vanligste er kalsiumkarbonat, CaCO3, og
kalkskall av havets smådyr har i årmillionenes løp dannet enorme leier av
kalkstein. Mange steder har havbunn kommet på land av forskjellige grunner, og
kalkfjell f.eks. på det norske Østlandet og i Alpene gir god dyrkningsjord og
gjør skøyteis glattere, men gir også problemer med kalk i drikke- og vaskevann,
såkalt hardt vann som svekker såpeskummet og setter seg i rør og kar og
dusjkabinetter som kjelstein.
Andre etterlatenskaper
etter livet er bl.a. fugleskitten som i Chile har dannet veldige sedimentfjell
med høyt nitratinnhold og har blitt brukt som gjødsel. Men livsformene
etterlater jo seg selv også når de dør, og studiet av fossiler er en egen
vidtfavnende del av geologien. Et fossil betegner opprinnelig noe som er gravd
opp, og ordet ble inntil på 1700-tallet også brukt om mineraler og andre ting
som man fant i jord og stein. Ettersom man kom fram til kjemiske analyser for
de andre tingene ble fossil brukt om de som ikke hadde veldefinert kjemisk
sammensetning, inntil man fant ut at de fleste sådanne stammet fra livsformer.
Kalkstein er svært rike på fossiler, og det er rimelig, for kalkskallene som
organismene har lagt igjen der er jo til for å være harde og bestandige. Men
også andre sedimentære bergarter som skifer og sandstein kan være rikholdige.
Det som kan finnes bevart er oftest harde deler som skall og skjeletter, men
det forekommer også avtrykk av bløte kroppsdeler, hår og fjær, avføring,
fotavtrykk, borehull m.m. Uforandrede bløtdeler finnes sjelden, unntaket er
innefrosne mammuter fra etter istiden og insekter i rav som kan være flere
hundre millioner år gamle. Uforandrede harde deler finnes i store mengder i
kalkfjell og andre steder hvor kalkskallene holder seg. Forandrede bløtdeler
opptrer ikke sjelden som fossiler, f.eks. kan organismer som raskt er blitt
begravet i finkornet sand, leire, kalk- eller kiselslam lage et detaljert
avtrykk som etterlater et hulrom når vevet råtner bort, og hulrommene kan
finnes igjen intakte eller sammentrykte eller fylt med mineraler som gir en
nøyaktig avstøpning av originalen. Forsteinede trær kan dannes ved at kiselslam
gradvis trenger inn i det levende vevet slik at den plassen som treet opptok
blir ganske ren kvarts, som er hard og kompakt, mens omgivelsene, som kanskje
består av sandstein, ofte kan forvitre bort.
Hvis livsformen får
forhold hvor forråtnelsesprosessene ikke virker, f.eks. oksygenfrie, kan de bli
karbonisert. Kulleier inneholder mange fossiler av planter, men graptolitter og
f.eks. fiskefinner fossiliseres også på denne måten. Også harde deler kan
forandres, f.eks. vil surt vann oppløse kalkstein og danne hulrom der det har
vært et skall, og hulrommet kan så bli fylt igjen enten senere eller av
avsetninger fra det samme vannet. Skjell kan begraves enten fylte eller ufylte
og hvis kalkskallet oppløses kan man få fine avstøpninger av innsiden av
skjellet.
På forskjellige måter
kan dyrs og planters bløtdeler unngå forråtnelse slik at de ikke forsvinner
helt, men blir liggende som sedimenter av et eller annet slag. Det skjer
vanligvis ved at de havner i oksygenfattige forhold slik at de organismene som
er ansvarlige for forråtnelsen ikke er til stede. De karbonforbindelsene som
inngår i de døde kroppene blir allikevel ikke bevart intakte. Over de lange
tidsrom som er til rådighet kan det skje forskjellige prosesser. Hvis havbunnen
er åstedet ser det ut til at det som fortrinnsvis skjer ender med at oksygenet
og nitrogenet separeres ut slik at det som blir igjen er karbon og hydrogen i
form av hydrokarboner av forskjellig lengde. Resultatet kalles generelt olje
eller mer spesifikt mineralolje, for å skille den ut fra den som utvinnes av
levende organismer. Mineraloljen er ikke noe rent, homogent stoff, men en
blanding av forskjellige hydrokarboner med rester av de andre biologiske
grunnstoffene som oksygen, nitrogen, svovel og fosfor i forskjellige former,
helst i lavest mulig oksydasjonstrinn. Oksygenet foreligger f.eks. som vann
(oksydasjonstrinn -2), nitrogenet som ammoniakk (-3), svovelet som
hydrogensulfid (-2) og fosforet som fosfin (-3). Det er nærliggende å tenke på
at oljen har blitt dannet under ganske sterkt reduserende forhold.
Hydrokarboner med
forskjellig lengde har forskjellig koke- og smeltepunkt, og gassformige hydrokarboner
er ofte separert ut i form av naturgass. Asfalt, tjære og voks er forholdsvis
faste hydrokarboner som er skilt ut og blir igjen når de flyktigere har dampet
eller rent bort. På mange oljerike steder danner det seg oljesjøer hvor de
flyktige bestanddelene raskt forsvinner mens asfalt eller tjære er igjen. Slike
klebrige sjøer er livsfarlige for mange nysgjerrige dyr, og mange av dem er
breddfulle av skjeletter av de forskjelligste organismer. Ozokeritt, albertitt
og hatchettin er mineralske voksarter som er lysere i fargen enn asfalt og kan
raffineres til hvite parafinaktige vokser som består av langkjedete og
uforgrenede mettede hydrokarboner. De opptrer ofte i sprekker og hulrom i
oljeførende fjell, men gjerne også i forbindelse med kulldannelse.
Kulldannelse skjer raskt
når organisk materiale forbrenner ved utilstrekkelig oksygentilgang. Når du
tenner på en trepinne er det de mest brennbare bestanddelene ytterst mot luften
som tar fyr først mens de andre spaltes av varmen og de flyktige delene unnslipper
i gassform mens det svarte karbonet blir igjen. Trekull fremstilles ved å
skjerme ved mot luft mens det oppvarmes og spaltes på samme måten. I
"vannsyk" jord i myr- og sumpstrøk går mye plantemateriale til
grunne, men den vanlige forråtningsprosessen er oksygenkrevende, og går ikke
langt i det stillestående myrvannet, som raskt blir tappet for oksygen.
Resultatet er en prosess
som ender med forkulling, men begynner med torvdannelse. Det organiske
materialet spaltes. Oksygenet, nitrogenet og hydrogenet slipper unna. Det blir
et reduserende miljø, og de forskjellige grunnstoffene slipper helst unna som
hydrogenforbindelser, også en del karbon unnslipper, som lette hydrokarboner,
mest metan, som er brennbare saker. Forbrenningen av den kan stundom beskues på
kveldstid ved aktivt torvdannende myrer.
Men det meste karbonet
foreligger etterhvert som mer og mer karbonrike hydrokarboner, såkalte
bitumenstoffer, og etterhvert rent kull. Bitumenstoffene er rike på
dobbeltbindinger mellom karbonatomer og er gjerne sterkt preget av alifatiske
ringstrukturer. Myrtorv inneholder typisk 60 % karbon. Dette omdannes i eonenes
løp til brunkull med 70 % og videre til steinkull hvor innholdet er ca. 80 %.
De reneste kullet kalles antrasitt og kan inneholde 95 % karbon. Det svarte
steinkullet og antrasitten trenger lang tid for å lages i naturen og er alltid
millionvis av år gammelt. I den velbenevnte karbontiden, som varte fra 345 til
280 millioner før vår tid, var klimaet fuktig og sumpete over store deler av
kloden, og derfra stammer de rikeste kull-leiene, men kull er kjent fra nesten
alle andre geologiske perioder også.
Siden kullet er en
blanding av forskjellige stoffer som ikke er innbyrdes løst i hverandre, er det
ikke for et mineral å regne, men for en bergart. Antrasitten med 95 % karbon
ligger nært opptil å være et mineral og er nokså krystallinsk i oppbygningen.
Men det finnes også ekte mineraler av rent karbon.
Grafitt, tidligere mye
kalt blyant eller blyantstein, et ord som i enda eldre tid ble brukt om en
antimonholdig blyglans som ble brukt til å skrive med, en forkortelse for
blyantimon, finnes i metamorfe bergarter, slike som har vært utsatt for
omkrystallisering under høyt trykk og/eller temperatur. Under slike forhold
krystalliserer karbonet i kull og andre organiske sedimenter ut som grafitt.
Den er et av de bløteste mineralene, og har hardhet 1 på Mohsskalaen. Tettheten
er 2,23 g/cm3, fargen er gråsvart, og den gir villig av seg sin
velkjente grå strek på alle prøveflater. Krystallstrukturen er heksagonal og i
det indre består den av skikt med sammenhengende aromatiske resonanssekskanter.
Det er ingen kjemiske bindinger mellom skiktene, bare svake v.d.Waalskrefter.
Grafitt er så å si et todimensjonalt mineral. Naturlig grafitt er sjelden
særlig ren og etterlater opptil 20 % aske når den brenner.
Det er ganske mye
grafitt i Norge, særlig i Nordland og Troms hvor grafittskifer er vanlig, men
også mange andre steder. Det produseres grafitt i Skaland Verk på Senja.
Drivverdige forekomster finnes også ved Jennestad i Sortland og Holandsfjord i
Nordland. Mange gneiser i Kongsberg-Bambleområdet fører litt grafitt. Den
fineste grafitten kommer fra Sri Lanka, ellers produseres mye på Madagaskar, i
Tsjekkia, Østerrike, Bayern og Ontario og Quebec i Canada.
Chaoitt er et sjeldent mineral som består av rent
karbon og likner grafitt overfladisk, men består av lange kjeder av
karbonatomer i et heksagonalt mønster. Det dannes i meteoritter og
meteorkratere ved omvandling av grafitt og annet karbonmateriale under høyt
trykk og temperatur.
Diamant er i slående
kontrast med grafitt det hardeste av alle mineraler, med hardhet 10 på skalaen.
Tettheten er 3,5 g/cm3. Det dannes av samme grunnmateriale som
grafitten, men krever ekstremt høye trykk, og finnes bare dypt nede i vulkanrør
med seig, kontinental lava, som resultat av kraftige eksplosjoner. Slike
såkalte kimberlittrør finnes også på den gamle grunnfjellsplaten som Finnmark
ligger på, og man har lett etter diamanter der, men ikke med hell foreløpig.
Diamanter er kubiske, harde, klare og med en sterk lysbrytning som kan gi
frapperende effekter ved sliping. De fluorescerer ved ultrafiolett lys.
Forskjellige forurensninger kan gi andre farger, blå og gule er de vanligste,
men heller ikke grønne er uvanlig. Brune og svarte diamanter inneholder
uomvandlet karbon og regnes for mindreverdige. En svart variant som består av
uregelmessige masser uten synlige krystallflater kalles carbonado. De aller
fleste diamanter er små, matte og nesten blygrå. Slike diamanter uten smykkesteinskvalitet
kalles "bort" og har diverse teknisk anvendelse.
Lonsdaleitt er en
heksagonal form av diamant som er funnet i visse meteoritter og også kan lages
syntetisk.
Natron, Na2CO3.10H2O,
har samme sammensetning som handelsproduktet krystallsoda (mens
handelsproduktet natron består av natriumbikarbonat, NaHCO3). Dette
natronet er den formen man finner soda på i naturen. Det er hvitt eller
fargeløst, krystalliserer monoklint, og siden det er lett vannløselig finner
man det bare i tørre strøk og i saltleier.
Trona, Na2CO3.NaHCO3.2H2O,
er et annet natriumkarbonat med mindre vanninnhold som forekommer under
liknende betingelser som natron, men som er mer stabil i sterk varme. Det er
fargeløst til grått eller gullig hvitt, glinsende og opptrer i fibre eller
masser eller i søyleformede monokline krystaller. Hardhet 2,5-3, tetthet 2,1
g/cm3.
Kalkspatt eller kalsitt,
CaCO3, har de siste 600 millioner årene som følge av havdyrenes
virksomhet blitt et av de mest utbredte mineralene. Den er i ren tilstand
fargeløs eller hvit, noen ganger farget av urenheter. Hardheten er 3, tettheten
2,71 g/cm3. Kjennetegnet ved at den bruser i kald, fortynnet syre.
Krystalliserer trigonalt, gjerne med tvillingkrystaller. "Spikerhode"
og "hundetann" er vanlige formvarianter. Ofte i mer eller mindre
finkornete masser. Kalkspatt er kjent for sin dobbeltbrytning som ble årsak til
oppdagelsen av det polariserte lyset. Legger du en krystall oppå en blyantstrek
ser du to bilder av streken gjennom krystallen. Kalkspat finnes i noen
vulkanske bergarter og i noen omvandlede basalter, men overveiende i
sedimenter. Løses i surt vann og settes ofte av i sprekker i fjellet som vannet
har rent igjennom eller i dryppsteinshuler, en prosess som akselereres med den
surere nedbøren i våre tider.
Kalkstein er en bergart som i det vesentlige
består av kalkspatt. Den er utbredt over store deler av verden, dominerer mange
steder i dette landet og avleverer ioner til vannet som gjør det hardt. Rundt
varme kilder avsettes ofte mye kalkstein i mange former, bl.a. som travertin,
som har vært brukt som bygningsstein. Kritt er en særskilt kalkstein ble dannet
etter masseutryddelsen av plankton samtidig med dinosaurene for 65 millioner år
siden. De sank i hopetall ned på bunnen og dannet krittavleiringer som ga
perioden sitt navn og deg noe å skjelve på hånden med når du går til tavla.
Kalkstein som er utsatt for høyere temperatur eller trykk omkrystalliseres til
marmor, som er mye brukt til bygningsstein, men lider under de moderne
nedbørsforhold. Også dolomitt kan danne marmor, mange marmorer inneholder en
blanding av kalkspatt- og dolomittkrystaller. Marmor er ofte hvit, med årer av
mørkere materiale, men også rød, grønn, grå og svart marmor er høyt verdsatt.
Marmor fra Paros i Egeerhavet rangeres spesielt høyt p.g.a. sin
gjennomskinnelighet, selv i 3,5 cm tykke lag skinner lys igjennom. Men også en
del av den norske nordlands-marmoren har samme kvalitet. Det største feltet er
på Fauskeeidet i Salta, hvor mye marmor har blitt drevet. Også i Nordtrøndelag
finnes flere betydelige forekomster. Marmoren på Gjellebekk i Lier ved Drammen
ble brutt på 1700-tallet og forefinnes i Marmorkirken i København, men er av
dårlig kvalitet. Kleberstein er en annen bergart som ofte kan inneholde
kalkspatt eller andre kalsium- og magnesiumkarbonater.
Aragonitt har samme
sammensetning som kalkspatt, men krystallisesrer rombisk, ofte som
pseudoheksagonale tvillingkrystaller. Hardhet 3,5, tetthet 2,94 g/cm3.
Den er hvit til glassklar i fargen og fluorescerer i elektron- og
røntgenstråler og i ultrafiolett lys. Viser også termoluminiscens, d.v.s. at
den avgir lysfenomener ved oppvarming. Forekommer i leier sammen med gips, men
også avleiret i sprekker og hulrom i basalter og som stalaktitter i dryppsteinshuler.
Små aragonittkrystaller finnes i perler, mange sjødyr feller ut aragonitt i
skallet i stedet for kalkspatt, og det avleires derfor mye aragonitt i
sedimenter, men det går med tiden over til den mer stabile kalkspatten.
Aragonitt felles fra varme kilder i stedet for kalkspatt, og finnes i
avleiringer rundt kildene. Den finnes en rekke steder i Norge, bl.a.
Elsjøområdet mellom Grubelien og Dalstjern i Oslofeltet hvor det er fylt i
sprekker i bergarten hornfels, og i Konnerudgruvene ved Drammen, hvor den
forekommer som pene, små strålebunter.
Dolomitt er et
magnesium-kalsium-karbonat (Ca,Mg)CO3, som forekommer i fargeløse
til hvite, trigonale krystaller, ofte i rombeform, gjerne med tvillingdannelse,
eller i kornete eller tilsynelatende strukturløse masser. Urenheter gjør fargen
ofte grå, grønnlig, gul, rosa eller brun. Hardhet 3,5-4, tetthet 2,85 g/cm3,
matt glassglans. Bruser ikke med kald, fortynnet syre slik som kalkspatten, men
gjør det når syren blir oppvarmet. Fluorescerer i ultrafiolett lys. Viser også
triboluminescens, d.v.s. lysvirkninger ved gnidning. Vanlig i lett omvandlede
kalksedimenter, bl.a. i store mengder i fjellmassivet Dolomittene i de
sveitsiske alper, hvor de sannsynligvis er ansvarlig for det ioneinnholdet som
gir Davos-isen den berømte glien. I Norge i store mengder i den nordlandske
dolomittmarmoren i Salten og Rena. Det er utstrakte felter av tett, hvit
dolomitt i Porsanger. Dolomitt kan inneholde jern og danner overgangsfaser til
ankeritt, ofte assosiert til malmmineraler.
Magnesitt, talkspatt
eller bitterspatt, MgCO3, er et hvitt eller fargeløst, trigonalt
mineral med hardhet 4 og tetthet 3,0 g/cm3. Det kan opptre i store,
velutviklede krystaller, men ofte i jordaktige, kompakte, fibrøse eller kornete
masser. Fargen kan ha et gult til brunt skjær av urenheter. Forekommer i ren
form i uregelmessige årer i bergarten serpentin, som ellers består mye av talk.
Inngår ellers i fast løsning i andre karbonatmineraler som kalkspatt, sideritt
og rodokrositt. Bruser ikke for kald syre. Opptrer flere steder på østlandet i
sedimenter fra sen prekambrium som årer og ganger i kleberstein og serpentin.
En kornete hvit variant med varierende mengder gressgrønn serpentin har vært
drevet i Snarum-Modumområdet.
Strontianitt, SrCO3,
et fargeløst, grått, gulaktig eller grønnlig, rombisk krystalliserende mineral
med hardhet 3,5 og tetthet 3,7-3,8 g/cm3, som opptrer i mineralårer
i store, fine, ofte avlange prismer, gjerne med tvillingkrystaller, eller i
fibrøse eller kornete masser eller klumper i kalksteiner. Både fluorescerende
og fosforescerende i elektron- og røntgenstråler og i ultrafiolett lys. Kan
også vise termoluminescens. Viktig strontiummalm. Ikke funnet i Norge.
Witheritt, BaCO3,
er et fargeløst, hvitt eller gullig til grålig mineral med hardhet 3,5 og
tetthet 4,3 g/cm3. Det opptrer i rombiske, pseudoheksagonale
tvillingkrystaller eller i blærete, kornete masser på mineralårer sammen med
barytt og blyglans. Fluorescerende og fosforescerende i elektron- og
røntgenstråler og ultrafiolett lys. Viser også termoluminescens. Viktig malm
for barium.
Ankeritt,
Ca(Fe,Mg,Mn)(CO3)2, er trigonalt og gult til brunt i
fargen, hardhet 3-4, glass- til perleglans, ofte gjennomskinnelig, har hvit
strek og tetthet 3,0 g/cm3. Krystalleriserer i avrundede romboedre,
men forekommer ofte i kompakte eller kornete masser. Finnes bl.a. i
ankerittbåndet jernmalm i Håfjellsmulden i Nordland, Bleker gullgruve i
Telemark og som bergartsdannende mineral i raudhaugitt i Fen, Telemark.
Sideritt eller
jernspatt, FeCO3, er et brunt til gulbrunt eller gråbrunt, trigonalt
mineral med hardhet 4 og tetthet 3,8-4 g/cm3. Den gir hvit strek på
prøveflater og opptrer som rombeliknende krystaller, korn, blærer eller masser
i jernholdige sedimenter, som mineralkorn i leire eller i årer etter vulkanske
gasser hvor man ofte finner pene krystaller. Inneholder gjerne andre trigonale
karbonatmineraler i fast løsning og inngår også selv i slike løsninger. Viktig
jernmalm, men sjelden i Norge. Funnet i Brevik-Bambletraktene i Telemark.
Rodokrositt eller
manganspatt, MnCO3, er et rosa til rødt eller brungult, trigonalt
mineral med hardhet 4 og tetthet 3,7 g/cm3 som avgir en hvit strek
på prøveflater. Forekommer vanligvis i blæreformede masser og skorper på
manganførende årer, ofte med viktige sølv- og blymineraler. Også i metamorfe
soner. Inneholder gjerne andre trigonale karbonatmineraler i fast løsning og
inngår også selv i slike løsninger. Sjeldent i Norge, men funnet i Botnedal i
Telemark.
Malakitt, Cu2(CO3)(OH)2,
er et klart grønt til svartaktig, monoklint mineral med hardhet 3,5-4 og
tetthet 4-4,1 g/cm3. Det forekommer mest på oksyderte soner av
kobbermineraler og opptrer vanligst som blærer med et båndete tverrsnitt, men
kan også danne fiberaktige aggregater eller kvaster eller rosetter av
nålformede krystaller. Forekommer noen ganger som en sammenkittende masse i
sandsteiner. Har ofte en vakker glans og fin farge og er brukt i smykker og
andre pyntegjenstander, men også som kobbermalm, og dessuten i finmalt form som
malerfarge under betegnelsen berggrønt. (Malakittgrønt er noe helt annet, et
organisk fargestoff.) I Ural er det særlig mye malakitt. Finnes på mange norske
kobberforekomster, spesielt Kongsberg og Konnerudkollen ved Drammen.
Azuritt eller
kobberlasur, Cu3(CO3)2(OH)2, er
vanlig som forvitringsmineral på kobberforekomster, enten som dypblå monokline
krystaller, nyreformede masser eller fibrige aggragater. Ofte sammen med
malakitt. Hardheten er 4, tetthet 3,8 g/cm3. Glass- til
diamantglans, lyseblå strek, et godt kløveplan og muslig brudd. På
kobberforekomster mange steder i Norge, f.eks. Årdal i Sogn, Skutterud på
Modum, Bandaksli i Telemark.
Sinkspatt, smithsonitt,
galmei eller kalamin, ZnCO3, er åpenbart et kjært barn og en viktig
sinkmalm siden oldtiden. Den er hvit, grønnlig, brunlig eller grå i fargen,
krystalliserer trigonalt og har hardhet 4 og tetthet 4,4 g/cm3.
Opptrer i blærer, skorper og ofte løse masser i oksyderte soner av sinkmalmer,
men løses litt i vann og kan også forekomme i stalaktitter i dryppsteinshuler.
Ikke kjent i Norge.
Bastnäsitt, (Ce,La)CO3(F,OH),
et heksagonalt, gult til rødligbrunt mineral med glass- til fettaktig glans.
Forekommer i tavleformede krystaller eller i amorfe masser. Ingen spalteflater,
ujevnt brudd. Hardhet 4-4,5, tetthet 4,9-5,2 g/cm3. Finnes i
varianter med overvekt av La og overvekt av Y. Ikke sjelden i Norge i
dypbergarter i Oslofeltet, granittpegmatitter på Sørlandet og Tysfjord i
Nordland.
Lantanitt, (La,Ce)2(CO3)3.8H2O,
er heksagonalt, hvitt til fargeløst eller svakte rosa- eller gulfarget og
krystalliserer i flak eller plater. Hardhet 2,5-3, tetthet 2,74 g/cm3.
Kjent i Norge fra Hobøl i Østfold og Holmestrand.
Kainositt, Ca2(Ce,Y)2Si4O12(CO3).H2O,
er et rombisk, gulbrunt, gjennomsiktig eller gjennomskinnelig mineral med
glassglans og hardhet 5-6 og tetthet 3,4-3,6 g/cm3. Beskrevet første
gang fra Hidra ved sørlandskysten og også kjent fra Kragerø, Krøderen og
Tysfjord. Parisitt, (Ce,La)2Ca(CO3)3F2,
er sjeldent mineral med ravaktig til matt glans som kan være hvitt, beige, rosa
eller gulbrunt til honninggult, krystalliserer i gjennomsiktige, heksagonale
krystaller og har hardhet 4-4,5, tetthet 4,3 g/cm3 og avsetter en
blek, gulhvit strek. Store krystaller finnes i Hundholm-pegmatitten i Tysfjord,
Nordland. Også kjent fra Kragerø, Sulitjelma og Kongsberg.
Cerussitt eller hvitblyerts er PbCO3,
krystalliserer rombisk, gjerne i tvillingkrystaller, ofte kornete eller i
masser. Hvit til grå i fargen, med diamantglans, ofte med andre farger etter
urenheter. Fluorescerer i røntgenstråler og langbølget ultrafiolett lys. To
distinkte kløvflater, muslig brudd, sprø. Hardhet 3, tetthet 6,55 g/cm3.
Forekommer i oksyderte soner av blymalmer, kan være drivverdig på bly. I Norge
sjelden, men sett på kontaktsoner i Oslofeltet.
Det tetragonale
vismutspatt eller bismutitt, (BiO)2CO3, er et variabelt
korngult til brungult forvitringsprodukt av vismutglans. Det krystalliserer
tetragonalt, med glassglans, men forekommer mest som jordaktige masser og
skorper på vismutglansen. Hardhet 2,5-3,5, tetthet 6,7-7,4 g/cm3.
Kjent i Norge fra Gjuv vismutgruve i Hjartdal i Telemark. Også funnet på
Gjellenbekk og på pegmatittganger i Iveland.
Skapolitt er en
mineralgruppe av variabel sammensetning som består av en blanding av meionitt,
3CaAl2Si2O8.CaCO3, og marialitt
3NaAlSi3O8.NaCl i forskjellige forhold i innbyrdes fast
løsning i hverandre. Kjemisk er den meget nært beslektet med plagioklasfeltspat
og likner den i hardhet og farge, men krystalliserer tetragonalt, ofte i lange,
stavformede firkantprismer. Temmelig vanlig, utbredt i kontaktsonene i
Oslofeltet og i kalkstein på sørlandet.
Dahllitt, Ca5(PO4,CO3)3(OH),
er en karbonatholdig apatitt som også kan inneholde mer eller mindre fluor.
Krystalliserer heksagonalt. Først oppdaget ved Ødegårdens apatittforekomster i
Bamble i Telemark, oppkalt etter Tellef Dahll, geolog og bergmann som var født
i Kragerø og var var en av Norges Geologiske Undersøkelses første bestyrere fra
1858.
Mellitt eller
honningstein, C6(COO)6Al2.18H2O, er
et gult, tetragonalt mineral av en interessant sammensetning. Den består av det
hydratiserte aluminiumsaltet av benzenheksakarboksylsyre (eller mellittsyre),
en organisk syre som består av en benzenring med en syregruppe tilknyttet hver
av ringkarbonene. Som navnet antyder, smaker det søtt av den. Forekommer som
knoller i brunkull, dannet ved nedbryting av planterester. Hardhet 2-2,5,
tetthet 1,55-1,65 g/cm3, glassglans, honninggult til gyllenbrun,
hvit strek.
KJEMI
Av rent karbon er det idag kjent en rekke forskjellige modifikasjoner. Fra
gammelt av kjennes amorft karbon, diamant og grafitt. Det amorfe er det svarte,
subkrystallinske som fås temmelig rent i sot og trekull. Det har en tetthet på
1,8-2,1 g/cm3 og er egentlig det samme som grafitt og slett ikke
amorft, men har mikroskopiske krystaller.
Grafitten er grå og
bløt, med en tetthet på 1,9-2,3 g/cm3. Som nevnt har den en lagvis
struktur hvor karbonatomene er ordnet i hvert skikt i et benzenringliknende
sekskantmønster. Bindingene i slike ringer er resonansforsterkede (mer om dette
under benzen) og svært vanskelige å bryte. Avstanden mellom atomene er 1,42 Å.
Men mellom skiktene er avstanden hele 3,35 Å, og i denne retningen virker det
faktisk ingen krefter! Ingen kovalente, sterke bindinger, slik som disse
resonansbindingene. Ingen varig elektrostatisk tiltrekning som mellom ioner
eller svakere mellom polare molekyler (hydrogenbindinger). Bare svake van der
Waalskrefter lik de som virker mellom neonatomer og prøver å holde dem sammen i
krystaller i nærheten av det absolutte nullpunkt, men gir opp allerede ved -248
°C. Derfor skrelles lagene av lett og avsetter seg på kladdepapiret ditt bare
med et lett trykk av hånden. Det er idag kjent at grafitt opptrer i to
krystallmodifikasjoner, en alfa-grafitt som er den kjente heksagonale, og en
trigonal betaform. Krystallformen er den eneste egenskapen som skiller dem fra
hverandre, men alfa-grafitt kan omvandles til beta ved mekanisk behandling og
går tilbake ved oppvarming til 1000 °C. Beta-grafitt kan utgjøre opptil 30 % av
naturlig grafitt, men vanlig kommersiell grafittsyntese gir bare alfa-grafitt.
Grafitt fremstilles
kunstig på forskjellige måter og kan få vidt forskjellige egenskaper etter
fremstillingsmåten. Pyrolyttisk grafitt fås ved varmespalting av lette
hydrokarboner som metan, etan og benzen på en grafittoverflate under lavt trykk
ved 2000 °C. Den er nokså lik den naturlige grafitten. Det er også den som fås
ved å oppvarme koks eller antrasitt i form av 'bakte' elektroder ved 2700 °C.
Retortegrafitt (retortekull) utskilles ved fremstilling av koks og lysgass fra
kull ved at gassene som skilles ut delvis spaltes ved de varme retorteveggene.
Den dannes i tette, faste masser og er meget hard, med god elektrisk
ledningsevne. Glanskarbon fås når en lysgass- eller metanflamme brenner mot en
glatt overflate, f.eks. glassert porselen eller metall oppvarmet til 800 °C.
Den er metallglinsende, meget sprø og ureaktiv og nesten like hard som diamant.
Men i det indre består den av sammenfiltrede grafittkrystaller med diametre på
20 Å eller mindre. Fibergrafitt eller karbonfiber fremstilles ved forkulling av
akrylfiber. De har en usedvanlig styrke og fasthet og er idag tatt i bruk i
utstrakt grad.
Sot fås ved ufullstendig
forbrenning av karbonholdige damper eller gasser. Det er bare lysende flammer
som soter. Lyset kommer fra glødende partikler i de delene av flammen som ikke
har nok oksygentilførsel til at forbrenningen kan gå fullstendig. Når det er
karbonholdige materialer som forbrennes består de glødende partiklene for det
meste av karbon, og avsetter seg som sot på en kald overflate hvis den føres
inn i de lysende delene av flammen. En flamme som ikke soter eller soter lite
kan bringes til å sote mer hvis lufttilførselen (d.v.s. trekken) minskes - og
omvendt. Sotavsetninger i ovner og skorsteiner reduseres ved bedre trekk. Det
karbonet som ikke avsettes som sot vil i stedet forbrenne og gir varme. Men
hvis det er for mye trekk forsvinner mye av varmen ut av skorsteinen.
Parafinlamper oser mindre og gir mer lys pr. mengde forbrukt brennstoff hvis
trekken bedres med et lampeglass som dirigerer luft forbi den brennende veken.
Sot er ikke helt rent
grafitt og inneholder litt hydrogen, oksygen og ofte svovel. Derfor kan den
variere mye i egenskaper etter fremstillingsmåten. Kjønrøk er en slags sot som
fremstilles ved forkulling av harpiksrike trær. Sot fremstilt med utgangspunkt
i forskjellige brennstoffer gis ofte navn etter brennstoffet, f.eks.
antracensot eller acetylensot. Sot er en av de mest finfordelte substansene vi
kjenner som ikke er gasser.
Koks fås etter
forkoksing, tørrdestillasjon, d.v.s. oppheting av kull, torv eller faste
destillasjonsrester etter jordolje eller kulltjære til opptil 1000 °C uten
lufttilgang. Koks som er fremstilt ved denne temperaturen er hardt, ganske
tungt og matt gråsvart av farge. Det består for det meste av grafitt, men har
et betydelig innhold av askestoffer, d.v.s. mineraler som blir igjen etter
forbrenningen.
Ved oppvarming av
karbonholdige materialer uten lufttilgang inntrer forkulling, som kan gi ganske
rent karbon i en mikrokrystallinsk grafittform som resultat. Vanlige
utgangsmaterialer er tre (trekull), torv, kull, koks, dyreekskrementer, sukker
(sukkerkull), kokosnøtteskall, fruktsteiner m.m. Beinkull lages av bein, men inneholder
ganske mye apatitt (kalsiumfosfat). Alle disse materialene er dannet etter
frigjøring av gassformige produkter og er porøse, med en stor indre overflate.
Som regel er de lette nok til å flyte på vann.
Hvis forkullingen skjer ved forholdsvis svak oppvarming
og i nærvær av stoffer som tiltrekker seg de dannede tjæreproduktene og hindrer
kullpartiklene å sintre sammen blir kullet uhyre porøst og kan absorbere store
mengder av forskjellige slags stoffer. Absorpsjonsevnen økes ytterligere ved å
varme kullet opp i vanndamp eller karbondioksyd slik at grafitten oksyderes.
Denne oksydasjonen kalles aktivisering og det behandlede kullet aktivt kull, et
stoff som brukes som absorpsjonsmiddel til en mengde forskjellige formål.
Diamanten har ikke som
grafitten kjemiske bindingskrefter bare i et todimensjonelt plan, men i et
nettverk i tre dimensjoner. I dens glitrende indre er karbonatomene knyttet til
fire andre atomer med fire kovalente enkeltbindinger, alle med 136 graders
vinkel med hverandre slik at de står ut i en regelmessig tetraederform fra
atomene. Det kubiske nettverket av slike bindinger går tvers igjennom
diamanten, den holdes sammen av kovalente krefter i alle retninger og har ikke
svakheter i noen plan, akser eller punkter. En diamant er egentlig et
kjempemolekyl, og med sin hardhet illustrerer den godt styrken i de kovalente
bindingene. Karbon er elementenes Supermann, den sterke, harde og vakre, som i
ledige stunder kan slappe av og ikle seg sin hemmelige identitet, grafitten,
bløt, grå og uanselig. Men det er grafitten som er den stabile modifikasjonen
ved normalt trykk og temperatur. Diamanten holder seg bare tilsynelatende
uforandret fordi omvandlingshastigheten er svært lav. De sterke kovalente
bindingene må brytes og knyttes sammen på andre måter igjen for at
forvandlingen skal finne sted, og det er vanskelig ved lave temperaturer selv
om det medfører energigevinst. Men ved 1500 °C i fravær av luft går
forvandlingen raskt. Diamant er også kjent for sin høye brytningsindeks på
2,4173, som skyldes interaksjon mellom lyskvantene og den høye tetthetene av
elektroner i de kovalente bindingene. Bare en håndfull andre stoffer har høyere
brytningsindeks. Den er også en elektrisk isolator i motsetning til grafitten,
som leder elektrisk strøm ganske bra, men den har god varmeledningsevne.
Diamant er den mest kompakte av karbonmodifikasjonene, med en tetthet på
3,15-3,53 g/cm3 (smykkesteinskvaliteter 3,514).
I 1969 ble det
"hvite" karbonet oppdaget ved sublimering over 2300 °C av grafitt
produsert ved termisk spalting av karbonforbindelser. Det dannes små, klare
krystaller som tilsynelatende også har en skiktstruktur som grafitt, men
tettere.
Lonsdaleitt er en
heksagonal krystallform av diamant med egenskaper som likner diamantens (den er
kanskje enda hardere) og forekommer som mineral i meteorer. Den kan også
fremstilles syntetisk.
Karbyn, også kalt karbon
III, er en grafittliknende form som også dannes ved støtomvandling av
karbonmateriale under meteorittnedslag (mineralnavn chaoitt). Karbynet består av
lange kjeder av karbonatomer som er bundet til hverandre med avvekslende
enkelt- og trippelbindinger. Kjedene er buntet sammen i sekskantmønster og gir
modifikasjonen en heksagonal symmetri. Tettheten er 3,43 g/cm3,
altså tett oppunder diamantens. Det er mulig at slike kjeder også kan være
ganske utbredt i det interstellare støvet.
Ved hurtig kompresjon av
diamant kan det dannes metallisk karbon som er metastabilt over et trykk på 3
TPa, d.v.s. 10 millioner atmosfærer.
Fullerener er
karbonmodifikasjoner hvor karbonatomene er bundet sammen i molekyler på rundt
60 atomer eller mer av form som en ball eller et rør eller liknende. De er
uhyre stabile og motstandsdyktige. Bindingene i dem er av samme type som mellom
sekskantene i grafitt og i tetraedermønsteret i diamant. En annen interessant
egenskap er at de kan inneslutte forskjellige andre atomer med egenskaper som
kanskje kan utnyttes på forskjellige måter.
Karbon er et nokså lite
reaktivt grunnstoff. Diamant motstår med iherdighet alle kjemiske påvirkninger
og er uløselig i alle løsningsmidler, men brenner i luft over 7-800 °C.
Grafitten løses ikke i noen vanlige løsningsmidler, men har en betydelig
løselighet i mange smeltede metaller, f.eks. jern. Med metallene og med bor og
silisium reagerer den ved oppvarming til karbider. Med nitrogen trengs det
svært høy temperatur for å få reaksjon, liksom med hydrogen. Grafitt begynner å
oksyderes i luft ved 450 °C, men brenner ikke før ved 7-800 °C, unntatt i
finfordelt tilstand. Luft som inneholder kullstøv er eksplosjonsfarlig hvis den
utsettes for en flamme med temperatur på 4-500 °C eller mer. Karbon har en
sterk affinitet til oksygen og er et utmerket reduksjonsmiddel som brukes og
har vært brukt metallurgisk i uminnelige tider. Grafitt kan også redusere vanndamp
til hydrogen ved 800 °C. Karbon reagerer ellers med svovel ved rødglød, med
fluor ved romtemperatur og med de andre halogenidene ved moderat oppvarming.
Karbon har fire
valenselektroner og det er fireverdig i nesten alle forbindelsene sine, siden
det både mangler fire elektroner på å få konfigurasjonen til den neste
edelgassen, neon, og har fire for mye til å få den til den forrige, helium. Som
det eneste grunnstoffet i karbongruppen danner karbon anioner med noen få,
sterkt elektropositive metaller i form av "metanid"-ionet C4-
og også acetylidionet C22-, som imidlertid har en
kovalent trippelbinding mellom de to karbonatomene. Formelt har også karbonet
oksydasjonstrinnet -4 i metan, CH4, men i karbondioksyd, CO2,
karbontetraklorid, CCl4, og andre tilsvarende chalkogenider og
halogenider er oksydasjonstallet +4, mens det er +2 i den viktige forbindelsen
karbonmonoksyd og noen få andre. Men selv i fluoridet foreligger det aldri noe
C4+-ion, verken i noen form for elektrolytt eller i krystaller.
Bindingene er alltid kovalente, om enn i varierende grad polare.
Det er også evnen til å
danne kovalente bindinger som i særlig grad setter sitt preg på karbonkjemien.
Elektroner sirkulerer ikke rundt atomkjernene i sirlige runde planetbaner slik
som de første atomstrukturteoretikerne tenkte seg, men beveger seg i orbitaler.
For ting som er så små som elektronene er begreper som posisjon og forflytning
litt mer diffuse enn i vår makro-verden, og orbitalene sier noe om hvor det er
mest sannsynlig å finne elektronene til enhver tid, nøyaktigere er det ikke
mulig å plassere dem. For orbitalene gjelder det ganske bestemte regler for
hvordan elektronene kan gruppere seg, og særlig viktig er det at det i hver
orbital bare er plass til høyst to elektroner. Orbitalene har også forskjellige
nivåer av potensiell energi, p.g.a. at elektronene i de forskjellige har
forskjellig gjennomsnittsavstand fra den tiltrekkende kjernen, og elektronene
velger naturlig nok den orbitalen som har lavest energi og minst gjennomsnittsavstand
hvis de har fritt valg.
Karbon har seks
elektroner, og to av dem befinner seg i orbitalen med det klart laveste
energinivået, som kalles 1s. S-orbitalene er symmetriske om kjernen, tettest
mot midten og avtar gradvis utover. Når det kommer flere elektroner til må de
over i et nytt "skall", hvor gjennomsnittsavstanden er større, siden
det ikke er plass til flere orbitaler i skall nr. 1. To elektroner får plass i
2s-orbitalen, som har samme fasong som 1s, men altså større. De to siste må
nøye seg med en annen type orbital, som heter 2p og ligger litt over 2s i
energi. 2p-orbitalene har høyest elektrontetthet i to kuler på hver side av
kjernen, og det er tre av dem, symmetrisk beliggende rundt hver sin av de tre
aksene i et tredimensjonalt aksesystem, i rett vinkel mot hverandre, slik at de
ialt har plass til 6 elektroner.
Ionebindinger oppstår
når et atom med stor elektrontiltrekningsevne overtar et elektron fra et med
nokså lav sådan evne, slik at det dannes ioner som tiltrekker hverandre elektrostatisk.
Ionebindinger kan lett brytes av en elektrolytt som f.eks. vann - polare
molekyler som legger seg med den negative enden mot det positive ionet og med
den positive mot det negative ionet. Kovalente bindinger oppstår mellom atomer
hvor forskjellen i elektrontiltrekningsevne ikke er så stor og består i at de
deler ett eller flere elekronpar seg imellom, inntil de har skaffet seg den
edelgasskonfigurasjonen alle atomer lengter etter, d.v.s. en konfigurasjon hvor
alle orbitalene i det ytterste elektronskallet er fylt med elektroner. Ved en
kovalent binding slås to orbitaler som hver inneholder et elektron sammen i en
molekylær overlapp-orbital som i likhet med andre orbitaler bare kan inneholde
to elektroner. Der kan begge elektronene bevege seg fritt rundt de to kjernene
så lenge de strengt overholder kjørereglene. I motsetning til ionebindinger som
bare holdes sammen av tiltrekningskrefter mellom to separate enheter innebærer
kovalente bindinger en sammenknytning av to atomer til et molekyl. Derfor er de
også mye sterkere og vanskelige å bryte, og de har alltid en bestemt retning og
en veldefinert geometri.
Både s- og p-orbitaler kan danne kovalente
bindinger. For s-orbitalene ser de felles molekylærorbitalene ut som en slags
ellipseform med en symmetriakse gjennom de to kjernene. Dette kalles en
sigma-binding og symmetrien gjør at et molekyl som inneholder sigmabindinger
kan dreie seg nokså fritt rundt disse bindingene. P-molekylærorbitalene, som
kalles pi-bindinger, ser ut noenlunde som to bananer på hver sin side av aksen
mellom de to kjernene. Disse bindingene er symmetriske bare om et plan gjennom
de to kjernene, og her gis det ingen frihet til å rotere.
Når karbon skal danne
kovalente bindinger blir ikke elektronene liggende med to i 2s-orbitalen og ett
hver i to av de tre 2p-orbitalene, slik som i frie karbonatomer. For det første
må de fordeles med ett i hver av de fire orbitalene slik at det kan slippes til
fremmede atomer, og for det andre kan det frigjøres energi ved å heve energien
til s-elektronet litt og minke den til de tre p-elektronene ved å lage
hybrid-orbitaler, fire likeverdige orbitaler som er en mellomting mellom de to
orbitaltypene og kalles sp3, siden de består av 1 s- og 3
p-orbitaler. Disse hybridene ser ut som en stor og en liten blære som står ut
på hver sin side av atomkjernen. De er ikke symmetriske om kjernen som
s-orbitalen og heller ikke er de to blærene speilbilder av hverandre som
p-orbitalene. Men de er fortsatt aksesymmetriske og kan dermed danne
sigma-bindinger med atomer som har elektronene sine i s-orbitaler, f.eks.
hydrogen. De fire hybridorbitalene stiller seg rundt karbonatomet i posisjoner
som gir hver av dem størst mulig avstand til hverandre, naturlig nok, siden
elektroner med lik ladning frastøter hverandre. Dermed strekker de fire
sigma-bindingene seg ut mot hver av hjørnene i et regelmessig tetraeder, en
figur som er sammensatt av fire likesidede trekanter. Vinkelen mellom hvilke
som helst par av dem er ideelt sett 136 grader.
Men noen ganger deler
karbonatomet mer enn ett elektronpar med et annet atom, slik at det oppstår en
dobbeltbinding. Det går ganske dårlig å legge to aksesymmetriske sigmabindinger
ved siden av hverandre, men problemet løses ved å frigjøre en av p-orbitalene
fra hybridiseringen slik at den kan danne en pi-binding med det andre atomet.
De tre andre orbitalene danner en ny hybrid av en s- og 2 p-orbitaler som
kalles sp2-hybrid. De har omtrent samme fasong som sp3-hybridene
og plasserer seg som dem med størst mulig avstand til hverandre, d.v.s. med
retning mot hvert av hjørnene i en likesidet trekant, alle med 120 graders
vinkel med hverandre og alle i samme todimensjonale plan, ikke fordelt i det
tredimensjonale rommet slik som sp3-orbitalene. En dobbeltbinding
består av en sigma- og en pi-binding.
Og noen ganger deler
selvsagt også karbonet tre elektronpar med naboatomet slik at det oppstår en
trippelbinding. Her frigjøres en p-orbital til, og en trippelbinding består av
to pi-bindinger og en sigma-binding som er en hybrid av en s og en p-orbital og
går under navnet sp. De to sp-hybridene fjerner seg selvsagt også mest mulig
fra hverandre og står ut i hver sin motsatte retning med 180 graders vinkel med
hverandre. Bindingene rundt et slikt karbonatom har altså oppgitt nok en
dimensjon, og står hver vei i samme endimensjonale linje. De to pi-bindingene
består hver av to bananer i hvert sitt plan parallelt med aksen gjennom
atomkjernene. Planene står vinkelrett på hverandre, igjen for å få størst mulig
innbyrdes avstand. Det er ikke plass til flere enn to pi-bindinger mellom to
atomer, og noen kovalent kvadruppelbinding er derfor ikke mulig.
Sp-hybridisering fås også når karbonatomet danner to dobbeltbindinger med to av
naboatomene. Da må også to p-orbitaler frigjøres for å lage pi-bindinger, en i
hver retning, og slike molekyler, som f.eks. karbondioksyd, er rettlinjet.
Karbonatomet bidrar til bindingene med en p-orbital og en sp-hybridorbital i
hver retning.
Karbonets kovalente
bindinger med andre karbonatomer er særlig sterke, noe som er bakgrunnen til
diamantenes hardhet og karbonets evne til å danne molekyler med lange, stabile
kjeder av karbonatomer. Bindingene med andre atomer er for det meste svakere,
og danner ofte angrepspunkter ved kjemiske reaksjoner. Bindinger med andre
atomer som er mer elektrontiltrekkende enn karbon blir polare fordi elektronene
tilbringer mer tid hos det tiltrekkende atomet enn hos karbonet som de ikke
liker så godt. Molekylet får dermed en negativ og en positiv ende, og
tiltrekning og frastøting mellom slike polare molekyl-ender har stor betydning
i kjemien, ikke minst fordi polare molekyler som har andre polare molekyler å
tiltrekkes av virker frastøtende på de upolare, noe som f.eks. innebærer at
noen væsker ikke blander seg med hverandre og at det går an å vaske seg med
såpe.
I vannløsning opptrer
karbon som karbonat- (CO32-) og bikarbonation (HCO3-),
eller tilsvarende andre komplekse ioner som f.eks. tiokarbonationet, CS32-,
cyanid, CN-, og en mengde organiske polare og ioniske forbindelser.
Mange organiske stoffer er også mye undersøkt og brukt som løsningsmidler, og
de upolare stoffene løser gjerne lett de upolare organiske forbindelsene.
Karboniumioner er
organiske molekyler som har fått tilført hydrogen, f.eks. metonium, CH5+,
mens karbeniumioner er organiske molekyler som har mistet hydrogen, f.eks.
metenium, CH3+. Men karbeniumioner kan også oppstå når
umettede organiske forbindelser opptar hydrogen f.eks. fra sterke syrer, f.eks.
CH2:CH2 + H+ = CH2:CH3+.
Karbanioner er negativt ladde molekyler, f.eks. CH2:CH-.
Alle variantene erm er eller mindre ustabile, ofte svært ustablie, og danner
meget få isolerbare forbindelser, men spiller viktige roller som mellomstadier
ved mange organiske reaksjoner.
En særegen ionisk
forbindelse er et salt av sammensetning [C48H51]+[C61H39]-,
som dannes som grønnsvarte krystaller når en løsning av et forgrenet
karboniumion basert på syklopropan blandes med en løsning av et stort karbanion.
Grafitt kan danne
diverse såkalte interkalasjonsforbindelser ved å inneslutte andre atomer,
molekyler og ioner mellom skiktene. Grafitt-"oksyd" fås ved å
behandle grafitt med sterke oksydasjonsmidler i vannløsning, f.eks. rykende
salpetersyre eller salpetersyre + kaliumklorat. Støkiometrien blir ideelt sett
C8O2OH, og materialet, som reagerer surt, inneholder
karbonyl- (-C=O) og hydroksylgrupper (-C-OH).
Ved to atmosfærers trykk
i flytende hydrogenfluorid ved 20 °C fås først en substans CFx, hvor
x kan være mellom 2 og 5, deretter går substansen over til C12HF2.
Samme reaksjon skjer ved elektrolyse av smeltede alkalifluorider med
grafittanode. Ved temperaturer på 4-600 °C fås en hvit forbindelse (CF)n
ved fluorering av grafitt. Ingen av disse grafittfluoridene og grafittoksydene
leder elektrisk strøm. Elektrisk ledende interkalater kan dannes ved spontan
reaksjon med alkalimetaller eller med halogenider som jerntriklorid og
rheniumheksafluorid. Reaksjon ved katodisk reduksjon eller anodisk oksydasjon
gir mer kontrollerbare resultater. Reaksjon med litium gir et litiuminnhold tilsvarende
opptil C6Li. Kalium, rubidium og cesium gir C8K, C8Rb
og C8Cs, mens natrium bare gir C64Na. Men både for
alkalimetallene og for en god del andre enheter er en mengde forskjellige
sammensetninger mulig. Alkalimetallforbindelsene er uhyre reaktive, mer enn
metallene selv. De selvantenner i luft og reagerer eksplosivt med vann. Den
elektriske ledningsevnen er langt høyere enn for den rene grafitten.
Ved sammensmelting med
metallene og noen ikkemetaller danner karbon karbider. Karbidene av de mest
elektropositive metallene er saltliknende forbindelser som er fargeløse,
ikke-ledende, har moderate smeltepunkter og spaltes av vann til metallioner og
hydrokarboner. Krystallstrukturen har ionisk karakter og karbidionet har ofte
oksydasjonstall -4, men vel så ofte er karbidet for et acetylid å regne, her er
ionet C22-, og disse karbidene spalter av acetylen i
vann. Alkalimetallkarbidene er som regel acetylider: Li2C2,
Na2C2 og KHC2, og det samme gjelder
jordalkalimetallene: CaC2, SrC2, BaC2, men
beryllium danner et gult karbid Be2C som spalter av metan i vann og
trolig inneholder C4--ionet. Det samme gjelder det gulgrønne
aluminiumkarbidet, Al4C3, mens de sjeldne jordmetallenes
karbider kommer i en mellomstilling. De er fargede, med uklare
oksydasjonstallforhold, men dekomponerer i vann på samme måte som de
elektropositive metallenes karbider. Eksempler er de gule YC og LaC2,
det røde CeC2, de gule PrC2, NdC2, SmC2
og ThC2, dessuten Ce2C3, Pr2C3
og Tb2C3. De tre sistnevnte danner en blanding av
acetylen, etylen, metan og hydrogen i en hydrolyseprosess som ennå ikke er
forstått i alle detaljer. De førstnevnte har bare acetylen som hydrolyseprodukt.
Urankarbidet, UC2,
hører derimot til overgangsmetallenes karbider, som har metallisk glans og
elektrisk ledningsevne, høye smeltepunkter, høy hardhet og stor
motstandsdyktighet mot kjemiske påvirkninger. Karbonatomene befinner seg her i
fast løsning i hulrom i metallenes krystallstrukturer, og er ikke ionisk
bundet. Disse karbidene har meget stor betydning i metallurgien og gir blant
annet stålet dets typiske egenskaper. Titan-, zirkonium- og hafniumkarbidene,
TiC, ZrC og HfC, er grå og smelter ved h.h.v. 3140, 3540 og 3890 °C, Vanadium-,
niob- og tantalkarbidene, VC, NbC og TaC, er svarte og smelter ved 2810, 3500
og 3880. Krom har et grått karbid, Cr3C2, som smelter ved
1890 °C, molybden et grått, MoC, med smeltepunkt 2692 °C og et hvitt Mo2C
med 2687 °C og wolfram et svart, WC, med sm.p. 2870 °C, mens uranets dikarbid
er grått og smelter ved 2350-2400 °C. Manganets karbid, Mn3C, likner
det grå jernkarbidet eller cementitt, Fe3C, som er en viktig
komponent av stål og et av de aller best kjemisk karakteriserte stoffer gjennom
alle tider. Dette og nære slektninger som nikkelkarbidet, Ni3C,
likner mye de andre karbidene av overgangsmetallene, men er noe mindre kjemisk
motstandsdyktige, og avgir hydrokarbonblandinger ved syrepåvirkning.
Kobber- og sølvkarbidene, Cu2C2
og Ag2C2, er spesielle, de er ikke metallglinsende og
leder ikke strøm, de er h.h.v. røde og hvite i fargen og er sterkt tilbøyelige
til å eksplodere når de varmes opp, men de er stabile og uløselige i vann og
dannes ikke ved sammensmelting av komponentene, men felles når man leder
acetylengass ned i en vannløsning av kobber- eller sølvioner.
Karbidene av
ikkemetallene, borkarbidet B4C og silisiumkarbidet SiC danner en
egen klasse, de diamantliknende, kovalente karbidene. De er begge svarte,
dårlige elektriske ledere, meget harde(borkarbidet hardere enn diamant),
kjemisk motstandsdyktige, har høye smeltepunkter (h.h.v. 2350 og 2700 °C) og
omtrent samme krystallstruktur som diamant.
Kovalente karbonnitrider
som C3N4 og C4N3 kan ifølge
teoretiske betraktninger være hardere enn diamant og ha andre ekstreme
egenskaper. Derfor har det på 1990-tallet vært gjort mange forsøk på å
fremstille dem. Metodene har vært ekstreme, f.eks. bombardering av karbontarget
med nitridioner eller atomisk nitrogen, laserbeskytning av karbontarget i
nitrogen- eller ammoniakkatmosfære m.m. Det fortelles at man har klart å lage
tynne filmer av karbonnitrider uten spesifisert sammensetning. Rapportene tyder
på at egenskapene kan være usedvanlige, men analysen er ikke kommet så veldig
langt ennå (2000).
Ved meget sterk
oppvarming av kull i nitrogenatmosfære, f.eks. med en lysbueflamme og
kullelektroder, kan man få forskjellige binære forbindelser av karbon og
nitrogen, hvorav den viktigste er den meget giftige gassen cyan, (CN)2,
som noe lettere kan fås ved moderat oppvarming av kvikksølvcyanid. Cyan brenner
i luft med en blåkantet, meget varm flamme, hvor temperaturen kan komme opp i
4850 °C, den varmeste som kan oppnås ved noen kjemisk reaksjon. Den oppfører
seg på mange måter som et halogenmolekyl, f.eks. disproporsjonerer den i basisk
løsning til cyanid og cyanat: (CN)2 + 2 OH- = CN-
+ OCN- + H2O.
Den er løselig i vann,
alkohol og eter, men løsningene er ikke holdbare, og cyan dekomponerer med
tiden i forskjellige karbon- og nitrogenholdige forbindelser. Ved oppvarming
til ca. 400 °C polymeriserer gassen til paracyan, (CN)n, et hvitt,
krystallinsk stoff.
Hydrogencyanid eller
blåsyre, HCN, kan fås av cyan ved hydrogenreduksjon, eller enklere ved å varme
opp ammoniakk og karbonmonoksyd til 500-700 °C i nærvær av en katalysator: NH3
+ CO = HCN + H2O. Gay-Lussac var den første som fremstilte gassen
cyan i 1814 og kalte den cyanogen fordi han trodde den var årsaken til
blåfargen i berlinerblått. Navnet cyanogen er av gresk opphav og betyr
"(mørke-)blåfargens opphav." Blåsyre-navnet henspiller på det samme.
Blåsyre er en meget flyktig væske med kokepunkt nær romtemperatur, og kan
vanligvis regnes for en gass. Den er sterk og hurtigvirkende gift, dødelig dose
regnes som 60 mg for en voksen person. Den karakteristiske, meget sterke lukten
av bittermandler er det siste mange giftmorder- og gasskammerofre har kjent i
livet, den kan merkes også i svake, ufarlige konsentrasjoner. Molekylet
inneholder en trippelbinding og har strukturen H-Cº N, sannsynligvis i blanding med H-Nº
C, med samme bindingstype som i karbonmonoksydmolekylet. Disse to formene kan
ikke skilles fra hverandre, men det kan lages organiske estere av blåsyre i
begge former, de med den førstnevnte strukturen kalles nitriler, de andre
isonitriler. Flytende blåsyre er ustabil og polymeriserer lett, ofte voldsomt.
Et av produktene er adenin, C5H5N5, som i
uratmosfæren sannsynligvis har virket som spore for opprinnelsen av livet.
Blåsyre som selges til skadedyrbekjempelse m.m. tilsettes stabilisatorer for å
hindre polymerisering.
Blåsyre er en svak syre og danner salter som
kalles cyanider og til en viss grad likner halogenidene. Cyanidene av alkali-
og jordalkalimetallene er lettløselige i vann og meget giftige ved inntak fordi
de utvikler blåsyre i mavesaften: KCN + HCl = KCl + HCN. Med unntak for kvikksølv(II)cyanid
er tungmetallcyanidene tungtløselige og derfor mindre giftige, men cyanidionet
er en av de effektiveste kompleksdannerne, og i overskudd av alkalicyanid
dannes komplekser som er løselige. De komplekse cyanidene er langt mindre
giftige enn de enkle. Mange av dem har vært kjent i lange tider, f.eks. gult og
rødt blodlutsalt, K4[Fe(CN)6] og K3[Fe(CN)6]
og berlinerblått, Fe[Fe(III)Fe(II)(CN)6]3. Bruken av
cyanid i sølv- og gullutvinning baserer seg på at det dannes løselige
cyanidkomplekser av sølv og gull med overskudd av alkalicyanider.
Cyanater kan lett
fremstilles av cyanider selv med svake oksydasjonsmidler, f.eks. med
bly(II)oksyd: KCN + PbO = KOCN + Pb. Cyanatene er like gode kompleksdannere som
cyanidene og mange interessante komplekser er kjent. Den tilsvarende syren,
cyansyre, H-O-CºN, fås ved å tilsette syre til
cyanatene. Den er en fargeløs væske som bare er stabil under 0 °C.
Sannsynligvis er den en blanding av HOCN og isocyansyre, H-N=C=O.
Ammoniumcyanat, NH4OCN, konverteres til urea (urinstoff), (NH2)2CO,
ved oppvarming, rett og slett ved at to av hydrogenatomene på det ene
nitrogenet hopper over på det andre (ikke nødvendigvis i samme molekyl) og det
dannes en kovalent binding mellom nitrogenet i ammoniumionet og karbonet. Dette
var den første observerte reaksjonen der et uorganisk stoff ga opphav til et
stoff som også lages i organismen, og viste i 1828 at det ikke var noe
ubrytelig skille mellom organisk og uorganisk kjemi.
Hvis man heller en
løsning av kvikksølv(II)nitrat i etanol, faller det ut et hvitt, krystallinsk,
pulver som er kvikksølv(II)fulminat, Hg(ONC)2. Den tilsvarende syren
kalles knallsyre, H-O-NºC, med en trippelbinding som
tilsvarer trippelbindingen i karbonmonoksyd. Navnet henspiller på at kvikksølv(II)fulminat
er et slagfølsomt sprengstoff som særlig har vært brukt i fenghetter og også
har vært kjent som knallkvikksølv.
Varmer man opp
kalsiumkarbid til 1050 °C i nitrogen får man kalsiumcyanamid, CaNCN. Tilsettes
syre til dette fås et fargeløst, sterkt hygroskopisk stoff som kalles cyanamid,
H2N-Cº N, og kan oppfattes som et amid
av cyansyre. I saltsyre går den over til urinstoff, (NH2)2CO,
men i basisk løsning til en dimer, dicyanamid (H2NCN)2,
et hvitt, krystallinsk stoff med smeltepunkt 212 °C. Fra dette kan det igjen
fremstilles en trimer, melamin eller triaminotriazin, C3N3(NH2)3,
med aromatisk syklisk struktur som er mye brukt i industriell syntese. Til en
triazinring som består av tre nitrogen- og tre karbonatomer i
resonanskonfigurasjon (se under benzen) er det festet aminogrupper (-NH2)
til hvert av karbonatomene som ligger i annenhver posisjon på ringen.
Ved å smelte
kaliumcyanid med svovel fås kaliumtiocyanat eller kaliumrodanid, KSCN. Med syre
fås tiocyansyre eller rodansyre, H-S-Cº N, en
gass som har en sterk tendens til å polymerisere. Under -110 °C er den et
hvitt, krystallinsk stoff, men bare mellom dette smeltepunktet og -90 °C
eksisterer den som en væske. Over dette henger molekylene seg sammen til en
polymer som er fast også ved romtemperatur, men sakte avgir en damp av HSCN.
Tiocyansyren er en av av de få *sterke* syrene, d.v.s. en syre som er
fullstendig hydrolysert i vannløsning. Rodanidionene ter seg ganske likt
klorid. De fleste av dem er vannløselige, unntakene er rodanidene av kvikksølv,
kobber, sølv og gull. Med jern(III) gir rodanidioner i løsning en
karakteristisk blodrød farge p.g.a. dannelse av komplekse kationer: [FeSCN]2+
og [Fe(SCN)2]+, en reaksjon som brukes til påvisning og
også har gitt opphav til navnet (gresk rhodeos = rosenrød). Rodanid er også som
de andre cyanforbindelsene en glimrende kompleksdanner med en myriade kjente
forbindelser, og det samme er isotiocyanatene, saltene av isotiocyansyre,
H-N=C=S. Det er også kjent tiocyan eller rodan, NCS-SCN eller (SCN)2,
som er ustabilt i vann og polymeriserer hurtig i luft til det mursteinsrøde
polytiocyan, men det er stabilt i eddiksyre- eller karbontetrakloridløsning.
Ved reaksjon mellom
blåsyre og klorgass fås cyanklorid, ClCN, en gass med kokepunkt 12,66 °C og smeltepunkt
-6 °C. Den polymeriseres ved oppvarming til triazintriklorid, C3N3Cl3,
med struktur som likner melamin. Kloratomene "sitter løst", er lette
å bytte ut med andre grupper og triazinklorid brukes derfor til mange synteser,
bl.a. til insektmidler og fargestoffer. Det finnes også tilsvarende
forbindelser med fluor, brom og jod, med ganske like egenskaper.
Ved sterk oppheting av
kull og fosfor kan det fås et ustabilt, krystallinsk karbonfosfid, C3P4.
Fosfor danner ikke trippelbindinger, og noe "fosfocyan" tilsvarende
cyanet dannes ikke.
Karbon og svært mange
karbonforbindelser brenner i luft til "kullsyre" eller karbondioksyd,
CO2. Dette er en fargeløs og luktfri gass som består av rettlinjede
molekyler med strukturen O=C=O. Den er løselig i vann og reagerer svakt surt:
CO2 + 2 H2O = HCO3- + H3O+.
Men 99,63 % av gassen befinner seg i løsningen som solvatiserte gassmolekyler,
og de få molekylene av karbonsyre, H2CO3, som finnes i
likevekt med bikarbonationet HCO3-, lar seg ikke isolere
som en konsentrert karbonsyre, alt karbondioksydet forsvinner som gass når
løsningen dampes inn. Tilsettes karbondioksydløsningen base fås først
bikarbonat, og ved fullstendig nøytralisasjon karbonat. Bikarbonater spalter av
karbondioksyd og vann ved oppvarming og går over til karbonater, eks.: 2 LiHCO3
= Li2CO3 + H2O + CO2. Men ved å
lede karbondioksyd inn i karbonatløsninger kan man lage bikarbonater: CO32-
+ H2O + CO2 = 2HCO3-. Alle
alkalikarbonatene kan smeltes uten nevneverdig spalting. Det gjelder også thallium(I)karbonat,
som likevel har lavt smeltepunkt, 273 °C. Andre karbonater spaltes i
metalloksyd og karbondioksyd ved tilstrekkelig oppvarming.
Bikarbonater dannes med
ammonium og alkalimetaller, og de er alle hvite og lett løselige i vann,
litium-, natrium- og ammoniumsaltene tyngst. Karbonatene dannes med en- eller
toverdige metaller, yttrium og lantanidene, men få andre tre- eller flerverdige
metaller. Ammoniumkarbonat, thallium(I)karbonat og alle alkalikarbonatene
unntatt litiumkarbonat er lett løselige i vann, de andre tungt løselige eller
uløselige. Litiumkarbonatet løses dog i atskillig høyere grad enn
jordalkalikarbonatene og karbonatene av Mn, Fe, Ni, Ag, Zn og Pb, som alle er
nokså tungt løselige. Eksempelvis løses 9,3 mg nikkelkarbonat i 100 ml vann ved
25 °C. Karbonatene av Co, Cu, Cd, Hg og de sjeldne jordmetallene regnes for
uløselige. Men karbonationet kan også danne komplekser, og ved tilsetning av
karbondioksyd eller alkalikarbonat i vannet løses ofte betydelig større
mengder. Karbonatene er også alle mer eller mindre tilbøyelige til å løses i
syre, gjerne med utvikling av karbondioksyd.
Ved forbrenning av karbon og karbonforbindelser
uten god oksygentilgang fås karbonmonoksyd eller kullos, CO. For fremstilling i
laboratoriet dryppes maursyre ned i svovelsyre, som stjeler et molekyl vann:
HCOOH - H2O = CO. Molekylet har omtrent samme elektronstruktur som
nitrogenmolekylet, med en trippelbinding (Cº
O) men litt forskjøvet siden ladningen på hver av endepunktene ikke helt
nøytraliseres. Den er en lukt- og fargeløs gass som også har omtrent samme
kokepunkt som nitrogen, -191,5 °C, mer enn hundre grader lavere enn
karbondioksydet. Den er heller ikke noen inert og reaksjonstreg gass som
nitrogenet og karbondioksydet, men derimot nokså reaktiv. Den brenner i luft
med en karakteristisk blålig og meget varm flamme til karbondioksyd. Den er
også et godt reduksjonsmiddel og reduserer mange metalloksyder til metall. I
mange reduksjonsprosesser med kull eller koks, f.eks. den velkjente
masovnprosessen, er det egentlig karbonmonoksydet som står for reduksjonen. Det
har også over 300 ganger så sterk affinitet til oksygentransportørene i blodet
som oksygen, og siden den derfor kan føre til kvelningsdød regnes den for svært
giftig. Effekten merkes ved bare 0,01 volum-% og mer enn 0,5 % kan være dødelig.
Karbonmonoksyd reagerer
med klor til det enda giftigere fosgen, COCl2, og med svovel til
karbonylsulfid, COS. Det er også en god kompleksdanner. Kobber(I)klorid løst i
fortynnet saltsyre tar opp karbonmonoksyd til en addisjonsforbindelse
Cu(CO)Cl.H2O, og gassen reagerer med mange overgangsmetaller til
såkalte karbonylmetallforbindelser som er molekylære i motsetning til de fleste
forbindelser med overgangsmetallene, og også ellers har interessante egenskaper.
Det dreier seg i påfallende høy grad om de metallene som ikke danner
karbonater, men også f.eks. pentakarbonyljern, Fe(CO)5, en væske som
koker ved 102 °C. Med finfordelt metall går reaksjonen lett ved bare moderat
oppvarming.
Hver karbonylenhet gir
metallet et ekstra elektronpar og metallet tar generelt opp så mange
karbonylenheter som det trenger for å bruke opp elektronorbitalene slik at det
får en edelgasskonfigurasjon, f.eks. har pentakarbonyljern 26 + 5x2 = 36
elektroner, det samme som krypton. Det mest åpenbare unntaket er
heksakarbonylvanadium, V(CO)6, hvor plassforholdene gjør det
vanskelig å tilknytte mange nok CO-enheter. Samme utregning gjelder f.eks. for
tetrakarbonylnikkel og heksakarbonylkrom. De odde metallene danner som regel
ikke karbonylforbindelser med bare ett metallatom i molekylet (mononukleære
forbindelser). Den enkleste karbonylforbindelsen til kobolt er
oktakarbonyldikobolt, Co2(CO)8. Her gir karbonylenhetene
hvert koboltatom 8 elektroner. Det blir tilsammen 35. Med en kovalent metall-metallbinding
deler de et par av sine egne og fyller opp til 36.
De fleste
metallkarbonylforbindelsene er ganske flyktige og løses i organiske
løsningsmidler, noe som er nyttig for separasjonsprosesser, men hvis det er mer
enn ett metallatom i molekylet er de mindre flyktige og løses mindre lett eller
overhodet ikke i de organiske løsningsmidlene. Ved delvis substitusjon med
klor, hydrogen, ammoniakk, pyridin, nitrogenmonoksyd (nitrosyl) og andre
grupper kan det lages en hel del forskjellige varianter. Karbonylhalogenidene
er ioniske og inneholder karbonylkationer, f.eks. [Mn(CO)5]+.
De er faste stoffer, som oftest med sterke farger. Hvis
karbonylmetallforbindelser påvirkes av base kan det dannes karbonylmetallater:
Fe(CO)5 + 4OH- = Fe(CO)42- + CO32-
+ 2H2O. Etter surgjøring av løsningene kan det destilleres av noen
meget svake syrer, f.eks. H2Fe(CO)4. For kobolt blir det
HCo(CO)4. Alle disse karbonylforbindelsene spaltes ved 200 °C eller
lavere, og resultatet blir metall av uvanlig høy renhet.
Karbonmonoksyd reagerer
også med alkalimetaller i flytende ammoniakk til alkalikarbonyler, hvite,
krystallinske stoffer med formel Na2[OCCO] og tilsvarende. Med
sterke baser gir karbonmonoksyd formiater: KOH + CO = HCOOK.
Ved elektrokjemisk
reduksjon av karbonmonoksyd fås en ringformet oksosyre, H2C4O4,
såkalt kvadratsyre eller 1,2-hydroksysyklobuten-3,4-dion. Liknende forbindelser
kan fås ved andre prosesser, f.eks. K2C6O6,
kaliumrodizonat eller 1,2-hydroksysykloheksen-3,4,5,6-tetraon-kaliumsalt, ved å
føre karbonmonoksyd over kalium ved 170 °C. Jeg fraskriver meg ansvaret for å
fortelle hva saltene av kvadratsyre heter.
Trikarbondioksyd, C3O2
(O=C=C=C=O), eller karbonsuboksyd er en fargeløs, illeluktende, giftig gass som
kan fremstilles f.eks. ved dehydrering av malonsyre med fosforpentoksyd ved
140-150 °C: 3 HOOCCH2COOH + 2 P4O10 = 3 C3O2
+ 2 H3PO4. Ved romtemperatur polymeriserer oksydet til en
gul substans som ved 100-300 °C blir rubinrød og ved 400 °C fiolett. Gassen
spaltes ved temperaturer over 200 °C til karbon og karbondioksyd.
Trikarbonmonoksyd, C3O
eller C=C=C=O, kan dannes ved varmespalting av fumaroyldiklorid,
Cl-CO-CH=CH-CO-Cl. Det er ustabilt, men kan studeres instrumentelt.
En annen ren
karbon-oksygenforbindelse med formel C12O9 er egentlig
anhydridet av en organisk syre, mellittsyre, C6(COOH)6,
og fås av denne ved påvirkning av et vanntiltrekkende middel som svovelsyre.
Ved oppvarming av
trekull eller metan og svoveldamp til oppimot 1000 °C fås karbondisulfid, CS2,
en fargeløs til svakt gulfarget væske med høy lysbrytningsindeks og lav
viskositet (seighet). Teknisk karbondisulfid lukter vondt p.g.a. urenheter, men
i helt ren tilstand lukter den behagelig aromatisk. Den fordamper lett,
kokepunktet er 46,3 °C, og den brenner med blå flamme til karbondioksyd.
Tenntemperaturen er 230 °C, men i luftblanding kan den antennes ved så lav
temperatur som 100 °C. Et karbondisulfidinnhold i luft på 2 til 50 % er
eksplosivt. Den er også giftig og skadelig både ved innånding og hudkontakt.
Dampen er 2,7 ganger så tung som luft og konsentrerer seg derfor raskt nær
gulvet. Karbondisulfid er et godt løsningsmiddel for organiske stoffer (fett,
harpiks, gummi m.m.) og også for slike uorganiske som ikke løser seg i vann,
f.eks. svovel, fosfor og jod. Den løser seg lett i organiske løsningsmidler som
alkohol, eter, benzen, karbontetraklorid og kloroform, men nesten ikke i vann,
unntatt hvis vannet inneholder sulfidioner. Da dannes det tiokarbonatkomplekser
eller mer presist tritiokarbonat, med ionet CS32-, og egenskaper
som likner karbonatene. Ved syrebehandling fås tiokarbonsyre, H2CS3,
som en ubestandig, rød væske. Også blandingskarbonater som monotiokarbonat, CSO22-
og ditiokarbonat CS2O2- er kjent. Ved å oppvarme
tritiokarbonat med svovel fås oransje tetratiokarbonater med ionet CS42-.
Natriumditiokarbamater, NaCS2NR2, hvor R er en organisk
gruppe eller hydrogen, fås ved å blande karbondisulfid med aminer i nærvær av
natriumhydroksyd. Av natriumsaltet kan det fremstilles sink-, mangan- og
jernsalter.
Oksyderes vannløsninger
av ditiokarbamater med hydrogenperoksyd, klor eller peroksodisulfater fås
tiuramdisulfider. Tetrametyltiuramdisulfid brukes til
vulkaniseringakseleratorer og polymeriseringsinitiatorer (avgir metylgrupper
ved oppvarming). Tetraetyltiuramdisulfid, (C2H5)2N-C:S-S-S-C:S-N(C2H5)2
, er bedre kjent som antabus, som gir allergireaksjoner ved inntak av alkohol
og derfor brukes i terapi for misbrukere. Karbondisulfid polymeriserer under
høyt trykk til en svart
masse med struktur -S-C:S-S-C:S-S-.
Det er også kjent et
karbonsubsulfid, C3S2, en rød væske med smeltepunkt -0,5
°C, som dekomponerer ved oppvarming, og et monosulfid, CS, som over -160 °C
polymeriserer til et rødt, krystallinsk stoff. Karbonmonosulfidet kan som
monoksydet danne interessante komplekser med overgangsmetallene, analogt med
karbonylmetallforbindelsene.
Karbondiselenid, CSe2,
kan fås ved reaksjon mellom smeltet selen og diklormetan. Dette er en gyllengul
væske med kokepunkt 125-126 °C. Den er uløselig i vann som ikke inneholder
selenidioner, den lukter verre enn disulfidet, men er ikke brennbar. Den
polymeriserer sakte ved romtemperatur til en svart substans som strukturmessig
er en analog til polykarbondisulfid. Forskjellige blandingsforbindelser, som
CSSe og CSTe, kan lages, og har liknende egenskaper.
Karbon reagerer med
fluor ved romtemperatur til karbontetrafluorid. Ellers kan halogenider av
karbon med en viss vanskelighet lages ved å brenne finfordelt karbon i
halogenatmosfære. Bedre er det å behandle karbondisulfid med halogen eller
varme opp metan eller andre hydrokarboner med halogen til 250-400 °C.
Karbontetrafluorid, CF4, er en fargeløs gass med kokepunkt -128 °C
som er tungt løselig i vann. Karbontetraklorid, CCl4, også kalt
tetra og bensinoform, er en fargeløs væske med kokepunkt 76,8 °C som knapt nok
er løselig i vann, men løses i en rekke organiske løsningsmidler, foruten at
den er et godt løsningsmiddel selv for upolare organiske stoffer. Den har en
karakteristisk søtaktig lukt. Virker bedøvende og er giftig og kreftfremkallende.
Karbontetrabromid, CBr4, er et blekgult krystallinsk stoff med
smeltepunkt 90,1 °C som er tungt løselig i vann, men løses lett i en del
organiske stoffer. Karbontetrajodid, CI4, er et mørkerødt,
krystallinsk stoff som lukter jod, dekomponerer ved oppvarming og er uløselig i
nøytralt vann, men løses i en del organiske stoffer, samt i baser. Alle de tre
lettere halogenidene er kjemisk ureaktive og virker kvelende på ild, men kan
spaltes av sterk varme, lettere jo tyngre halogenene er. De har ikke noen
tendens til å danne komplekser med kloridioner i vann slik som CS2
har med sulfider, og det er ikke kjent klorokarbonater f.eks.
Tetrahalogenidene av
karbon kan betraktes som halogensubstituert metan og kan like gjerne benevnes
tetrafluormetan, tetraklormetan etc. Også andre enkle hydrokarboner som etan og
etylen har helt halogensubstituerte former med egenskaper som er ganske like
tetrahalogenidene, særlig de sistnevnte. Det finnes også en del
blandingshalogenider, slik som CCl2F2 eller CFClBrI, med
egenskaper som ligger mellom de rene halogenidene. De delvis substituerte
hydrokarbonene, f.eks. kloroform, CHCl3, har egenskaper som ligger
mellom de fullsubstituerte og de usubstituerte.
Hva som er forskjellen
på organiske og uorganiske forbindelser er og har alltid vært litt uklart. Når
de moderne kjemikernes forfedre utvant sine ekstrakter og uttrekk fra de
utroligste substanser og blandet sine miksturer av dem, delte de inn sine
råvarer omtrent slik vi gjør når vi leker 20 spørsmål, i riker. Alt som kom fra
stein og fjell hørte til mineralriket og alt som kunne utvinnes fra levende
eller døde dyr og planter hørte henholdsvis til dyre- og planteriket, og med et
fellesnavn ble de stundom de to siste kalt organiske. Men inndelingene var ikke
sjelden litt vanskelige. Pottaske eller kaliumkarbonat hørte f.eks. til
planteriket fordi det ble utvunnet av treaske, mens fosfor hørte til dyreriket
fordi det ble utvunnet av urin eller knokler. Når både kalium og fosfor ble
funnet i mineraler begynte inndelingen å bli litt usikker. Og snart ble kalium
funnet i blod og fosfor i plantedeler. Løsningen lot til å være å klassifisere
fosfor og kalium og andre slike stoffer som organiske mineraler, noe vi jo
fortsetter med i ernæringsfysiologien, mens at alt som var virkelig organisk
var de karbonholdige, kovalente, ikke-ioniske forbindelsene. Men da den
bayerske kjemikeren Friedrich Wöhler (den første som isolerte aluminium og
beryllium) i 1828 syntetiserte urinstoff, (NH2)2CO, ved å
varme opp ammoniumcyanat, fikk denne tesen et grunnskudd, og siden har vi lært
å fremstille det ene etter det andre av livets kjemikalier syntetisk - et
nukleotid er et nukleotid enten det er tatt ut av en levende celle eller
fremstilt av vulkansk apatittlava, karbondioksyd, vann og luftnitrogen, noe som
er fullt mulig, og det kunstige nukleotidet ville fungere fullkomment i en
levende celle. Etter hvert har vi blitt enige om å holde på den løselige
definisjonen at organiske kjemikalier er de som er 'typisk for det organiske
livet' enten de har en organisk opprinnelse eller ikke.
Men hva er så typisk for
det organiske livet? Tja, ikke-ioniske, kovalente karbonholdige forbindelser,
kanskje? Er så karbondisulfid og -tetraklorid organiske forbindelser? Neppe.
Metan er det derimot definitivt, og kan det derfor kanskje kreves at de
organiske forbindelsene må inneholde en binding mellom karbon og hydrogen? Da
blir kloroform (CHCl3) organisk, mens karbontetrakloridet ikke er
det. Heksakloretan (C2Cl6) likner fullstendig
hydrokarbonet etan (C2H6) i strukturen, men blir da ikke
organisk, og samme forholdet gjelder heksaklorbenzen (C6Cl6)
og benzen (C6H6), mens pentakloretan (C2HCl5)
og -benzen (C6HCl5) blir organiske. Litt kunstig kanskje?
Og hva med pentakloretanol (C2Cl5OH)? Denne forbindelsen
er faktisk en sterk syre, i motsetning til den velkjente etanolen, og
inneholder ikke noen C-H-binding. Men sier vi oss tilfreds med det og holder
oss til definisjonen opplever vi jo også det ironiske at Wöhlers urinstoff (H2N-CO-NH2)
også blir uorganisk. Sannsynligvis ligger skillet organisk/uorganisk i hodene
våre, vi er liv som betrakter en verden av liv og ikke-liv. La oss si at
tetraklormetan er et organisk stoff mens karbontetraklorid er uorganisk.
Karbon reagerer med
hydrogen bare ved oppvarming til svært høye temperaturer. Det går med en
elektrisk lysbue mellom grafittelektroder i hydrogenatmosfære, og resultatet er
for det meste en blanding av metan, CH4, og acetylen, C2H2.
Dette er hydrokarboner, forbindelser mellom karbon og hydrogen og ingen andre.
Metan kan også lages ved å blande to volumdeler hydrogensulfid og en volumdel
karbondisulfid og føre blandingen gjennom et kvartsrør hvor det ligger noen
kobberspon og varmes opp slik at de gløder: 2H2S + CS2 +
8Cu = 4Cu2S + CH4.
Metan er en uhyre vidt
utbredt gass i universet, det er bare hydrogen, helium og vann det finnes mer
av. Den er også en organisk forbindelse, et produkt av mange organiske
forråtnelses- og fordøyelsesprosesser.
Fjerner du et hydrogen
fra et metanmolekyl får du en del av et metanmolekyl som kalles metyl, CH3.
I stedet for hydrogenatomet kan du da sette på diverse andre ting. Dette kalles
å substituere. En metylgruppe kan også substitueres inn på andre forbindelser
og vi pleier å betegne slike substituenter som radikaler. Hvis to
metylradikaler føres sammen får vi etan, C2H6 (det kan
gjøres ved å behandle metylbromid med natrium), også en brennbar gass og et
hydrokarbon. Og det er det velsignede med karbonet og de kovalente bindingene
at slik kan du bare fortsette. Det neste medlemmet i serien, C3H8,
heter propan og det neste, C4H10, butan, begge brennbare
gasser og velkjente produkter. Klarer du å telle på gresk finner du fort
navnene på de neste også: C5H12 er pentan, C6H14
er heksan, så kommer heptan, oktan, nonan, dekan, hendekan, dodekan, tridekan,
tetradekan, pentadekan, heksadekan, heptadekan, oktadekan, nonadekan, ikosan,
henikosan, dokosan, trikosan o.s.v. C30H62 er triakontan,
C40H82 er tetrakontan, C100H202 er
hektan. De tilsvarende radikalnavnene lages ved å hekte av -an og sette på -yl,
etyl, propyl o.s.v. En slik rekke forbindelser som bare skiller seg fra
hverandre ved kjedelengden kalles en homolog rekke, i dette tilfellet har
rekken fellesnavnet alkanene, de hydrokarbonene hvor antall hydrogen er dobbelt
så mange som karbonene + 2, og som (derfor) ikke inneholder noen
dobbeltbindinger. Organiske forbindelser uten dobbeltbindinger sies å være
mettede, og alkanene er altså de mettede hydrokarbonene. De kalles også
parafiner.
Alkanenes egenskaper
varierer ganske regelmessig oppover i rekkene. Ettersom molekylvekten øker,
øker også smelte- og kokepunktet. De fire første er gasser, butan har kokepunkt
omtrent ved frysepunktet for vann, noe som har betydning for de som banner og
strever med kokeapparater vinterstid. Alle fra og med pentan til og med
pentadekan er væsker, men stadig seigere jo lengre opp man kommer. Heksadekan
og heptadekan har smeltepunkt omtrent ved romtemperatur, og er bløte,
voksaktige faste stoffer. Det er de som kommer etter også, men etterhvert
hardere. Alle, selv de tyngste, flyter på vann, og alle er de brennbare, særlig
de letteste, som er atskillig mer brennbare enn rent karbon.
Hvis et alkan har 4
eller flere karbonatomer kan det forekomme forgreninger. C4H10
er ikke bare CH3-CH2-CH2-CH3, det
vanlige butanet, også kalt n-butan (n=normal), men også CH3-CH(CH3)-CH3,
som kalles isobutan (iso=samme). Pentan har tre mulige konfigurasjoner, enten
uforgrenet, med en gren på nest ytterste ledd eller i kryssformasjon. De to
variantene kalles h.h.v. iso- og neopentan. Så har vi heksan, som har 5 mulige
konfigurasjoner, uforgrenet, med en ettledds gren på nest ytterste eller midtre
ledd, med to ettledds grener på hvert av de nest ytterste leddene og med begge
de to grenene på det samme nest ytterste leddet. Heptan har 9 mulige, og så kan
du selv regne videre på hvor mange de andre har. Hvis man fortsetter med å
kalle de nye variantene iso-, neo- etc., slipper man fort opp for brukbare
trebokstavers ord, og derfor fant man på å nummerere atomene i den lengste
ubrutte kjeden i molekylet og bruke det navnet som et slikt hydrokarbon uten
grener har, samt navngi grenene og angi posisjonen med tall. Isobutan får
dermed navnet 2-metylpropan, siden den lengste kjeden i molekylet er på 3
karboner og det sitter en metylgruppe på den midtre. De 9 konfigurasjonene av
heptan kalles n-heptan, 2-metylheksan, 3-metylheksan, 2,2-dimetylpentan,
3,3-dimetylpentan, 2,3-dimetylpentan, 2,4-dimetylpentan, 3-etylpentan og
2,2,3-trimetylbutan. Merk at 2,3-dimetylpentan og 3,4-dimetylpentan er
identiske, de er bare speilbilder av hverandre. I slike tilfeller brukes alltid
bare de laveste tallene. Alle disse stoffene er distinkte kjemikalier, men har
samme formel (C7H16). De forskjellige konfigurasjenene
kalles isomerer av grunnvarianten, som for heptan naturlig regnes for å være
den uforgrenede. Forskjellene i egenskaper kan være nokså store, særlig for de
lengre hydrokarbonene. For heptan gjør det seg særlig gjeldende på frysepunktene,
hvor n-heptan har -90,61 °C og 2,2,3-trimetylbutan ligger helt oppe på -24,19
mens de andre alle ligger mellom -134,46 og -118,27. Kokepunktene ligger mellom
79,197 og 98,42 °C, og det er en tendens til at de minst forgrenede løses bedre
i de mest upolare organiske løsningsmidlene.
Hvis du tilsetter 30 ml
svovelsyre forsiktig til 10 ml etanol og varmer opp, *FORSIKTIG*, får du
etylen, et umettet hydrokarbon. Umettede hydrokarboner inneholder
dobbeltbindinger (alkener) og/eller trippelbindinger (alkyner) mellom
karbonatomer. Et alkyn kan lages av et alken ved å addere brom til alkenet:
-CH=CH2 + Br2 = -CHBr-CH2Br, og deretter
behandle det med den meget sterke basen natriumamid: -CHBr-CH2Br +
NaNH2 = -CºCH + NH4Br + NaBr. På
hydrokarboner som ikke har dobbeltbindingen på enden av molekylet (terminalt),
blir den nye trippelbindingen i denne reaksjonen flyttet til et av
endepunktene.
Det enkleste alkenet er etylen (eller mer
systematisk eten): CH2=CH2, et plant molekyl, mens det
enkleste alkynet er acetylen (eller mer systematisk etyn): H-Cº C-H, et lineært molekyl. Alkenene og alkynene gis navn på samme
måte som alkanene, slik at vi får propen (propylen), buten, penten, heksen
o.s.v., samt propyn, butyn etc. Har de flere enn 3 karboner må posisjonen til
dobbelt- eller trippelbindingen angis, f.eks. har 2-heksen dobbeltbindingen
mellom det andre og det tredje karbonet i molekylet.
Er det mer enn én
multippelbinding i samme molekyl angis det med gresk nummerering foran endelsen
-en eller -yn, slik som i butadien, CH2=CH-CH=CH2.
2,6-dekadien er CH3-CH=CH-CH2-CH2-CH=CH-CH2-CH2-CH3.3,8-dodekadien-5-yn
er CH3-CH2-CH=CH-Cº C-CH2-CH=CH-CH2-CH2-CH3.Er det noen som påtar seg å finne
ut hvor mange isomerer disse forbindelsene har?
Som nevnt kan ikke et
molekyl roteres om en dobbeltbinding, og en form for isomeri, den såkalt
geometriske, gjelder slike molekyler med dobbeltbinding. F.eks. kan 2-buten,
som har alle karbonatomene i et plan og dobbeltbindingen mellom de to midtre ha
begge de to ytterste karbonatomene på samme side av dobbeltbindingen eller et
på hver side. For å skille mellom de to variantene benevnes den første som
cis-2-buten og den andre trans-2-buten og tilsvarende for tilsvarende
forbindelser. Er det flere dobbeltbindinger kan det gjerne bli aktuelt å
benevne molekylet med trans-cis-trans- eller cis-cis-trans-cis- etc. De samme
to forstavelsene brukes også i liknende situasjoner, f.eks. hvis man vil si noe
om to sidegrener i en ring ligger på samme side av ringplanet eller på hver sin.
De umettede
hydrokarbonene har merkbart lavere smelte- og kokepunkt enn de mettede, noe som
har kostholdsfysiologisk betydning. En viktig egenskap de har er også at de kan
addere andre molekyler over dobbeltbindingene sine. F.eks. kan et etylenmolekyl
CH2=CH2 addere et molekyl brom slik at vi får
1,2-dibrometan, CH2Br-CH2Br. Denne reaksjonen går av seg
selv ved enkel sammenblanding av ingrediensene og brukes til test på umettethet
ved at man ser den rødbrune bromfargen forsvinne. På samme måte kan et
propenmolekyl, CH3-CH=CH2, addere vann til isopropanol,
CH3-CH(OH)-CH3. Hydrogen kan også adderes, slik at de
umettede forbindelsene mettes (man sier også at den herdes). Og faktisk kan to
molekyler med dobbeltbindinger addere hverandre ved såkalt kondensasjon, ja
ikke bare to, men lange rekker av enkeltmolekyler, slik at det oppstår
polymerer. Dette faktum åpnet en ny gren av kjemien som skulle vise seg å få
enorm betydning. Gruppen etenyl, CH2=CH-, er bedre kjent som vinylgruppen.
Med en velegnet initiator eller startreagens kan slike molekyler adderes til
hverandre i hurtige kjedereaksjoner og på få sekunder danne utstrakte nettverk
av molekyler med sterkt etterspurte egenskaper. Vinylplaster kan som
utgangspunkt ha f.eks. vinylklorid, CH2=CHCl, vinylbenzen
(=fenyletylen eller styren), C6H5CH=CH2,
akrylnitril, CH2=CH-CN eller metylmetakrylat, CH2=C(CH3)COOCH3,
og gi produktene polyvinylklorid (PVC), -CH2-CHCl-CH2-CHCl-,
polystyren, -CH2-CH(C6H5)-CH2-CH(C6H5)-,
orlon, -CH2-CH(CN)-CH2-CH(CN)- og pleksiglass, -CH2C(CH3)(COOCH3)CH2C(CH3)(COOCH3)CH2.
Slike reaksjoner kan også gå mellom to forskjellige utgangsstoffer, såkalt
kopolymerisering. En liknende, industrielt viktig reaksjon er
Diels-Alder-reaksjonen, hvor et molekyl med to dobbeltbindinger like inntil
hverandre adderes til et annet molekyl med en dobbeltbinding slik at det
oppstår en ringstruktur. En praktisk måte å lage ringer med seks karbonatomer
på, så praktisk at Diels og Alder fikk Nobelprisen for det, sant å si. Hvis
dien-molekylet (det med de to dobbeltbindingene) er ringformet selv, fås
ringstrukturer med brostrukturer. Hvis molekylet som dienet reagerer med er et
alkyn i stedet for et alken fås ringer med to dobbeltbindinger, syklodiener.
Disse kan man lett dehydrogenere til benzenringer ved å varme dem opp i nærvær
av platina.
Hydrogen/karbonforholdet
i de enkle alkenene (eller olefinene), som også er en homolog rekke, er 2:1,
mens i alkynene er det 2n-2:n, hvor n er et tilfeldig positivt heltall. Men det
går an å ha slike H/C-forhold uten at det er multippelbindinger i
karbonkjedene. Hvis endene av et olefin møtes og kobles sammen får man en ring,
et ringformet hydrokarbon hvor H:C-forholdet er 2:1, men uten dobbeltbindinger.
Et eksempel er sykloheksan, C6H12. Utfra atomantallene er
dette en isomer av heksen, men altså uten dobbeltbindingen. Ringformede
karbonforbindelser navngis som regel på grunnlag av ringen, når ikke andre
deler av molekylet synes viktigere. Nummereringen skjer langs ringkarbonene i
klokkeretningen, og begynner der hvor et karbon er forbundet med en annen
gruppe, eller hvis det er flere grupper, på det stedet som gir den laveste
nummerkombinasjonen og med de enkleste gruppene først.
1-metyl-3-propyl-4-etyl-sykloheksan kan ikke skrives 1-metyl-4-etyl-5-propyl-sykloheksan
fordi tallene blir høyere. Sykliske hydrokarboner har klart høyere smeltepunkt
enn de kjedeformede og også noe høyere kokepunkt. Nordmannen Odd Hassel fikk en
gang nobelprisen i kjemi for strukturarbeider på sykloheksan. Molekylet har den
strukturmessige begrensningen at enkelt bundne karbonatomer nødvendigvis må
peke ut i hjørnene av et tetraeder med bindingene sine. Siden alle bindingene
spriker ut i det tredimensjonale rommet kunne ikke molekylet forme seg som en
fin, flat sirkel. Hassel viste at sykloheksan kunne veksle mellom to former, en
trans-form hvor molekylet gikk i sikksakkmønster sett fra siden, /\/, og en
cis-form hvor den ene enden hadde vridd seg: \_/. De to formene hadde små, men
målbare forskjeller i egenskapene, og selv om bindingene var de samme mellom de
samme atomene, måtte det erkjennes at det var to forskjellige molekyler. Dette
er et eksempel på stereoisomeri, som baserer seg mer på form enn på struktur.
Mer om det senere.
Men også i ringene kan
det opptre dobbeltbindinger, hvis du setter inn en dobbeltbinding i sykloheksan
blir det C6H10 og vil hete sykloheksen. Kommer det to
dobbeltbindinger kan det være 1,3-eller 1,4-sykloheksadien, C6H8.
Det er også muligheter for tre dobbeltbindinger. Men C H er ikke
1,3,5-sykloheksatrien. Nei, det skjer noe spesielt. I en slik tre-umettet
seks-karbon-ring er alle karbonatomene involvert i dobbeltbindinger og vinklene
mellom alle bindingene er 120°. Dermed kan hele molekylet få en plan,
todimensjonal form, en regulær sekskant av karbonatomer med et hydrogen
tilknyttet til hvert. Dette molekylet kalles benzen og ringstrukturen en
benzenring. Den tyske kjemikeren Friedrich August Kekule von Stradonitz
(1829-1896), som i 1858 fastslo at karbon var fireverdig og gjorde pionerarbeidet
for å bestemme de organiske forbindelsenes struktur, var den første som beskrev
denne strukturen. (Ifølge ham selv kom ideen til ham i en drøm etter lengre
tids funderinger.) Hvis strukturen hadde vært slik som Kekule først tegnet opp,
og mange fortsatt gjør, med annenhver dobbelt- og annenhver enkeltbinding
mellom karbonene, ville sekskanten ikke vært regulær, for dobbeltbindinger
mellom karbonatomer er kortere enn enkeltbindingene (ca. 1,34 mot ca. 1,54 Å).
Men faktisk viser målinger at sekskanten er helt regulær, med identisk avstand
mellom karbonatomene. Strukturen kan allikevel ikke være slik som Kekule
trodde, og den vanlige måten å tegne benzenringer på er feil. I virkeligheten
har den vist seg å bestå av en mellomting mellom en struktur hvor det er
annenhver enkelt- og annenhver dobbeltbinding mellom karbonene og en struktur
hvor bindingene er byttet om i forhold til den første. Dette kalles en
resonansstruktur, fordi man opprinnelig tenkte seg at benzenet vekslet mellom
de to strukturformene, men det har vist seg at bølgefunksjonene til
p-elektronene i benzen er konstant i to ringer på hver side av benzenringen.
Alle bindingene mellom karbonatomene er like, og har halvparten så stor
p-tetthet som en vanlig dobbeltbinding, altså er det halvannenbindinger som
holder benzenet sammen. Mange tegner derfor idag benzenmolekylet som en
sekskant med en ring inni, men Kekulés variant er fremdeles populær, mye fordi
den er lettere å få til med enkle grafiske hjelpemidler, men også kanskje fordi
den er stiligere?
Selvsagt plasserer
benzenelektronene seg slik fordi konfigurasjonen gir mindre indre energi enn
vekslingen mellom enkelt- og dobbeltbindinger, og benzenringen er også en
spesielt stabil struktur som er enda vanskeligere å bryte opp enn andre kovalente
karbongrupper. Vanlige umettede hydrokarboner kløves lett av sterke
oksydasjonsmidler, men hvis en benzenring med en mettet sidegren (eks. toluen
eller metylbenzen) utsettes for sterke oksydasjonsmidler, oksyderes den
*mettede* sidegrenen før ringen. At benzen ikke er mettet vises ved at den kan
addere hydrogen og blir til sykloheksan. Men hvis benzenet har en umettet
sidegren, som f.eks. i etynylbenzen, omdannes etynylgruppen til etenyl og
etenyl til etyl før ringen hydrogeneres. Denne stabiliteten er også noe av
forklaringen på at grafitt, som består av lag på lag med store, sammenhengende
flater av slike sekskanter, er stabilere enn diamant, og den ubrutte
bølgefunksjonen av p-elektronene gir en elektronbevegelighet som er med på å
forklare grafittens ledningsevne sammenliknet med diamant, som er en isolator.
Resonans er et viktig
fenomen i den organiske kjemien. Alle molekylære sammenstillinger av atomer som
kan tegnes på to eller flere forskjellige måter etter de vanlige valensreglene
(regn også med muligheter for at et eller flere atomer kan ha elektrisk
ladning) har i virkeligheten en elektronkonfigurasjon som er en mellomting
mellom disse tilstandene, og er derfor resonansstabilisert. Ikke minst er dette
viktig for mange mellomformer i organiske reaksjoner. Mange av reaksjonene
ville ikke kunnet gå hvis det ikke var for resonansstabiliseringen.
Forbindelser som
inneholder benzenringer kalles aromatiske, fordi mange av de første som ble
oppdaget hadde sterk lukt. De andre sykliske (ringformede) forbindelsene kalles
alisykliske eller også naftener. De kjedeformede, som ikke ligger i ring,
kalles alifatiske. Alifatiske radikaler som metyl, etyl o.s.v. kalles med et
fellesnavn alkylradikaler mens de aromatiske kalles arylradikaler. Benzen er det
enkleste av de aromatiske hydrokarbonene. Usystematisk nok kalles ikke
benzen-radikalet benzyl, men fenyl. Benzyl er forbeholdt radikalet av toluen,
et annet kjent aromatisk hydrokarbon som har en metylgruppe på benzenringen
(toluen er altså identisk med metylbenzen). Xylen er
dimetylbenzen. Her
er to metylgrupper substituert inn på ringen, og produktet kalles xylen enten
gruppene står i 1,2-, 1,3- eller 1,4-posisjon. Slike situasjoner oppstår ofte
når benzen substitueres med mer enn en gruppe, og det har blitt vanlig å skille
disse tre mulige variantene (merk at 1,5 er identisk med 1,3 og 1,6 med 1,2)
ved å bruke betegnelsene orto-, meta- og para, slik at orto-xylen er
1,2-dimetylbenzen, meta-xylen er 1,3-dimetylbenzen og para-xylen
1,4-dimetylbenzen. Hvis to benzenringer sitter inntil hverandre slik at to
karbonatomer er felles for de to ringene (andre måter, f.eks. med ett atom
felles, går ikke), får vi et annet kjent hydrokarbon som heter naftalen, C10H8.
Med tre ringer i kjede fås antracen, C14H10. Hvis kjeden
går i vinkel får vi en isomer av antracen som kalles fenantren.
Merk at jo flere ringer
du setter inntil hverandre jo lavere blir hydrogenprosenten, mens
karbonprosenten øker. Slike polysykliske forbindelser dannes også i
forkullingsprosesser og ufullstendig forbrenning og finnes i store mengder i
røyk og mindre i røkt og stekt mat og i grillmat samt i brente kaffebønner o.l.
Det finnes ganske mye av dem i jord, trolig med opphav i skogbranner. Til dels
er de sterkt kreftfremkallende. Det hender at krystalliserte blandinger av
polysykliske aromatiske hydrokarboner forekommer sammen med kvikksølvmineraler,
trolig som resultat av omdannelse av organiske sedimenter ved forholdsvis høy
temperatur.
Med de polysykliske
forbindelsene blir Kekules tegnemåte tydelig uriktig. Det går greit når
benzenringene ligger i kjede, men prøv å sette dem sammen med mer enn en side
felles...
Som benzenet er de
polysykliske aromatiske hydrokarbonene uvanlig stabile. Både hydrokarbonene
selv og avledninger av dem forekommer ofte som fargestoffer i naturen, f.eks.
har plantefargestoffet alizarin vært brukt som rødfarge på militæruniformer, og
på uniformer fra napoleonstiden kan man beundre den praktfulle rødfargen i
museer ennå idag, mens de andre fargene har falmet. Polyaromatiske pigmenter
brukes også f.eks. av sjøanemoner, og fossiler av sjøanemoner fra så langt
tilbake som 150 millioner år siden er ofte vakkert farget av godt bevarte
polyaromatpigmenter.
Hvis man setter inn et
oksygenatom mellom et av hydrogenene på et hydrokarbon og karbonet får man en
hydrokarbonrest og en OH-gruppe, som tilsammen utgjør en alkohol. En enkel måte
å fremstille en alkohol på er å tilsette vann til et alken i nærvær av sterk
syre. Vannet adderer seg til dobbeltbindingen: CH3-CH=CH2
+ H2O = CH3-CH(OH)-CH3.
Selv om dobbeltbindingen er i enden av molekylet
kommer aldri OH'en ytterst, men alltid på det nest ytterste karbonet. Dette er
en sekundær alkohol, det karbonet som OH-gruppen sitter på har to nabokarboner.
Markownikoffs regel for slike addisjonsreaksjoner sier at når et polart molekyl
adderes til en dobbeltbinding i et asymmetrisk molekyl vil den positive delen
av det polare molekylet adderes til karbonet med flest hydrogenatomer. Skal du
ha et primært alkohol med OH-gruppen på enden, hvor karbonet bare har ett
nabokarbon, kan du gå ut fra et halogenid hvor halogenatomet sitter på enden av
karbonkjeden. Tilsettes base til et slikt går reaksjonen lett:
CH3-CH2-CH2-CH2-CH2-CH2Cl
+ OH- = CH3-CH2-CH2-CH2-CH2-CH2OH
+ Cl-.
Alkoholene navngis ved å
legge til -ol på det tilsvarende hydrokarbonnavnet, f.eks. gir etan etanol,
tridekan gir tridekanol, heksen gir heksenol, pentyn gir pentynol. Noen
alkoholer har egne navn som ofte foretrekkes, den viktigste er fenol, som er
alkoholen til benzen. Kresol er alkoholen til toluen, CH3C6H4OH,
det finnes i en orto-, meta- og paraisomer. Metanol benevnes noen ganger som
karbinol, som også har vært brukt som betegnelse på alkoholer som kan sies å
være avledet av metanol, f.eks. er (CH3)3COH trimetylkarbinol,
men kalles idag fortrinnsvis 1,1-dimetyletanol. Hvis det er nødvendig angis
plasseringen av OH-gruppen som vanlig med tall, f.eks. er den første alkoholen
vi fikk ved vannaddisjon 2-propanol mens 2,7-dekandiol er dekan med OH på 2. og
7. karbon. 1,3-fendiol kunne vært benzen med OH på to karboner med ett
usubstituert mellom seg, men slike forbindelser kaller man heller
dihydroksybenzen. 1,2,3-propantriol har også et spesielt navn, glyserol, en
viktig forbindelse. 1,2-etandiol kalles etylenglykol. Slike toverdige alkoholer
kan fremstilles av alkener ved oksydasjon med kaliumpermanganat i kald, svakt
basisk løsning. De kalles med et fellesnavn glykoler.
Alkoholer har mye høyere
smelte- og kokepunkter enn hydrokarbonene. Ingen alkoholer er gasser ved romtemperatur,
og selv metanolen koker ikke før ved 65 °C. Alle de enverdige (med en
OH-gruppe) mettede alkoholene til og med dekanol er flytende ved romtemperatur,
til sammenlikning er hydrokarbonene flytende t.o.m. pentadekan. De flerverdige
alkoholene har høyere smeltepunkter, f.eks. er diolene flytende bare t.o.m.
heksandiol. Fenol er også et fast stoff, men smelter allerede ved 43 °C. De
toverdige fenolene har høyere smeltepunkt, 1,4-formen (som gjerne kalles
hydrokinon) smelter ved 173 °C. Bare de letteste enverdige alkoholene er
løselige i vann, fra pentanolene er de tungt løselig eller uløselige, men
løseligheten blir bedre jo flere hydroksylgrupper det er i molekylet. Mange
fenoler er også godt vannløselige.
Alkoholene er fargeløse
eller hvite stoffer. De faste er myke, voksaktige, krystallinske stoffer, som
hydrokarbonene, og de er like brennbare. De vannløselige, enverdige alkoholene
har skarp lukt og smak og er biologisk aktive, sterke giftstoffer. De
flerverdige og de tyngre er mindre giftige, og alkoholer med mange OH-grupper
smaker søtt, f.eks. er sorbitol, et kunstig søtstoff som er ca. halvparten så
søtt som sukker, 1,2,3,4,5,6-heksanheksaol. Mange alkoholer har behagelig lukt
og forekommer som lukt- og smaksstoffer i naturen, f.eks. er 1-isopropyl-4-metyl-2-hydroksybenzen
eller tymol det aktive luktstoffet i timian og
1,2,6,6-tetrametyltrisyklo[5.3.1.02,8]hendekan-11-ol, eller med et
hyggeligere navn juniperol, er aromaessensen i einerbær. Ellers er glyserol en
flerverdig alkohol som er uhyre viktig i biokjemien og flere andre alkoholer
har også stor biologisk betydning.
Karbonsyre kunne sies å
være en alkohol, en dehydrert fireverdig metanol eller metantetraol, C(OH)4
minus et molekyl vann blir CO(OH)2 eller H2CO3.
Men dette er jo en syre, og selv om alkoholene på visse måter er motparten til
de organiske syrene reagerer de selv mer surt enn basisk i vann. Alkoholer
reagerer også med alkalimetaller og en del andre reaktive metaller til
alkoholater, som er krystallinske stoffer med mye høyere smeltepunkter enn
alkoholene og god løselighet både i vann og i organiske løsningsmidler som
vanligvis ikke løser alkalisalter. Fenol er en betydelig sterkere syre enn de
andre alkoholene, på grunn av en annen resonanskonfigurasjon med dobbeltbinding
til oksygenatomet som er mulig når hydrogenet mangler. Derfor har fenol også
vært kalt karbolsyre. Karbolvann er det tradisjonelle navnet på en 2%
vannløsning av fenol. Fenolatene har liknende egenskaper som de andre
alkoholatene. Alle alkalialkoholatene reagerer sterkt basisk i vannløsning.
En viktig sorts
forbindelser som likner alkoholer er karbohydrater, også kalt sukkerarter eller
sakkarider. Det spesielle ved dem er at de foruten karbon inneholder nøyaktig
dobbelt så mange atomer hydrogen som oksygen, d.v.s. at de består av karbon
pluss så og så mange vannmolekyler. Denne regelen er riktig nok ikke helt
ufravikelig, og idag regnes en del substituerte karbohydrater som f.eks.
metylglukose, C7H14O6, til karbohydratene.
Glukose er en vanlig sukkerart med formel C6H12O6.
Til sammenlikning har sorbitol C6H14O6.
Sorbitol kan også kalles 1,2,3,4,5,6-heksanheksaol, og glukose kunne gis navnet
1-heksanal-2,3,4,5,6-pentaol, for siden det mangler to hydrogen i forhold til
sorbitolet er den sjette posisjonen i kjeden ikke en hydroksylgruppe men en
hydroksylgruppe minus 2 H, altså en aldehydgruppe. Andre sukkerarter mangler
ikke hydrogenene sine i endene, men inne i kjeden, slik at det har en annen
karbonylgruppe, en keto-gruppe der inne i stedet for en aldehydgruppe på
endepunktet. De sukkerartene som inneholder en aldehydgruppe og altså er
aldehyder kalles aldoser, mens de som er ketoner kalles ketoser.
Det er mulig å
fremstille sukker med molekyler i slike 'rettlinjede' kjeder på samme måte som
sorbitolet. Men både aldehyd- og ketogrupper er forholdsvis reaktive enheter,
og hvis slike molekyler løses i vann, legger molekylet seg straks i ring ved at
denne gruppen reagerer med den andre enden av molekylet. Slik forekommer
karbohydrater vanligvis i naturlig tilstand. Sukkermolekyler inneholder en
rekke asymmetriske karbonatomer og dreier derfor polarisasjonsretningen av
polarisert lys som skinner gjennom dem. De fleste naturlige sukkermolekyler er
høyredreiende og betegnes med D- foran navnet, f.eks. kalles naturlig glukose
D-glukose. I et molekyl kjedeformet sukker er hvert av de asymmetriske
karbonatomene forbundet med en -H og en -OH samt enten en CHOH (arrangert på
diverse måter) på hver side eller en karbonylgruppe eller en CH2OH-gruppe
på en av sidene. Men når molekylet knyttes sammen til en ring får det et ekstra
asymmetrisk karbon, det som før var del av aldehyd- eller ketogruppen. Dette
karbonet er omgitt av en -H, en -OH, en -O- og en -CHOH-, og avhengig av
hvordan aldehydgruppen er orientert når den reagerer med OH'et i den andre
enden kan enten -OH være på "over"-siden av ringplanet og -H under
eller omvendt. De to formene innvirker sterkt på polarisasjonsvinkelen og
betegnes med gresk alfa og beta. Med glukose som eksempel igjen, hvor det er
den nest ytterste OH-gruppen som reagerer med aldehydet og det derfor er en CH2OH-gruppe
utenfor ringplanet, er det formen med -OH på motsatt side av denne gruppen som
betegnes alfa-D-glukose mens den som har -OH på samme side betegnes
beta-D-glukose. Siden ringsammenknytningen er en likevektsreaksjon og det
derfor alltid er en liten del kjedesukker i en løsning, oppstår det spontant en
blanding av de to formene, og hvis en av dem har lavere indre energi vil den dominere.
I glukose utgjør betaformen alltid 65 % av en ren, nøytral vannløsning. Dette
har sammenheng med at sukkermolekylet har en "stol"-form akkurat som
sykloheksan, og av de perifere bindingene til karbonatomene (de bindingene som
ikke inngår i ringen) står en ut omtrent i ringplanet mens den andre står
omtrent loddrett på planet. Hvis det er en OH-gruppe som står loddrett på
planet kommer dens elektronsky nærmere de andre elektronene i molekylet enn
hvis den hadde stått ut i ringplanet, og siden det kreves energi for å presse
elektroner sammen vil former hvor de største gruppene står ut i ringplanet ha
lavere indre energi og større stabilitet enn de med store grupper loddrett på
planet.
I likhet med de
alkoholene som har mange OH-grupper, er også karbohydratene lettløselige i
vann. Siden alle grønne planter vet hvordan de skal lage sukker, forekommer det
rikelig av disse kjemikaliene i både dyre- og planteriket, og det er kjent en
rekke forskjellige varianter.
De viktigste er de som har henholdsvis 5 og 6
karbonatomer i molekylet. Vi tar i bruk det greske tallsystemet igjen og kaller
de første pentoser mens de andre går under betegnelsen heksosene. De viktigste
pentosene er arabinose, ribose og xylose, alle med formel C5H10O5,
mens de vanligste heksosene er glukose (druesukker), galaktose, mannose og
fruktose (fruktsukker), alle med samme formel som glukosen, d.v.s. at de er
isomere.
Alle disse pentosene og
heksosene er monosakkarider, og består av et enkelt ringformet sukkermolekyl.
Men ofte kan monosakkarider bindes sammen ved vannavspalting fra to OH-grupper
slik at det oppstår en eterbinding. Sukkere som er laget av noen få
sammenbundne monosakkarider kalles oligosakkarider. Hvis det er mange er navnet
polysakkarider. Disakkaridene inneholder to enheter og har formelen C12H22O11,
hvis de er satt sammen av heksoser. Mange er viktige i naturen, f.eks. sukrose
(også kalt sakkarose, rør- eller roesukker eller vanlig sukker) som består av 1
glukose og 1 fruktose, laktose (melkesukker) er 1 glukose og 1 galaktose mens
maltose (maltsukker) består av 2 glukoser. Trisakkaridet raffinose, C18H32O16,
som finnes i sukkerroer, består av 1 hver av galaktose, glukose og fruktose.
Formelen for
polysakkaridene er tilnærmet (C6H10O5)n
for heksosene og (C5H8O4)n for
pentosene. Biologisk uhyre viktige er glykogen, stivelse og cellulose, som er
bygget opp av glukoseenheter. For cellulose er n omtrent 3000. Stivelse består
av to polysakkarider, amylose med n= ca. 200 og amylopektin med n= ca. 1000.
Cellulosen og amylosen består av bunter av stive molekylkjeder, mens
amylopektinet og glykogenet er forgrenet. Karakteristisk for mange
polysakkarider er dårlig vannløselighet, flere brukes som strukturdannende
elementer, både av planter og dyr.
Når man varmer opp
alkoholer med konsentrert svovelsyre til vanligvis knapt et par hundre grader
trekker den sterkt hygroskopiske svovelsyren til seg et molekyl vann fra to
alkoholmolekyler og vi får en eter, f.eks. 2C4H9OH - H2O
= (C4H9)2O = dibutyleter. Varmer man opp
blandinger av forskjellige alkoholer med svovelsyre kan man få etere med
forskjellige radikaler, f.eks. fenyletyleter: C6H5OC2H5.
Eterne er en slags isomerer av de enverdige alkoholene med oksygenet mellom to
karboner i stedet for mellom et karbon og et hydrogen. Williamsons etersyntese
består i å la halogenider reagere med alkoholater, f.eks. CH3Br +
NaOC4H9 = CH3OC4H9 +
NaBr. Eterne navngis ofte med navnene på begge radikalene etterfulgt av
"-eter", som i eksempelet over, men mer systematisk er det å betrakte
det minste radikalet som en sidegrein, inkludert oksygenet og bruke det vanlige
radikalnavnet på hele gruppen men med -oksy til slutt i stedet for -yl.
Dibutyleter blir da 1-butoksybutan og fenyletyleter blir etoksybenzen.
Fordelene ved denne metoden sees tydelig når forbindelsene blir mer
kompliserte, som f.eks. 2,4-dimetoksy-3-metylpentan. Ringformede etere som
etylenoksyd, C2H4O og dioksan, C4H8O2,
har litt komplisert systematisk navngiving som avhenger av hvor mange atomer det
er i ringkjeden og om det forekommer dobbeltbindinger eller andre stoffer som
nitrogen eller svovel i ringen. Etylenoksydet heter etter dette systemet
oksiran. Når det gjelder dioksan (her er det også tre varianter utfra
plasseringen av oksygenatomene i ringen, 1,2, 1,3 og 1,4 - orto, meta og para)
er dette det systematiske navnet på forbindelsen, og det kan nevnes også at
hvis fire hydrogenatomer fjernes fra den slik at det blir to dobbeltbindinger
blir navnet dioksin, en av verdens farligste miljøgifter. Navnereglene gjelder
bare enkle ringer med 3 til 10 atomer. Hvis forbindelsene er mer kompliserte
navngis de som om det var et karbon i stedet for oksygen i ringen, men med
prefikset oksa- + nummerert for å indikere posisjonen. Etylenoksydet er en viktig
forbindelse som inngår i mange synteser. Stoffer som har etylenoksydet som del
av en karbonkjede kalles epoksyforbindelser. De kan f.eks. lages ved å addere
et oksygenatom til en dobbeltbinding ved hjelp av en peroksykarboksylsyre (med
en -C(:O)-O-O-H gruppe), f.eks. blir sykloheksen til sykloheksenepoksyd med
denne fremgangsmåten. Epoksyharpikser er polymerer som er mye brukt i
industrien.
Som alkoholene er eterne
ildsfarlige stoffer, men betraktelig mer flyktige. Dimetyleter og metyletyleter
er begge gasser ved romtemperatur, mens dietyleter, den mest kjente, som også
bare kalles eter eller etyleter, har et kokepunkt på 34,51 °C, d.v.s. at den
koker på håndvarme. Løselighetsforholdene er omtrent som for alkoholene, men
mange etere har en tendens til å være ustabile og spaltes lett av lys og luft.
De har sterk lukt, (ofte ganske behagelig, eukalyptol og pinol fra eukalyptus-
og furunålsolje er f.eks. etere), og betydelig biologisk aktivitet, etyleter
har bl.a. vært brukt som bedøvelsesmiddel.
Når primære alkoholer utsettes for et kraftig
oksydasjonsmiddel, som kaliumdikromat i sur vannløsning, oksyderes de til
aldehyder:
3 CH3-CH2-CH2-CH2-CH2-OH
+ Cr2O72- + 8 H+ = 3 CH3-CH2-CH2-CH2-CH=O
+ 2 Cr3+ + 7 H2O.
CHO-gruppen er
karakteristisk for aldehydene. Den oksyderes lett videre til syregruppen COOH,
og hvis man vil ha godt utbytte av aldehyder fra ovenstående reaksjon må den
utføres over kokepunktet for aldehydet, slik at det kan destilleres av så snart
det dannes.
Aldehydene er betydelig
flyktigere enn alkoholene de oksyderes fra, så det er lett å finne en passende
temperatur. De er litt mindre flyktige enn eterne. Løselighetsforholdene er som
for alkoholene.
Fordi aldehydgruppen så
lett oksyderes virker aldehydene ofte reduserende og fungerer som et mildt
reduksjonsmiddel i mange organiske reaksjoner. Reduksjon av Ag(I) til metallisk
sølv brukes som en test på aldehyd. Aldehyder som lagres i kontakt med luft vil
snart inneholde større eller mindre mengder syre. Det har vært vanlig å kalle
dem opp etter syrene de oksyderes til, f.eks. er C4H9COOH
valeriansyre, mens ovennevnte C4H9CHO er valerianaldehyd,
men etter nye regler skal aldehydene navngis ved å bytte ut -ol i navnet på
alkoholet de oksyderes fra med -al, slik at valerianaldehyd blir pentanal. Det
enkleste aldehydet er formaldehyd, CH2O, (eller metanal, men denne
betegnelsen er lite brukt). Formaldehyd er giftig, og acetaldehyd, det neste,
er ikke så veldig sunt å ta inn, men videre minsker giftighetsgraden. De lette
aldehydene har skarp, ubehagelig lukt, men de tyngre har bedre, og de
aromatiske (merk navnet) aldehydene kan ha virkelig behagelig lukt, f.eks.
lukter benzaldehyd, C6H5CHO, mandler, kanelsyrens aldehyd
C6H5CH:CHCHO, som kan kalles kanelaldehyd eller
3-fenylpropenal, lukter som det kanskje ikke er vanskelig å gjette kanel, mens
2-pentyl-3-fenylpropenal, C6H5CH:C(C5H11)CHO,
også kalt jasminaldehyd, lukter - vel, det kan du få lov til å gjette.
Sukkerarter som ikke har lagt seg i ring og derfor inneholder en dobbeltbinding
har den ofte i enden av kjeden som en aldehydgruppe og kalles da aldoser.
Aldehyder kan i svakt
basisk miljø gjennomgå viktige kondensasjonsreaksjoner med seg selv. Med
acetaldehyd fås:
CH3CHO + CH3CHO = CH3CH(OH)CH2CHO,
en forbindelse som kalles aldol (mer systematisk 3-hydroksybutanal), og denne
typen reaksjoner kalles derfor aldolkondensasjon. Slike aldoler har lett for å
dehydrere (avspalte vann), særlig hvis pH høynes ytterligere, og resultatet
blir da umettede aldehyder. Med aldol fås CH3CH(OH)CH2CHO
- H2O = CH3CH=CHCHO eller 2-butenal, også kjent som
krotonaldehyd. Mange slike kondensasjonsreaksjoner, også med ketoner, er kjent,
og de er viktige i syntetisk organisk kjemi, spesielt fordi de er av de få
reaksjonene som gir opphav til nye karbon-karbonbindinger.
I surt miljø og vannfri
løsning med stort overskudd av alkoholer adderes alkohol til aldehyd slik at
det dannes acetaler:
C6H5CHO + 2CH3OH = C6H5CH(OCH3)2
+ H2O. Acetaler er en slags etere og vanskelige å oksydere, derfor brukes
de en del til å beskytte aldehyder mot oksydasjon. De hydrolyserer lett til
aldehyder igjen i sur vannløsning. Et viktig acetal eller hemi-(halv-)acetal er
de sykliske monosakkaridene som oppstår ved at en OH-gruppe i den ene enden av
molekylet adderes til aldehydgruppen i den andre og de to endene knyttes sammen
med en eterbinding.
Aldehyder som har
aldehydgruppen festet på et karbonatom uten hydrogener, som f.eks. i
benzaldehyd, gjennomgår en industrielt viktig selv-oksydasjons-reduksjon i
basisk miljø:
2C6H5CHO + OH- = C6H5CH2OH
+ C6H5COO-, den såkalte
cannizzario-reaksjonen.
Når sekundære alkoholer
utsettes for slike kraftige oksydasjonsmidler som dikromat i sur vannløsning,
oksyderes de til ketoner:
3 CH3-CH2-CH(OH)-CH2-CH3 +
Cr2O72- + 8 H+ = 3 CH3-CH2-CO-CH2-CH3
+ 2 Cr3+ + 7H2O.
C=O-gruppen mellom to
karboner er karakteristisk for ketonene, den oksyderes ikke videre og ketoner
fås i godt utbytte fra slike reaksjoner uten spesialbehandling. De kan også
reduseres tilbake igjen til alkoholer med egnede midler, som
litiumaluminiumhydrid, LiAlH4.
Ketoner fås også ved å
addere vann til alkyner i surt miljø, f.eks C3H7-Cº CH + H2O = C3H7COCH3.
Ketonene gis ofte navn på samme måte som eterne, slik at den øverste blir
dietylketon og den sistnevnte metylpropylketon. Noen har også egne navn, f.eks.
er dimetylketon vanlig kalt aceton, metylfenylketon er acetofenon og
difenylketon er benzofenon. Nye regler tilsier at ketonene skal navngis etter
de alkoholene de er oksydert fra, men med -on i stedet for -ol, slik at
dietylketon blir 3-pentanon og metylpropylketon 2-pentanon. Ketonene er omtrent
like flyktige som aldehydene av samme sammensetning og like brennbare. De har
gjerne behagelig lukt, f.eks. lukter acetofenon som appelsinblomster og
5-metyl-2-isopropylsykloheksanon eller menton lukter peppermynte.
3-metylsyklopentadekanon eller muskon er en ingrediens i mange parfymer.
Ketoner er svakt sure og
kan avspalte et proton fra nabokarbonet til ketogruppen. Anionet er
resonansstabilisert, med den virkelige strukturen beliggende et sted mellom -CH--C(=O)-
og -CH=C(-O-)-. Dermed kan protonene vende tilbake til molekylet
enten på det ene eller det andre av de to ladningspunktene. Et keton som aceton
foreligger derfor alltid som en blanding av to former, den såkalte ketoformen
CH3-CO-CH3 og enolformen CH2=C(OH)-CH3,
et faktum som er viktig for å forstå reaksjoner som ketonene deltar i. De to
formene keto og enol kalles tautomerer av aceton og det fenomenet at enkelte
syrer kan opptre i forskjellige former på grunn av resonansvirkninger i anionet
kalles tautomeri. Anioner som oppstår ved at hydrogen-protonet i C-H-enheter
spaltes av kalles karbanioner. De er ofte veldig sterke baser og nyttige
mellomformer i mange organiske reaksjoner.
Oksyderer vi en primær alkohol
fullt ut uten å redde unna aldehydene får vi som nevnt den organiske
syregruppen COOH, også kalt karboksylgruppen. Denne består av en C=O-gruppe som
vi kjenner fra ketonene og aldehydene + en OH-gruppe som vi kjenner fra
alkoholene.
At karboksylsyrene er
surere enn alkoholene skyldes resonansstabilisering når gruppen avgir et
proton, siden konfigurasjonene C(O-)=O og C(=O)-O- er
likeverdige, og i realiteten fordeler elektronene seg slik at begge
oksygenatomene har en "halvannen"-binding til karbonet og hver har en
halv negativ elektrisk ladning. Syrene navngis etter nyere regler som
aldehydene etter de alkoholene de er oksydert fra, men mange syrer har vært
kjent fra lenge før noen internasjonale regler var påtenkt, og har egne navn:
maursyre, HCOOH, oksalsyre, (COOH)2, eddiksyre, CH3COOH,
propionsyre, C2H5COOH, smørsyre, C3H7COOH,
valeriansyre, C4H9COOH, kapronsyre, C5H11COOH,
palmitinsyre, C15H31COOH, stearinsyre, C17H35COOH,
akrylsyre, C2H3COOH, krotonsyre, C3H5COOH,
oljesyre, C17H33COOH, benzosyre (eller benzoesyre) C6H5COOH,
ftalsyre, C6H4(COOH)2, sitronsyre, HOC(CH2COOH)2COOH,
vinsyre, (CHOHCOOH)2 og mange flere. De enverdige (altså med en
karboksylgruppe) syrene uten ringformede grupper kalles med et fellesnavn
fettsyrer, og er viktige i biokjemien. Benzosyren er årsaken til at
benzenradikalet fikk navnet fenyl og toluenradikalet benzyl, fordi den finnes i
naturen, kan utvinnes ved enkle prosesser og derfor ble oppdaget tidlig. Fordi
den består av en syregruppe på en benzenring er det rimelig å kalle den
benzosyre, faktisk er benzen oppkalt etter benzosyre, som har navnet sitt etter
benzoin, en aromatisk harpiks fra asiatiske trær, et ord av arabisk
opprinnelse. Men benzosyre kan reduseres til benzaldehyd, som reduseres videre
til en alkohol, C6H5CH2OH, også kalt
benzylalkohol. Systematikken blir altså her den samme som med de alifatiske
alkoholene, aldehydene og syrene, f.eks. skal etter de nevnte nyere reglene C9H19COOH
hete dekansyre selv om radikalet C9H19- ikke heter dekyl,
men nonyl. Et mer systematisk navn for benzylalkohol regnes idag forøvrig å
være alfa-hydroksytoluen.
Syrene er ikke særlig
flyktige, og har omtrent samme smelte- og kokepunkter som alkoholene av
tilsvarende atomvekt, noe som skyldes innvirkninger av hydrogenbindinger mellom
OH-gruppene. Særlig for de letteste syrene gjør dette seg sterkt gjeldende, og
ren eddiksyre kalles også 'iseddik' - med et smeltepunkt på 17 °C passer den
ofte slående til betegnelsen. Siden går smeltepunktet ned, og de mettede
fettsyrene er væsker ved romtemperatur t.o.m. pelargonsyre, C8H17COOH.
Fra kaprinsyre, C9H19COOH og oppover er de faste,
voksliknende stoffer, men når det introduseres dobbeltbindinger går
smeltepunktet ned igjen, et faktum som har fått overmåte stor betydning i
moderne ernæringsteori. De før nevnte palmitin- og stearinsyrene er de
vanligste mettede syrene i biologisk fett, og smelter ved h.h.v. 63 og 72 °C,
mens umettede fettsyrer som den nevnte oljesyre og den fler-umettede
linolensyre, C17H27COOH, har smeltepunkt på h.h.v. 16,3
og -11,3 °C. De aromatiske syrene har forholdsvis høye smeltepunkter, benzosyre
smelter ved 122 °C og ftalsyre ved 215.
Syrene har omtrent samme
løselighetsforhold som alkoholene, bare de letteste fettsyrene er vannløselige,
men flerverdige syrer løses lettere i vann, mens de derimot har en tendens til
å være lite løselige eller uløselige i de mest upolare organiske
løsningsmidlene som benzen. F.eks. er sitronsyre og vinsyre lett løselig i
vann. De letteste fettsyrene har skarp, stikkende lukt, og de som ligger litt
over dem har ofte en særdeles ubehagelig lukt. Tre av dem, kapronsyre og
kaprinsyre som er nevnt før, samt kaprylsyre, C7H15COOH,
forekommer i visse kjertler hos geiter, og da kan du bare tenke deg...
Tydeligvis har naturen funnet grunn til å advare oss mot disse syrene, men
advarselen gjelder altså ikke geiter. Også mange av de andre syrene forekommer
hyppig i naturen, maursyre brukes som angreps- og forsvarsvåpen av mange
maurarter, oksalsyre fins i gaukesyre og rabarbra, smørsyre fins i svette,
ekskrementer og harskt smør, samt i Pilestredet i Oslo, valeriansyre fins i
vendelrot, salicylsyre, C6H4(OH)COOH, i mjødurt, vinsyre
i vindruer (ikke i vin), sitronsyre i sitroner, eplesyre, HOOCCH(OH)CH2COOH,
i epler, stikkelsbær, rognebær m.m., melkesyre, CH3CH(OH)COOH, i
vin, agurker, ost, surkål, sur melk og sure lår, benzosyre i tyttebær og visse
balsam- og harpiksarter, og listen kunne gjøres mye lengre.
De organiske
karboksylsyrene er ikke sterke, syrekonstanten ligger for det meste under
0,00002. Bare med mange sterkt elektronegative atomer i molekylet oppnås en
tilnærmet fullstendig dissosiering, og trikloreddiksyre, CCl3COOH,
har en syrekonstant på 0,3. Karboksylsyrer danner salter med de fleste
metaller. Navnene på saltene er som på andre salter, med metallnavnet først og
deretter et ionenavn som er syrenavnet modifisert med endelsen -at: benzosyre -
benzoat, oksalsyre - oksalat. Det er noen avvik som har sammenheng med at det
alltid skal bruke latinbaserte navn på ionenavnet, mens noen av syrene har
nasjonale eller andre tradisjonelle, usystematiske navn som gjerne foretrekkes,
eksempelvis maursyre - formiat, eddiksyre - acetat, smørsyre - butyrat, vinsyre
- tartrat, ravsyre - succinat, oljesyre - oleat, eplesyre - malat og sitronsyre
- citrat (sitrat brukes også). Mange syrer har navn som slutter på -insyre, og
her sløyfes -in- i ionenavnet på norsk, f.eks. stearinsyre - stearat,
glutaminsyre - glutamat. Hydrokarbonene propan og butan er oppkalt etter syrene
propionsyre og smørsyre (som danner butyrater og heter butyric acid på engelsk).
Som oftest er syrene for
svake til at det kan lages salter ved å la syrene virke på metallet, men de
saltene som er løselige i vann kan lages ved å koke syrene med hydroksyder
eller oksyder av metallene, og de uløselige kan fås ved utfelling når man
tilsetter syrene eller vannløselige salter av syrene til vann som inneholder
løste ioner av metallene. Alkalisaltene kan fås ved å koke estere, d.v.s.
syreforbindelser med organiske stoffer, med alkalihydroksyder, en prosess som
ikke sjelden kalles å saponisere. Spesielt kan salter av fettsyrene fås ved å
lutkoke en spesiell type estere som kalles fett, og det interessante ved dem er
at anionene av de langkjedede fettsyrene i vann danner såkalte miceller,
sammenslutninger hvor de ioniske COO-gruppene som vannet liker vender ut mot
vannet mens de upolare C-H-kjedene som er upopulære blant vannmolekylene
trekker sammen i det indre. Miljøet inne i disse micellene virker ganske godt
oppløsende på upolare partikler av forskjellige slag som f.eks. fett og olje
som ikke løses i vann, og det er hovedårsaken til at salter av fettsyrer kalles
såper.
Alle fettsyresalter
kalles såper, også de uten alkali og uten vaskeevne. De forskjellige såpenes
egenskaper er avhengig av hvilket metall og hvilken fettsyre de består av. De
kortkjedete såpene er som regel krystallinske stoffer med moderat hardhet, mens
de langkjedete er myke, fettete, voksaktige. Smeltepunktene ligger betydelig
over de til syrene, f.eks. smelter natriumacetat ved 324 °C, 307 grader mer enn
eddiksyre, mens natriumpalmitat smelter ved 270 °C, 207 mer enn palmitinsyre.
Alle alkalisåpene er løselige i vann, men ellers har kortkjedede såper en
tendens til å være betydelig mer vannløselige enn de langkjedede. Alle
acetater, deriblant sølv- og blyacetat, er vannløselige, men de langkjedede
såpene er med unntak for alkalisåpene tungt løselige eller uløselige i vann.
Dette fører til problemer for bruk av såpe i vask hvis vannet inneholder
metallioner som kalsium eller jern, noe det ofte gjør f.eks. i strøk med
kalkrik berggrunn. Tungt løselige kalsiumsåper felles ut, såpevannet skummer
dårlig og har liten vaskeevne.
Saltene av de andre
karboksylsyrene skiller seg ikke så mye ut fra såpene. Generelt har de høyere
smeltepunkter enn syrene, alkalisaltene er som regel vannløselige og de andre
er ofte vannløselige hvis syrene er det. De uløselige saltene er ofte løselige
i organiske løsningsmidler, ikke sjelden bedre enn de vannløselige. Oksalatene
skiller seg noe ut og oppfører seg kjemisk påfallende likt karbonatene.
Oksalatene er også gode kompleksdannere, bedre enn karbonatene, og uløselige
oksalater går ofte i løsning igjen med overskudd av alkalioksalat. Epler
inneholder syrer som eplesyre, garvesyrer og vinsyre som er sterke nok til å
danne salter med jern, og hvis man skjærer i epler med stålkniver som ikke er
rustfrie blir eplene derfor mørke i overflaten. Sølvskjeer inneholder som regel
kobber og må ikke bli liggende i sure matvarer fordi det dannes giftige kobbersalter
av de organiske syrene.
Blander man et
syreklorid, f.eks. acetylklorid med en alkohol som butanol, i vannfritt miljø,
f.eks. i eterløsning, fås en ester, i dette tilfellet butylacetat: CH3COCl
+ C4H9OH = CH3COOC4H9 +
HCl. Dette er den mest effektive måten å lage estere på. Ellers kan de lages av
en blanding av organisk syre og alkohol. Hvis blandingen gjøres sterkt sur
oppstår en likevekt: A-COOH + HO-B <> A-COO-B + H2O.
Likevekten kan forskyves over til produktsiden med overskudd av alkohol eller
ved å fjerne vannet som dannes, enten ved destillasjon eller ved å bruke
svovelsyre til surgjøring. Syrekatalysert esterifisering fungerer ikke med
fenoler og går sakte med tertiære alkoholer og med store, forgrenede
syremolekyler. Her går det bedre med syreklorider, men siden saltsyre reagerer
med tertiære alkoholer må den fjernes, f.eks. ved reaksjon med pyridin. I
naturen lages estere av alkoholer og "aktiviserte" syrer som er
tilført en fosfatgruppe fra ATP.
Estere navngis med
syrenavnet sist i ordet, brukt på samme måte som i saltene, og først i ordet
settes alkoholradikalnavnet. Tidligere ble de navngitt med det uendrede
syrenavnet først og alkoholradikalet + 'ester' sist, slik at butylacetat blir
eddiksyrebutylester. Estere likner etere en del i egenskapene, og inntil dette
århundret gikk begge ofte under betegnelsen etere. (Men betegnelsen med
innskutt s ble foreslått allerede på midten av 1800-tallet av Leopold Gmelin,
siden de i motsetning til eterne var avledet av Syrer). På samme måte som ketoner
er isomerer av aldehyder og etere er isomerer av alkoholer med de funksjonelle
gruppene flyttet innover i molekylet, er estere isomerer av syrer. De er
betraktelig flyktigere enn de tilsvarende syrene, f.eks. har butylacetat
smeltepunkt -77,9 °C og kokepunkt 126,5 °C, mens den isomere kapronsyre smelter
ved -2 °C og koker ved 205 °C. De har også atskillig dårligere løselighet i
vann, mange løses ikke overhodet, men de løses godt i upolare organiske
løsningsmidler. I motsetning til syrene har de nesten alle sammen ytterst
behagelig lukt, og en mengde forskjellige estere fungerer i planteriket som
aromastoffer i blomster og frukter. F.eks. gir det nevnte butylacetatet
bananene sin karakteristiske lukt eller aroma. Metylbutyrat, C3H7COOCH3,
lukter ananas, pentylbutyrat, C3H7COOC5H11,
gir aprikoslukt, benzylacetat, CH3COOCH2C6H5,
lukter fersken og etyl-3-oksobutyrat (også kalt aceteddiksyreetylester eller
bare aceteddikester), CH3COCH2COOC2H5,
lukter blåbær. Mange naturlige estere er kompliserte i strukturen, f.eks.
sedertreolje, C17H24O5, som jeg ikke skal
prøve å gjengi strukturen på her. Estere kan også lages med flerverdige
alkoholer og syrer, og en spesielt interessant type ester er med glyserol og
fettsyrer, slike estere kalles også fett, f.eks. er stearin glyseryltristearat,
C17H35COOCH(CH2OOCC17H35)2.
(Men stearinlys er pr. idag oftest laget av rene fettsyrer, f.eks. stearinsyre
eller en blanding.) Glyserider er også en betegnelse som er brukt om disse
forbindelsene, i dette tilfellet stearinsyreglyserid. Men mer om dette siden.
Estere kan også dannes
med alkoholer og uorganiske syrer og på samme grunnleggende måte som med de
organiske, ved vannuttrekking med konsentrert svovelsyre. De navngis også
tilsvarende, f.eks. er glyseroltrinitrat O3NCH(CH2NO3)2
og ikke en nitroforbindelse som de mer alminnelig brukte navnene nitroglyserol
og nitroglyserin antyder. To- eller flerverdige syrer kan danne to eller flere
esterbindinger, gjerne med forskjellige alkoholer. Karbonsyren (kullsyren) har
interessante estere, f.eks. dietylkarbonat (C2H5)2CO3
eller (C2H5O)2CO, en væske som brukes en del
som løsningsmiddel. Trimetylfosfatet (CH3)3PO4
eller (CH3O)3PO har liknende egenskaper og bruk. Men
flerverdige syrer kan også danne estere med bare en eller noen få av de
protondonerende gruppene sine og dermed helt eller delvis beholde sin
syrestyrke. Fosforsyrens estere med sukkermolekylet ribose er et eksempel som
er meget viktig i biokjemien.
Hvis et syreklorid
tilsettes den tilsvarende syren dannes et syreanhydrid: CH3COCl + CH3COOH
= CH3CO-O-COCH3 + HCl. Anhydrider reagerer nokså likt med
syreklorider og hvis ikke anhydridsyntese er målet i seg selv bruker man heller
syrekloridet og unngår den ovennevnte reaksjonen. Men noen toverdige syrer
danner lett nyttige ringformede anhydrider ved enkel oppvarming, f.eks.
ftalsyre, C6H4(COOH)2, maleinsyre,
HOOCCH=CHCOOH og ravsyre, HOOCCH2CH2COOH.
Eddiksyreanhydrid kan lages ved å oppvarme aceton til 750 °C slik at den
spaltes til metan og "keten": (CH3)2CO -> CH2=C=O
+ CH4. Ketenet adderer så eddiksyre til eddiksyreanhydrid. Blandede
anhydrider reagerer også på samme måte som de enkle. I levende organismer hvor
kjemien foregår i et pH-nøytralt miljø kan ikke de drastiske virkemidlene fra
laboratoriesyntesene brukes, som syrekatalyse, hydridreduksjon, synteser med
syreklorider o.l. I biologiske systemer blir derfor organiske syrer
"aktivisert" ved at det dannes et blandet anhydrid med
adenosintrifosfat:
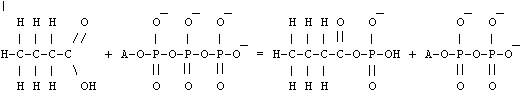 Estere, amider e.l. dannes lett
ved at fosforsyren avspaltes når det blandede anhydridet kommer nær en alkohol,
et amin e.l.
Estere, amider e.l. dannes lett
ved at fosforsyren avspaltes når det blandede anhydridet kommer nær en alkohol,
et amin e.l.
Hvis du tilsetter
ammoniumhydrogensulfid til en alkohol- eller eterløsning av kloridet av et
hydrokarbon får du et merkaptan eller en tiol, f.eks.: C4H9Cl
+ NH4SH = C4H9SH + NH4Cl.
Merkaptaner er svovel-ekvivalenten av alkoholene og navngis etter nyere regler
som dem, men med -tiol som endelse istedetfor -ol. Det er heller ikke uvanlig å
kalle dem merkaptan med hydrokarbonradikalet som prefiks, slik at navnet på den
eksemplifiserte forbindelsen blir butylmerkaptan eller butantiol. Merkaptaner
er klart flyktigere enn de tilsvarende alkoholene, tross at molekylvekten er
høyere, f.eks. smelter butantiol ved -115,67 °C og koker ved 98,46 °C, mens
butanol smelter ved -89,53 °C og koker ved 117,25 °C, faktisk er de også
flyktigere enn hydrokarboner av samme molekylvekt. De løses i mange organiske
løsningsmidler, men nesten ikke i vann, selv de letteste, metantiol og etantiol
er nokså tungt løselige. Merkaptanene er fargeløse væsker eller hvite
krystallinske stoffer og kjennetegnes ved en usedvanlig frastøtende lukt.
Ekskrementer og råtnende dyre- og plantedeler inneholder merkaptaner, og det er
åpenbart naturens mening å advare oss mot slike ting. Men naturen har alltid et
lune på lager, og trår du et lite svart-hvitt nordamerikansk dyr for nære kan
du få dressen, håret og generelt de neste 5-10 dagene fulle av butylmerkaptan,
som stinkdyret bruker til å redde livet med.
Merkaptanene er
atskillig surere enn alkoholene, f.eks. har etantiol en syrekonstant på 2,5x10-11
mot etanolens 1x10-16. Saltene de danner med metaller kalles
tiolater og har egenskaper som avviker en del fra alkoholatene, bl.a. er
tiolatene av mange tungmetaller uløselige i vann. Cystein, NH2CH(COOH)CH2SH,
er en viktig aminosyre som finnes i nesten alle proteiner og er hovedårsaken
til at forråtningsprosesser avgir merkaptaner. SH'ene er aktive grupper i mange
av de proteinene som fungerer som enzymer, og de uløselige tiolatene som dannes
med tungmetaller gjør derfor disse enzymene virkningsløse og er en hovedårsak
til at tungmetallene er så giftige.
I motsetning til
alkoholene kan merkaptanene lett oksyderes til disulfider, f.eks. med jod: 2C4H9SH
+ I2 = C4H9SSC4H9 + 2HI.
Denne reaksjonen utnyttes av cysteinholdige proteiner til å danne disulfidbroer
mellom aminosyrekjedene som gir god hjelp til strukturoppbygningen av
proteinene. Den dobbelt-aminosyren som er resultatet av sammenbindingen heter
cystin: NH2CH(COOH)CH2SSCH2CH(NH2)COOH.
Hår består av proteiner og de enkelte hårstråene henger delvis sammen p.g.a. en
svak luftoksydasjon av cysteinene. Dette har blitt utnyttet i
permanentbehandling hvor alle disulfidbindingene først brytes med en luktfri
merkaptanforbindelse som ammoniumtioglykolat, HSCH2COONH4,
hvorpå håret omarrangeres i ønsket fasong og deretter oksyderes med f.eks. en
hydrogenperoksydløsning for å låses i den fasongen.
Tiolationet er en
reaktiv enhet som reagerer raskt med organiske halogenider til sulfider,
eksempelvis mellom benzentiol og etylbromid: C6H5S-
+ C2H5Br = C6H5SC2H5
+ Br-. Slike sulfider er svovelekvivalenten av etere og benevnes på
liknende måte, i dette tilfellet fenyletylsulfid. De nevnte disulfidene navngis
forøvrig på samme måte. Sulfidene har egenskaper som likner eterne og lukter
ikke så vondt som merkaptanene og disulfidene. En viktig egenskap de har er at
de reagerer med halogenider til såkalte sulfoniumsalter, med dimetylsulfid og
metylbromid fås f.eks. trimetylsulfoniumbromid: (CH3)2S +
CH3Br = (CH3)3SBr. Fra sulfoniumionet kan så
lett en av metylgruppene avgis igjen, en reaksjon som utnyttes i organismene
ved hjelp av den viktige aminosyren metionin, NH2CH(COOH)CH2CH2SCH3.
Metionin danner et sulfoniumion med adenosin og kan dermed avgi en metylgruppe
i forskjellige syntesereaksjoner som foregår i naturen.
Sulfider kan oksyderes
av slike moderate oksydasjonsmidler som hydrogenperoksyd, og danner da
sulfoksyder, f.eks. dannes dimetylsulfoksyd, (CH3)2SO, av
dimetylsulfid, og ved videre oksydasjon, f.eks. med overskudd av peroksyd,
dannes sulfoner, i dette tilfellet dimetylsulfon, (CH3)2SO2.
Hvis man tenker seg at sulfoner hydrolyseres slik at de avspalter et
hydrokarbon og får en OH-gruppe bundet til svovelatomet fås en sulfonsyre.
Dimetylsulfon ville i tilfelle gitt metan og metylsulfonsyre, CH3SO3H
(reaksjonen skjer ikke i virkeligheten). Sulfonsyrer er sterke syrer, på linje
med de vanlige mineralsyrene. De består også teknisk sett av et molekyl
svovelsyre hvor en av OH-gruppene er forestret med en alkohol (samme forholdet
som mellom karbonsyre og karboksylsyrene), og dannes også helst ved å behandle
organiske stoffer (fortrinnsvis ikke oksygenholdige) med svovelsyre. I
egenskaper likner de karboksylsyrene bortsett fra at de er sterke, og saltene
likner også, men har bedre løselighet i vann.
Hvis en eterløsning av
et organisk halogenid behandles med et stort overskudd av ammoniakk får man
aminer, f.eks. C5H11Cl + 2NH3 = C5H11NH2
+ NH4Cl. Aminnavnene består av det organiske radikalnavnet + 'amin',
slik at det ovenstående blir pentylamin.
Aminer er ikke så
flyktige som hydrokarboner, men atskillig flyktigere enn alkoholer, og både
metylamin og etylamin er gasser ved romtemperatur, selv om kokepunktet for
sistnevnte er oppe på 16,6 °C. Løselighetsforholdene er omtrent de samme som
for alkoholene. I motsetning til de oftest fargeløse eller hvite organiske
oksygen- og svovelforbindelsene har aminene en tendens til å være farget,
særlig de aromatiske. Fargen er vanligvis gul, gjerne ganske blek, men kan
forsterkes av andre aktive grupper i molekylet. Fenylamin, C6H5NH2,
er en viktig forbindelse som er bedre kjent som anilin. Aminer har en
karakteristisk fiskelukt, det avgis også store mengder aminer når fisk råtner.
Hvis ikke fremstillingen av aminer fra klorider
gjøres med stort overskudd av ammoniakk, vil kloridene ofte reagere med de
nydannede aminene i stedet for ammoniakken. Det man får da er sekundære og
tertiære aminer, aminer hvor det ene eller begge hydrogenene på nitrogenet er
substituert. I ovennevnte eksempel er resultatene dipentylamin og
tripentylamin. De sekundære og tertiære aminene skiller seg lite ut i
egenskaper fra de primære. Sekundære aminer kalles ofte iminer. Navngivingen er
ellers enkel, f.eks. er (CH3)2NH dimetylamin og (CH3)3N
trimetylamin. Litt mer komplisert blir det hvis gruppene ikke er like. Da
betraktes forbindelsen som avledet av det primære aminet til den største
gruppen og de andre gruppene kalles med sine radikalnavn med N- foran, f.eks.
får CH3-CH=CH-CH2-N(CH3)-C2H5
navnet N,N-metyletyl-2-butenylamin.
Aminer reagerer i likhet
med ammoniakken klart basisk, og det er aminene som er den organiske kjemiens
viktigste baser. Både de primære, sekundære og tærtiære aminene reagerer basisk
og alle gjør det på samme måte som ammoniakk, ved å ta opp protoner på den
ledige sp3-orbitalen på nitrogenet. De saltene som dannes kalles i
likhet med ammoniakksaltene ammoniumsalter, men de organiske molekyldelene må
spesifiseres. Men tripentylamin og saltsyre blir det f.eks.
tripentylammoniumklorid, (C5H11)3NHCl. Det
finnes en mengde slike substituerte ammoniumsalter, med interessante
egenskaper.
Aminer spiller en stor
rolle i biologien, og en interessant type aminer er alkaloidene, som har fått
denne betegnelsen (av alkali) fordi de er basiske. De finnes i planter, og
mange av dem har medisinsk betydning på grunn av sin virkning på
sentralnervesystemet. Mange brukes som legemidler, andre hører til de sterkeste
gifter man kjenner. Valmue-, jordrøyk-, søtvier-, soleie-, rose- og
erteblomstfamiliene er særlig rike på alkaloider. Som regel er de uløselige
eller tungt løselige i vann, men løselige i alkohol og andre organiske
løsningsmidler. Som oftest har de ikke lukt, men en bitter smak. Eksempler er
de narkotiske stoffene morfin og kokain, det febernedsettende midlet kinin, de
dødelige giftstoffene stryknin og atropin, som også har viktig medisinsk
betydning i mindre doser, sinapin som finnes i sennep og piperin som finnes i
pepper og faktisk er en isomer av morfin, men med svært så forskjellig
sammensetning. Molekylene er vanligvis kompliserte, men mange kan likevel
lønnsomt syntetiseres og de aktive gruppene kan som regel identifiseres slik at
det går an å rendyrke de virkningene man er ute etter og fjerne bivirkningene
til naturstoffene. F.eks. er novokain eller
4-amino-benzosyre-2-dietylaminoetylester et bedøvelsesmiddel av samme
konstruksjon som kokain, men uten de narkotiske virkningene.
Aldehyder kan reagere
med aminer til iminer: -CH=O + H2N-CH< = -CH=N-CH< + H2O.
Ved hydrolyse bytter aminogruppen plass: -CH=N-CH< + H2O = -CH2NH2
+ O=C<. Dette kalles transaminering, og utnyttes i de levende organismene
til diverse formål, f.eks. aminosyresyntese, omdanning av aminosyre til aminer
(dekarboksylering) og under fordøyelsen for å trekke energi ut av aminosyrer
hvis det er noen til overs etter proteinbyggingen.
Sekundære eller tertiære
aminer kan gjerne opptre også i ringstrukturer, hvor nitrogenatomet inngår i
ringen i stedet for karbon, og siden nitrogenet er treverdig har det tilknyttet
ett hydrogenatom mindre enn det karbonatomet som det inngår i stedet for. Slike
ringformede forbindelser hvor andre atomer enn karbon går inn i ringen kalles
heterosykliske. Foruten nitrogen kan også oksygen og svovel gå inn i ringene,
men selvsagt bare med enkeltbindinger på hver side av seg, mens nitrogen også
kan opptre i ringer hvor det forekommer dobbeltbindinger, som i benzenringene.
Det har også vært fremstilt syntetiske ringforbindelser med fosfor, arsen,
selen, tellur, bor og andre mer selsomme ringmedlemmer. Typisk for alle de
heterosykliske nitrogenforbindelsene er en klar basekarakter. Noen viktige
heterosykliske forbindelser:

Mange av disse
heterosykliske forbindelsene er væsker, et par er faste stoffer ved
romtemperatur. De er fargeløse eller svakt gullige. Alle unntatt det
nitrogenfrie furanet er løselige i vann. Alle disse ringstrukturene danner
basis for en mengde forskjellige stoffer med forskjellige grupper påsatt et
eller flere steder. Særlig viktige er purinderivatene adenin og guanin og
pyrimidinderivatene cytosin, thymin og uracil som utgjør den genetiske koden i
nukleinsyrene, byggebeskrivelsene for alt liv. Spesielt interessant er
syre/baseegenskapene til de heterocykliske forbindelsene. Nitrogenholdige
forbindelser er som regel gode baser, og de oksygenholdige mindre gode. Dette
stemmer også for pyridin og pyrimidin, hvor nitrogenet er del av benzenliknende
ringer, men i pyrrol hvor det går inn i stedet for det ene sp3-karbonet
i syklopentadien og har et hydrogenatom bundet til seg, er det mer surt enn
basisk. Det protolyserer ikke basisk i vann slik som de primære aminene. Det
opptar protoner fra sterke syrer, men det er heller nabokarbonene enn
nitrogenet som tar opp protonene, og det danner salter med sterke baser, som
f.eks. kaliumpyrrolat C4H4NH + KOH = C4H4NK
+ H2O. Årsaken til alt dette er at et pyrroloniumion med et ekstra
proton på nitrogenet ikke har resonansstabilisering. Hvis protonet tas opp på
karbonatomet eksisterer det tre omtrent likeverdige resonansformer, mens det
negativt ladde pyrrolationet har hele fem likeverdige resonansformer.
En annen interessant
forbindelse er pyran, C5H6O. Dette er en nokså sterk
base, ettersom den danner en benzenlik elektronstruktur ved opptak av et
proton, men ikke har resonansstabilisering i grunnformen.
Heterosykliske
forbindelser er vanlige i naturen, og utgjør mange biokjemisk viktige
substanser som de nevnte purin- og pyrimidinderivatene i arvestoffet, men også
porfyrin, C20H14N4, et metallbindende derivat
av pyrrol som inngår bl.a. i hem, den virksomme bestanddelen av hemoglobin, og
i klorofyll. Mange hormoner som serotonin og andre viktige virksomme stoffer er
heterosykliske, liksom svært mange alkaloider, viktige virksomme stoffer som
kan utvinnes av planter og omfatter farlige gifter som stryknin, narkotika som
morfin og nikotin og medisiner som penicillin, atropin, reserpin og kinin.
Oksygenholdige heterosykliske forbindelser som cyanidin og quercitin gir farge
til mange naturprodukter. Førstnevnte finnes f.eks. i mørke kirsebær. Slike
fargestoffer er ofte gode syre-baseindikatorer. Kirsebær er som oftest sure,
men prøv å legge et i lut eller en natronløsning og se hva som skjer.
Hvis et molekyl
inneholder både aminogruppe og syregruppe kaller vi dem aminosyrer, en uhyre
viktig klasse forbindelser, biologisk sett. En aminosyre er kjemisk sett en
forbindelse som både er en syre og et amin, uansett hvor på molekylet de aktive
gruppene befinner seg, men de som er til livs bruk har alltid aminogruppen på
det andre karbonet i kjeden regnet fra (og med) syregruppen. Dette andre karbonet
er som regel et såkalt asymmetrisk karbon, det vil i praksis si at ingen av
gruppene som er knyttet til det er like: en aminogruppe, en karboksylgruppe, et
hydrogen og en funksjonell gruppe som er forskjellig for hver aminosyre.
Molekyler med slike asymmetriske karboner er som regel optisk aktive, d.v.s. at
hvis man lyser gjennom dem med polarisert lys, dreier de polarisasjonsretningen
til lyset. Molekylene kan arrangeres på to forskjellige måter om slike
asymmetriske karboner. Hvis vi legger et loddrett plan fra syregruppen gjennom
det asymmetriske karbonet og aminogruppen i aminosyrene, kan enten hydrogenet
ligge til venstre for planet og den funksjonelle gruppen til høyre eller
omvendt. Dette er stereoisomeri. Bindingene og gruppene er de samme og dermed
er også de kjemiske og fysiske egenskapene nokså like, de vesentlige
forskjellene er det geometriske arrangementet og den optiske aktiviteten. Det
er det andre særtrekket ved livets aminosyrer at de alle har den funksjonelle
gruppen til venstre for det nylig definerte planet. Og de dreier det
polariserte lyset til høyre, d.v.s. med klokkeretningen. Generelt har alle
molekyler med asymmetriske karboner stereoisomeri og optisk aktivitet, men det
finnes noen som ikke har det og noen optisk aktive molekyler mangler også
asymmetriske karboner.
Organiske syrer er altså
sure og aminer basiske, men aminosyrer er amfotere. For å ta det enkleste
eksempelet, glycin, også kalt glykokoll eller aminoeddiksyre, NH2CH2COOH,
foreligger den i sur løsning som NH3+CH2COOH
og i basisk som NH2CH2COO-. Den danner salter
med uorganiske baser såvel som med syrer, f.eks. NH3ClCH2COOH
og NH2CH2COONa. Alle aminosyrer er faste, krystallinske
stoffer med noen uvanlig egenskaper til organiske stoffer å være: høyt
smeltepunkt (262 °C for glycin - til sammenlikning 17 °C for eddiksyre) og for
det meste god vannløselighet, men meget dårlig løselighet i organiske
løsningsmidler. Forklaringen er at syreprotonet har en sterk tendens til å bli
overført til aminogruppen slik at aminosyrene vanligvis egentlig foreligger som
salter av seg selv: NH3+CH2COO-, et
selv-ionisert molekyl, også kalt zwitterion. Denne formen, som dominerer i
vannløsning mellom pH 4,8 og 6,3, er godt vannløselig, men faktisk ikke like
løselig som de to andre formene som opptrer i sur og basisk løsning.
Som kjent kan
aminosyrene kobles sammen til noe som vi kaller proteiner, dette skjer ved
hjelp av peptidbindinger, bindinger mellom syredelen av den ene aminosyren og
basedelen av den neste ved at en COOH avgir OH og en NH2-enhet en H
til et molekyl vann og danner peptidbindingen -CONH-. En kjede av slike
sammenbundne NHCHCO-enheter inkludert sidegrenen på CH'et kalles en peptidkjede
eller et peptid og kan f.eks. utgjøre et protein, eller en del av et, eller en
rest av et. Sidegrenene i kjeden er de kjemisk aktive eller strukturbyggende
elementene av aminosyrene. Proteinmolekylene kan bli ganske store og kan godt
komme opp i en molekylvekt på flere hundre tusen. Derfor oppgis molekylvekten
gjerne med enheten dalton, forkortelse D, identisk med atomvekt-enheten. Et
proteinmolekyl sies da å være på 26 kD (kilo-dalton), et annet på 122 kD, et
tredje på 408 kD o.s.v. Et viktig element i oppbygningen av proteinene er at
det kan dannes hydrogenbindinger mellom NH-gruppene og CO-gruppene i en annen
del av kjeden. Dette kan gi opphav til forskjellige typer delstrukturer i
proteinene hvorav en av de viktigste og vanligste er dobbeltspiralen, som
minner om dobbeltspiralstrukturen i DNA. Når proteinene oppvarmes brytes noen
av disse hydrogenbindingene, som ikke er så sterke som de kovalente, og ved
avkjøling faller proteinet tilbake til en mer tilfeldig struktur med nye
hydrogenbindinger, som kan få radikalt endrede egenskaper og vanligvis ikke er
brukelig for livsprosessene. Dette kalles koagulering eller denaturering, og er
velkjent bl.a. fra koking av eggehvite. Koker du suppe på kjøtt skal du ikke
legge kjøttet i før vannet er i kok, ellers går mye protein ut i vannet før det
koker, koagulerer der og må skummes av underveis. Legger du kjøttet i kokende
vann koagulerer proteinene i overflaten og slipper ikke ut i vannet.
Peptidbindingene brytes og proteinet nedbrytes i sine enkelte aminosyrer ved å
kokes ved 110 °C i konsentrert saltsyre i 24 timer. Har man de rette enzymene
til stede trengs mindre varme og svakere syre, faktisk kan enhver av oss utføre
denne hydrolysen i vår innvendige kjemiske fabrikk. Men mer om dette også
senere.
Estere spaltes av
ammoniakk til alkoholer og amider, f.eks. med metylbutyrat: C3H7COOCH3
+ NH3 = CH3OH + C3H7CONH2.
Denne reaksjonen er reversibel, og for å gi godt utbytte av amid må den gjøres
med et stort overskudd av ammoniakk eller ved å separere amidet fra alkoholet
under prosessen. Mer effektivt er det å tilføre ammoniakk til en eterløsning av
et syreklorid, som acetylklorid: CH3COCl + NH3 = CH3CONH2
+ HCl. Amidene kalles opp etter syrene de er avledet av, slik at propionsyrens
amid f.eks. heter propionamid. I de tilfellene, som f.eks. begge de ovennevnte,
hvor syrene har et annet navn som salt eller ester enn som syre, brukes helst
det førstnevnte navnet, slik at de to amidene over heter butyramid og acetamid.
Men det har også vært vanlig å bruke hele syrenavnet + -amid, som f.eks.
smørsyreamid og eddiksyreamid. Alle amidene med unntak for maursyreamidet (formamid),
HCONH2, er faste stoffer ved romtemperatur. De har som regel bedre
løselighet i vann enn syrene, men ofte dårligere i de mest upolare organiske
løsningsmidlene. De letteste har særlig dårlig løselighet i en del organiske
løsningsmidler. Amidene er hverken sure som syrene, basiske som aminene eller
amfotere som aminosyrene, men helt nøytrale. Urinstoff eller urea, (NH2)2CO,
er karbonsyrens (kullsyrens) diamid, også kalt karbamid. Monoamidet av
karbonsyre, NH2COOH, kalles karbamidsyre. Den eksisterer ikke i fri
tilstand, bare som salter og estere. Saltene kalles karbamater, men esterne
kalles gjerne uretaner, og danner utgangspunkt for flere viktige polymerer.
Hvis syrekloridene ikke
tilsettes ammoniakk, men primære eller sekundære aminer, fås substituerte
amider, f.eks. CH3COCl + C4H9NH = CH3CONHC4H9
+ HCl eller C6H5COCl + (C2H5)2NH
= C6H5CON(C2H5)2. Disse
amidene navngis ved å bruke syrenavnene og navnene på gruppene som sitter på
nitrogenet og angi at det er disse det dreier seg om med en N. Den førstnevnte
forbindelsen heter dermed N-butylacetamid og den andre N,N-dietylbenzoamid. Det
sees jo lett at -CONH-gruppene i de enkeltsubstituerte amidene er de samme som
i peptidbindingene mellom aminosyrene i peptider, slik at peptider og proteiner
gjerne kan sies å være en slags amider i kjede, og de er også langt mer
nøytrale i syre-basesammenheng enn de frie aminosyrene, dersom de ikke
inneholder mange aktive sure eller basiske grupper.
En tredje måte å
fremstille amider på er ved å utsette ammoniumsalter av organiske syrer for
sterkt vanntiltrekkende midler, f.eks. konsentrert svovelsyre. F.eks.
gir CH3COONH4 - H2O acetamid, CH3CONH2.Men som man ser er det rom for å
føre denne metoden et skritt videre, og hvis vi fjerner et H2O til
fra acetamidet får vi CH3CN, eller acetonitril. Her er gruppen til
venstre en cyanogruppe, med trippelbinding mellom karbonet og nitrogenet.
Nitrilene kalles også opp etter syrene, f.eks. er C11H23CN
dodekannitril (eller laurinsyrenitril). En eldre og litt misvisende navngiving
er med radikalnavnet og cyanid, slik at acetonitril (også kalt etannitril eller
eddiksyrenitril) blir metylcyanid og laurinsyrenitril blir ikke dodekyl, men
hendekylcyanid. Nitrilene er nesten like flyktige som hydrokarbonene, vi må
helt opp til tetradekannitril for å finne et som er noenlunde fast ved
romtemperatur (sm.p. 19,25 °C), og acetonitril har kokepunkt 81,6 °C.
Benzonitril, C6H5CN, smelter derimot ved -13 °C, hele 82
grader over smeltepunktet til det tilsvarende hydrokarbonet, toluen eller
metylbenzen. Løselighetsforholdene er omtrent som for hydrokarbonene og syrene,
alle er løselige i organiske løsningsmidler og de letteste er lett løselig i
vann, mens smørsyrenitril og valeriansyrenitril er tungt løselige, i likhet med
benzonitril, og de fleste andre er uløselige. De fleste nitrilene er fargeløse
væsker, de er ikke giftige og brukes en del som løsningsmidler i organisk og
uorganisk kjemi. Med svak syre eller base i vannløsning tar de opp
vannmolekyler igjen og blir til amider eller ammoniumsalter av syrer. Med
passende reduksjonsmidler som litiumaluminiumhydrid tar de opp hydrogen og blir
til aminer, f.eks. blir acetonitril til etylamin.
Aldehyder og ketoner
reagerer i svakt basisk miljø med blåsyre til cyanhydriner, f.eks. CH3CHO
+ HCN = CH3-CH(OH)-CN. Cyanhydrinene er nyttige i syntesen fordi de
lett lar seg omdanne til syrer eller estere med vann eller en alkohol i surt
miljø. F.eks. gir benzaldehyd et cyanhydrin som med vann og saltsyre gir
mandelsyre, C6H5CH(OH)COOH, og acetoncyanhydrin gir med
metanol og svovelsyre et metyl-2-hydroksy-2-metylpropionat, CH3C(OH)(CH3)COOCH3,
som svovelsyren trekker et vannmolekyl ut av og omdanner til metylmetakrylat,
CH2=C(CH3)COOCH3, som kan polymeriseres til
pleksiglass.
Hvis et primært
aromatisk amin som f.eks. anilin tilsettes natriumnitritt i kald, sur løsning,
frigjøres salpetersyrling som reagerer med anilinet: C6H5NH
+ HNO2 + H+ = C6H5N=N+ +
2 H2O. Resultatet kalles et diazoniumion. Det danner salter med
mange anioner og har mange interessante syntetiske reaksjoner. Særlig viktige
er reaksjonene med andre aromatiske aminer eller fenolationer, f.eks.: C6H5N=N+
+ C6H4(NH2)2 = C6H5N=NC6H3(NH2)2
+ H+. Gruppen -N=N- kalles azogruppen (fra det franske azote som var
et tidlig navn på nitrogen) og forbindelser som inneholder denne gruppen kalles
azoforbindelser. Alle er sterkt fargede, og når de inneholder grupper som gjør
dem vannløselige, slik som amino- og hydroksylgruppene eller en sulfogruppe,
kan de brukes som fargestoffer. Det er kjent en myriade slike azofargestoffer,
det som er nevnt over heter krysoidin og farger brunrødt. Ofte foreligger de
som salter av alkalimetaller eller klorider. Azogruppen er fargesenteret, men
nyansene påvirkes av den øvrige sammensetningen av molekylet. Gule, oransje,
røde, brune, svarte og blå varianter forekommer.
Med en blanding av
salpetersyre og svovelsyre som kalles nitrersyre kan de fleste organiske
forbindelser nitreres, d.v.s. at det innføres en nitrogruppe, -NO2,
og dannes en nitroforbindelse. Når salpetersyre og en organisk hydrogenholdig
forbindelse som benzen føres sammen reagerer de ved at et hydrogen fra benzenet
forener seg med OH-gruppen på syren til et molekyl vann. Svovelsyren påskynder
reaksjonen ved å trekke til seg vannet slik at likevekten forskyves mot
produktsiden i reaksjonen. Hvis den organiske forbindelsen inneholder en
OH-gruppe og altså er en alkohol, skjer substitusjonen fortrinnsvis på denne
gruppen, og det dannes en nitratester i stedet for en nitroforbindelse.
Eksempler på nitroforbindelser er 2,4,6-trinitrotoluen (TNT), C6H2(NO2)3CH3,
N-metyl-N,2,4,6-tetranitroanilin (tetryl), C6H2(NO2)3N(CH3)NO2,
trinitrofenol (pikrinsyre), C6H2(NO2)3OH,
heksahydro-1,3,5-trinitro-1,3,5-triazin (hexogen), (-CH2N[NO2]-)3
(en ringformet forbindelse) og heksanitrodifenylamin (hexyl), (C6H2[NO2]3)2NH.
På omtrent samme måte som i krutt, hvor nitrogen i oksydasjonstrinn +5 i
salpeteret er blandet med karbonet i trekullet, sitter femverdig nitrogen her i
tett kjemisk forbindelse med karbon i oksydasjonstrinn -4 og avgir oksygenet
sitt til det i eksplosive kjedereaksjoner med sterk gassutvikling (opptil 900
liter pr. kg sprengstoff) som gir høyt trykk (opptil 100 tonn/kvadratcm) og høy
eksplosjonstemperatur (opptil 5000 °C). Alle de nevnte forbindelsene er
velkjente eksplosiver.
Nitrogrupper kan
reduseres til aminer med tilstrekkelig sterke reduksjonsmidler. Aromatiske aminer
kan bare vanskelig lages ved ammoniakkbehandling av halogenider, og industriell
produksjon av anilin (aminobenzen) har i stor utstrekning foregått ved å
nitrere benzen og redusere nitrogruppen med tinn og saltsyre eller liknende:
C6H5NO2 + 3Sn + 7HCl = C6H5NH3Cl
+ 3SnCl2 + 2H2O.
Aldehyder og ketoner
reagerer under visse betingelser med hydroksylamin, NH2OH, til
oksimer, f.eks. med aceton dannes dimetyloksim: (CH3)2CO
+ NH2OH = (CH3)2C=N-OH + H2O.
Oksimer omarrangeres til amider når de behandles med svovelsyre: (CH3)2CNOH
-> CH3CONHCH3 (såkalt Beckmann-omordning), d.v.s.
oksygenatomet flytter over fra nitrogenet til karbonet og den ene metylgruppen
flytter fra karbonet til nitrogenet.
Mettede hydrokarboner
reagerer med klor og brom under påvirkning av lys eller varme. Benzen og andre
aromatiske hydrokarboner uten sidegrupper trenger en katalysator som
jern(III)klorid for å reagere. Eksempel: C8H18 + Cl2
= C8H17Cl + HCl. Resultatet kalles halogenider, i dette
tilfellet oktylklorid eller etter nyere regler (mono)kloroktan. Antall
halogenatomer som substitueres er avhengig av mengden halogen og hydrokarbon,
og halogenatomenes plassering på molekylet er fullstendig tilfeldig. Brukes ett
mol klor og ett mol oktan i reaksjonen fås en blanding av 1/3 1-kloroktan og
2/9 hver av 2-kloroktan, 3-kloroktan og 4-kloroktan. Trengs bare den ene må den
separeres ut, f.eks. ved destillasjon, men det er vanskelig, for forskjellene i
egenskaper er små. En annen måte å halogenere på er å addere halogen til
hydrokarboner med dobbelt- eller trippelbindinger, f.eks. 2-penten: CH3-CH=CH-CH2-CH3
+ Br2 = CH3-CHBr-CHBr-CH2-CH3. Med
klor og brom går denne reaksjonen raskt også i mørke ved romtemperatur, og
resultatet er entydig, 2,3-dibrompentan. Like raskt går reaksjonen med hydrogenhalogenider,
også hydrogenjodid. Adderes HI til 2-penten fås en blanding av 2- og
3-jodpentan, men her blir det atskillig mer av den sistnevnte. Er hydrokarbonet
symmetrisk fås bare ett produkt, f.eks. med acetylen og saltsyre: C2H2
+ HCl = CH2:CHCl. Produktet her heter vinylklorid, et uhyre viktig
råmateriale i plastindustrien. En annen måte å sette inn et halogenatom i en
spesifikk posisjon er å bytte ut hydroksylgrupper med halogen ved å la
alkoholer reagere med tionylklorid eller fosfortribromid eller -jodid, f.eks.
CH3CH2CH(OH)CH3 + SOCl2 = CH3CH2CHClCH3
+ SO2 + HCl. Eller: 3 C6H5OH + PBr3
= 3 C6H5Br + H3PO3.
Disse halogenidene
likner hydrokarbonene svært i egenskapene. Alle er uløselige i vann, men løses
i diverse organiske løsningsmidler, og et hydrokarbon-halogenid og et
hydrokarbon med samme molekylvekt har i prinsippet samme smelte- og kokepunkt.
Men de fleste er tyngre enn vann. De er også mindre reaktive, særlig hvis det
er mange halogenatomer. Dessuten er de giftige. Kloridene er mest giftige, og
som regel giftigere jo flere kloratomer det er i molekylet. Bromidene er mindre
giftige enn kloridene og jodidene mindre enn bromidene. Av organiske
halogenider er det bare jodidene som har biologisk betydning. Fluoridene er de
minst reaktive av halogenidene, og derfor også påfallende mindre giftige enn
kloridene. Velkjente giftige klorider er kloroform eller triklormetan, mye
brukt til å bedøve med, bl.a. av kidnappere i B-filmer, og av
sommerfuglsamlere. Så har vi DDT, som står for diklordifenyltrikloretan, eller
mer systematisk 2,2-bis(4-klorfenyl)1,1,1-trikloretan, CCl3CH(C6H4Cl)2.
Halogenider er også viktige i syntese. Primære halogenider reagerer lett med
hydroksydioner til alkoholer. De fleste sekundære og alle tertiære spalter
heller av et hydrogenhalogenid og gir umettede hydrokarboner: CH3-C(CH3)2-Cl
+ OH- = CH2=C(CH3)2 + H2O
+ Cl-. Halogenidene reagerer også med alkoholationer til etere, med
ammoniakk til aminer og med cyanid til nitriler. En ekstremt viktig reaksjon er
med magnesiummetall i vannfri eter: C3H7Br + Mg = C3H7MgBr.
Slike forbindelser kalles grignardreagenser. De er svært reaktive og brukes i
løsning så snart de er laget. Tilføres vann og syre fås det opprinnelige
hydrokarbonet tilbake mens magnesiumhydroksydhalogenid går i løsning. Med
grignardreagenser blir mulighetene til å bygge opp kompliserte molekyler
tilnærmet endeløse. Starter man med n-propylbromid og lager grignardreagens kan
f.eks. følgende reaksjoner oppnås ved enkel sammenblanding:
Med formaldehyd fås
primære alkoholer:
C3H7-MgBr + CH2O => C4H9OH.
(Produktet er egentlig C4H9OMgBr, tilføres vann og syre
fås alkoholen + MgBrOH.)
Med andre aldehyder fås
sekundære alkoholer:
C3H7MgBr + CH3CHO => C3H7-CH(OH)-CH3.
Med ketoner fås tertiære
alkoholer:
C3H7MgBr + CH3COC4H9
=> C3H7-C(OH)(CH3)-C4H9.
Med estere fås et
tertiært og et primært alkohol:
2 C3H7MgBr + C6H5COOC2H5
=> C3H7-C(OH)(C3H7)-C6H5
+ C2H5OH.
Med karbondioksyd fås en
syre:
C3H7MgBr + CO2 => C3H7COOH.
Som man forstår,
grignardreagenser er et av de nyttigste verktøy den organiske syntetikeren har.
Ikke bare hydrokarboner
kan halogeneres. Hvis benzenringer har aktive grupper som hydroksyl eller amin,
går reaksjonen med halogen lett ved romtemperatur: C6H5OH
+ Br2 = BrC6H4OH + HBr. Resultatet her er
alltid para-bromfenol (4-bromfenol). I sur eller basisk løsning kan ketoner
lett halogeneres, både med klor, brom og jod. Halogenet vil feste seg på et
nabokarbon til ketogruppen, alltid karbonet på den korteste grenen. I sur
løsning byttes hydrogenene med halogen ett og ett og reaksjonen kan alltid
stoppes når riktig antall halogener er nådd. Men i basisk løsning går den
videre til det ene nabokarbonet er mettet med halogen, og hvis man ikke
tilfører nok halogen til at alle molekylene mettes får man en blanding av
ureagert keton og ketoner med forskjellig antall halogenatomer på nabokarbonet.
Hvis en av grenene er en metylgruppe opptar den i basisk løsning raskt tre
halogenatomer og spaltes fra med kloroform, CHCl3, bromoform, CHBr3
eller jodoform, CHI3 som resultat. Jodoformreaksjonen brukes som
test på metylketoner, siden den er et gult fast stoff som er uløselig i vann og
har en karakteristisk lukt.
Freon er en generell
betegnelse på klorfluorkarboner (KFK eller CFC), og spesielt
difluordiklormetan. De er mye brukt til kjølemedium p.g.a. den kjemiske
inertheten og fordampningsegenskapene. Men oppdagelsen av at de med uhyggelig
effektivitet spalter oson har vært årsak til stor bekymring over at så store
mengder av dem slippes ut i atmosfæren, og mange kjøleanlegg, f.eks. ved
kunstisbanen på Valle Hovin i Oslo, har gått over til ammoniakk eller andre
kjølemedier.
Når en organisk syre
tilføres fosforpentaklorid dannes et syreklorid: C6H5COOH
+ PCl5 = C6H5COCl + HCl + POCl3.
Slike forbindelser navngis med syrenavnet + klorid, her benzosyreklorid, eller
med syreradikalnavnet + endelsen -oyl og klorid, i dette tilfellet
benzoylklorid. For de syrene som har egne navn brukes ofte den latinske
versjonen av navnet + -yl og klorid, som acetylklorid, propionylklorid,
butyrylklorid etc, men -oyl brukes ikke sjelden her også. Syrekloridene er
atskillig flyktigere enn syrene, vi må opp til stearoylklorid, C17H35COCl
for å finne en som smelter ved romtemperatur. De er løselige i upolare
organiske løsningsmidler, men reagerer med vann, ammoniakk og alkoholer til
h.h.v. syrer, amider og estere. De har skarp, skjærende lukt og er ubehagelige
substanser som har vært brukt som tåregasser og helst må arbeides med i
avtrekk.
Alle disse klassene av
forbindelser kan også inngå i polymerer, kjeder av repeterende identiske eller
nesten identiske molekylenheter. Sammensetningen av polymerene kan gi dem vidt
forskjellige egenskaper, men de har også mange ting til felles. Som regel har
de langt høyere smeltepunkt, viskositet (seighet) og mye lavere løselighet og
reaktivitet enn bestanddelene. De som i det hele tatt er løselige i vann eller
organiske løsningsmidler gir seige, grøtete løsninger som nærmer seg en
glassen, amorf konsistens hvis løsningen gjøres mer konsentrert. Mange polymerer
kan slett ikke krystallisere og danner glassaktige masser uten veldefinert
smeltepunkt. Også mange helt eller delvis krystallinske polymerer går ved
oppvarming bare nesten umerkelig over til seige masser som bare sakte blir
mykere.
Disse kjempemolekylene
arrangerer seg internt på tre grunnleggende forskjellige måter, som stive
"staver" av molekylkjeder, som regelmessige spiraler eller i
uregelmessige kveiler. En og samme kjemiske forbindelse kan få
bemerkelsesverdig forandrede egenskaper hvis det veksler mellom to av disse
arrangementene, f.eks. er polypropylen i kveilformen en seig, ekkel grøt, mens
spiral-polypropylen er et fast stoff med høyt smeltepunkt. Mer om polymerer
senere.
Analyse:
Kvalitativ påvisning av
karbon er sjelden aktuelt, da det idag ofte er opplagt om de angjeldende
prøvene er karbonholdige eller ikke. Men hvis materialet er brennbart kan det
være en god prøve å lede avgassene ned i en kalsiumklorid- eller
bariumhydroksydløsning for å se om vannet blakkes av karbonatutfellinger. Hvis
det ikke er brennbart kan man få karbondioksydutvikling ved sterk oppheting med
kobber(II)oksyd. En kvantitativ bestemmelse kan fås hvis forbrenningen kan
gjøres fullstendig og alle avgassene kan føres gjennom en
bariumhydroksydløsning. Bunnfallet sentrifugeres, tørkes godt ved moderat
oppvarming (100 °C) og veies. Karbonet er 6,0862 % av den veide massen. En
blanding av fast kalsiumoksyd (CaO) og natriumhydroksyd (NaOH) kan også brukes
som absorpsjonsmiddel.
En vannløsning av
platina(II)klorid brukes til å påvise karbonmonoksyd som reduserer metallionene
til metall: Pt2+ + H2O + CO = Pt + CO2 + 2 H+.
Mørkfargingen av løsningen på grunn av metallpartiklene gir indikasjonen. Palladium(II)klorid
kan også brukes på samme måten.
Påvisning av karbonat kan gjøres ved å dryppe
sterk (f.eks. 3 M) svovelsyre på prøven og se om det utvikles gass. Hvis det
skjer, bringes gassen i kontakt med en mettet bariumhydroksydløsning som
blakkes av karbondioksyd. Slik kontakt kan f.eks. oppnås ved å plassere et lite
rør med hydroksydløsning inne i prøverøret og koble til det ytre etter
syrepådryppingen.
Påvisning av oksalat
gjøres på samme måten. Hvis det ikke utvikles gass når det dryppes på syre kan
du prøve å tilsette kaliumpermanganat til syren. Hvis det da utvikles gass som
blakker kalkvannet er det påvist oksalat.
Cyanider frigjør blåsyre
ved pådrypning av svovelsyre. Blåsyren lukter meget sterkt av bitre mandler og
kan registreres også i meget små (ufarlige) mengder. Sørg bare for å ikke pøse
på med syre, da kan det gå deg ille... Vær oppmerksom at det ikke er alle som
kan oppfatte mandellukten.
Acetat påvises ved å
røre ut prøven med noen dråper sterk svovelsyre i en porselensskål. Lukt av
eddik påviser acetat. Acetat i løsning gir karakteristisk brunrød farge ved
tilsetning av jern(III). Ved innkoking av løsningen fås
jern(III)hydroksyacetat, (CH3COO)2Fe(OH), som gir
kvantitativ bestemmelse ved veiing.
Mange organiske
forbindelser har karakteristisk lukt som gir sikker påvisning. F.eks. er aminer
kjent for sin fiskelukt. Merkaptaner har sin egen, ubeskrivelige lukt.
Middelslange karboksylsyrer som f.eks. smørsyre har også en karakteristisk,
ubehagelig lukt. Andre syrer, estere, aldehyder og ketoner har karakteristisk,
individuell lukt som det er lett å identifisere. Smelte- og kokepunkter for
mange organiske stoffer er bestemt meget nøyaktig og kan brukes til
identifikasjon.
Det finnes også en rekke
karakteristerende reaksjoner. Umettede hydrokarboner reagerer raskt med brom i
karbontetrakloridløsning og hvis man drypper dråper av slik løsning på et
hydrokarbon er innholdet av dobbelt- eller trippelbindinger påvist hvis den
rødbrune fargen raskt forsvinner. Aromatiske hydrokarboner reagerer som mettede
ved denne testen.
Kompliserte molekyler
som inneholder dobbeltbindinger kan spaltes i dobbeltbindingen ved såkalt
"osonolyse". Oson bobles ned i en løsning av substansen og det
oppstår et "osonid" som reduseres med sink og eddiksyre til litt
kortere karbonylforbindelser, aldehyder og ketoner som med litt flaks kan
identifiseres. Eksempelvis spaltes 2-metyl-2-buten, (CH3)2C=CH-CH3
til aceton, (CH3)2CO og acetaldehyd, CH3CHO.
Oppvarming med
kaliumpermanganat spalter også umettede hydrokarboner. I Baeyers test oksyderes
hvert av de to karbonene i dobbelt- eller trippelbindingen til karbonyl, og
hvis det er bundet et hydrogenatom til dem, oksyderes det til hydroksyl slik at
resultatet oftest blir syrer som med litt flaks kan identifiseres. Bayers test
baserer seg på at den fiolette fargen av permanganatet forsvinner som tegn på
umettethet. Eksempelvis spaltes 3-fenyl-3-heksen, CH3-CH2-C(C6H5)=CH-CH2-CH3
til etyl-fenylketon, CH3-CH2-CO-C6H5,
og propionsyre, CH3-CH2-COOH.
Fenoler reagerer med
metyljodid i en acetonløsning av kaliumkarbonat til etere. Jodfrigjøring gir en
god indikasjon på reaksjonen. Andre alkoholer danner ikke eller nesten ikke
etere under slike betingelser.
Den såkalte Tollens test
for aldehyder går ut på å behandle det mulige aldehydet med en
sølvnitratløsning i ammoniakk. Ag(I)-ioner er dårlige oksydasjonsmidler, men
klarer å oksydere aldehyder: C6H5CH:CHCHO + 2Ag(NH3)3+
+ 3OH- = C6H5CH:CHCOO- + 2Ag + 2H2O
+ 4NH3. Det reduserte sølvet avsetter seg på reagensrøret som et
vakkert speil og påviser aldehydet.
Jodoformtesten på
metylketoner baserer seg på at bare ketoner med minst en metylgruppe avspalter
jodoform når de jodiseres i basisk løsning: CH3CH2CH2COCI3
+ OH- = CH3CH2CH2COO- +
CHI3. Jodoformen er uløselig i vann og felles som et gult bunnfall
med karakteristisk lukt.
Aldehyder og ketoner
reagerer med en sur løsning av 2,4-dinitrofenylhydrazin og danner et
karakteristisk gult eller oransje bunnfall av 2,4-dinitrofenylhydrazoner
(>C=O byttes ut med >C=N-NH-), gjerne med karakteristiske smeltepunkter.
Andre karbonylforbindelser, som karboksylsyrer og derivater av dem, reagerer ikke
på samme måten.
Det finnes en rekke
kromatografiske metoder som brukes i organiske analyser. Kromatografi består
prinsipielt i å skille komponenter i en blanding fra hverandre ved å utnytte
hvor forskjellig de forskjellige komponentene absorberes i et gitt
absorpsjonsmedium. Prøven som skal kromatograferes føres (elueres) gjennom
absorpsjonsmediet med et elusjonsmiddel (f.eks. vann eller et organisk
løsningsmiddel) som beveger seg i forhold til absorpsjonsmediet, og forholdet
mellom tiden de ukjente molekylene tilbringer på absorpsjonsmidlet og i
løsningen er forskjellig for hvert stoff, slik at de som absorberes minst føres
raskere med elusjonsmidlet enn de andre. Ved hjelp av standarder kan de
forskjellige substansene identifiseres. Betegnelsen kromatografi kommer av at
man ofte tilfører farge når kromatogrammet er fiksert (bevegelsen stanset) for
å se hvor langt de forskjellige substansene har beveget seg. Eksempler er
papirkromatografien som er beskrevet under proteinanalysen nedenfor, hvor
absorpsjonen skjer i papiret, tynnskiktkromatografi hvor det skjer i et tynt
skikt aluminiumoksyd, kvarts, trekull e.l. på en plate og prøven beveger seg
oppover p.g.a. hårrørseffekten, samt kolonnekromatografi, hvor
absorpsjonsmidlet er pakket i en kolonne som prøven elueres igjennom ovenfra.
Gasser kan identifiseres med gasskromatografi i spesialkonstruert apparatur.
Høytrykksvæskekromatografi (HPLC) er en annen metode som kjøres i automatisk
apparatur.
I moderne organisk analyse
brukes en rekke spektroskopiske metoder. Som atomene har molekylene diskrete
energinivåer for diverse vibrasjons- og rotasjonsenergier og elektronenergier,
og fotoner som har akkurat slik energi som trengs for overgang mellom to slike
nivåer blir absorbert, mens andre slipper gjennom. Ultrafiolett stråling kan
eksitere pi-elektroner, og molekyler som har dobbeltbindinger kan derfor
identifiseres p.g.a. absorpsjonstopper ved bestemte bølgelengder. Systemer med
minst to tettsittende dobbeltbindinger absorberer i det nære ultrafiolette,
litt enklere frekvenser å ha med å gjøre. Eksempler: butadien, heksatrien,
oktatetraen etc.
Vibrasjoner i bindingene
mellom atomene har energiforskjeller som gir absorpsjon i infrarødt. Hver
bindingstype har sine energinivåer, avhengig av hvilke atomer de går mellom, og
de påvirkes lite av de andre atomene i molekylet. Siden energinivåene ligger
med større avstand fra hverandre enn for de ultrafiolette, utstyret er
billigere og alle forbindelser har tydelig absorpsjon var dette lenge den mest
brukte spektroskopimetoden for organikere. Infrarød spektroskopi identifiserer
ikke hele strukturen til et molekyl umiddelbart, men viser hvilke grupper som
er til stede og substansen kan ofte identifiseres fullstendig ved sammenlikning
med tidligere opptatte spektra.
Kjernemagnetisk
resonansspektroskopi (nmr) går ut på å finne ut hvor sterkt et eksternt
magnetfelt må være for at en atomkjerne skal gå fra en spinntilstand hvor dens
eget magnetfelt er motsatt det eksterne til en hvor det virker samme vei. I
organisk analyse er det mest hydrogen- og karbonkjernene som er av interesse.
Elektronskyene rundt kjernene skjermer dem mot det eksterne magnetfeltet og
skjermingen varierer i styrke alt ettersom hvordan elektronskyene er fordelt
etter bindingsforholdene i molekylet. Spinnskiftingen til kjernen registreres
ved absorpsjon av fotoner i radiobølgeområdet som prøven konstant bestråles
med. Som referanse tilsettes f.eks. tetrametylsilan, (CH3)4Si,
hvor protonene er bedre skjermet enn nesten alle andre protoner, og avviket fra
den feltstyrken som trengs for spinnskifte på tetrametylsilan måles og oppgis i
milliondeler av feltstyrken (p.p.m.). I den vanligste karbonisotopen 12 er alle
kjernepartiklene parede, og spinnene opphever hverandre. Derfor baserer
karbon-NMR seg på isotopen 13, som det er 1,1 % av i vanlig karbon. I noen
analyser blir det tilsatt ekstra C 13 for å gjøre signalene tydeligere. Som
referanse brukes gjerne karbontetraklorid, 13CCl4, hvor
karbonet er svært godt skjermet. Siden identifikasjonen av de forskjellige
atomgruppene er svært spesifikk har NMR idag overtatt som den viktigste
analysemetoden for organikere.
Massespektroskopi går ut
på å fordampe molekyler i vakuum, ionisere dem ved elektronbestråling og sende
dem gjennom et magnetfelt etter å ha akselerert dem i et elektrisk felt. Ionene
beveger seg i krumme baner med radius som avhenger av ioniseringsgraden og
massen til ionet samt rimeligvis av feltstyrken. Molekylvekten til en substans
kan finnes ved å måle hvor den treffer på en registreringsenhet. Mindre enn et
milligram av substansen er nødvendig, og stoffer med mindre enn en promilles
forskjell i molekylvekt kan skilles fra hverandre. Et stort poeng ved denne
metoden er jo da også at man kan skille ut molekyler av en og samme substans,
men med forskjellig isotopsammensetning. Massespektroskopi kan brukes til å
fremstille etanol med bare karbon 12, hydrogen 1 og oksygen 16, for eksempel,
uten den vanlige tilblandingen av C 13 og 14, H 2 og 3 og O 17 og 18. Slik ren 12C21H516O1H
utgjør bare 97,47 % av vanlig etanol.
For proteinanalyse er det viktig å vite hvilke
aminosyrer de består av, hvor mye det er av hver og rekkefølgen av dem i
proteinkjeden. En enkel måte å bestemme de to første på er ved
papirkromatografi. Filterpapir består av ren cellulose med ca. 20 % absorbert
vann. Man setter papirstykket skrått ned i en skål med et egnet organisk
løsningsmiddel som fenol eller butanol. Løsningsmiddelet begynner å migrere
oppover papiret p.g.a. hårrørseffekten. Nederst på papiret drypper man en dråpe
av en aminosyreblanding (resultatet av en fullstendig proteinhydrolyse med
syrekoking). Aminosyrene vil også begynne å vandre oppover mens de kontinuerlig
fordeles mellom det absorberte vannet i papiret og det organiske
løsningsmidlet. De mest vannløselige aminosyrene vil tilbringe mer tid i den
stasjonære vannfasen og mindre i den migrerende organiske og vil derfor ikke
vandre så langt som de mindre vannløselige aminosyrene. Etter en passende
tidsperiode tas papiret ut av skålen, tilførselen av organisk løsningsmiddel
holder opp og bevegelsen stanser. Ved å spraye papiret lett med en basisk
løsning av ninhydrin, en forbindelse som gir en sterk fargevirkning med
aminosyrer, ser man hvor langt de forskjellige aminosyrene har vandret og kan
identifisere dem ved å sammenlikne med standarder. For best mulig oppløsning er
det en fordel å ha papirstrimmelen så lang som mulig. Størrelsen på flekkene
sier noe om hvor mye det er av de enkelte aminosyrene. Denne metoden ble brukt
av pionerene innen proteinanalyse. Idag analyseres proteiner i automatisk
utstyr basert på ionebytterkromatografi.
Å bestemme rekkefølgen
av aminosyrene i proteinet er en mer komplisert affære. Det finnes enkelte
kjemikalier som 2,4-dinitrofluorbenzen eller
1-dimetylaminonaftalen-5-sulfonylklorid (DANSYL-klorid) som fester seg på
amino-enden av peptidkjeden med en binding som ikke påvirkes av senere
hydrolyse slik at ende-aminosyren kan bestemmes. Enzymet karboksypeptidase
spalter av aminosyrer fra den andre enden, slik at hvis man lar det virke på et
protein en tid vil man finne større mengder av aminosyren ved karboksyl-enden
enn av de andre. Fenylisotiocyanat fester seg også til aminoenden, og ved
behandling med fortynnet saltsyre tar den med seg den siste aminosyren og lar
de andre være i fred slik at samme prosedyre kan repeteres med resten av
kjeden. (Edman-metoden.) Med automatiserte sekvenatorer er det idag mulig å
koble av litt over 100 aminosyrer (hver avkobling tar 2 timer) med denne
metoden for separat analyse før feilkildene blir for store. Derfor er det
aktuelt å spalte et protein i relativt korte peptider og prøve denne eller
andre metoder på dem. Til dette bruk har man f.eks. N-bromsuccinimid, som
spalter proteiner ved tyrosin, og en del enzymer som har andre preferanser. De
korte peptidene separeres så ved kromatografiske metoder før sekvenseringen
begynner.
For en optisk aktiv
forbindelse er det ikke nok å bestemme alle de aktive gruppene og i hvilken
rekkefølge de sitter på molekylet. Målinger av polarisasjonsdreining skiller
klart forskjellige stereoisomerer fra hverandre, men de sier ingenting om
hvordan de forskjellige asymmetriske karbonene faktisk er konfigurert. Her
gjelder det å bruke sin kløkt og det en hittil har lært av organiske reaksjoner
for å finne løsningen. Still opp alle konfigurasjonsalternativene og bruk
eliminasjonsmetoden. Hvis et av alternativene kan gi et speilsymmetrisk molekyl
etter en viss reaksjon, utfør reaksjonen og se om molekylet fremdeles er optisk
aktivt. I såfall er dette alternativet eliminert. Undersøk muligheten for at
molekylet kan spaltes og fortsett analysen på smådelene. Arbeidet krever
fantasi og kombinasjonsevne og kan være mer spennende enn kriminalromaner for
den som har sansen for denslags ting.
Fremstilling:
Tenn et stearinlys, før
en porselensskål inn i flammen og det setter av seg et svart lag. Du har
fremstilt karbon, i form av sot, en temmelig ren form av karbon. Trekull er
også ganske rent karbon som fra gammelt av har vært laget ved å brenne ved med
minst mulig lufttilgang i miler hvor veden er dekt til med granbar, jord og
sand eller knust trekull. Idag fremstilles trekull helst i lukkede jernretorter
som oppvarmes utenfra, gjerne med anordninger slik at man kan ta vare på avgassene
og fremstille treeddik og tretjære av dem eller bruke dem til oppvarming av
retorten. Koks er også ganske rent karbon som fremstilles ved en liknende
behandling av kull. Karbonfiber har interessante materialegenskaper og
fremstilles ved en annen liknende prosess hvor forskjellige syntetiske
polymerfibre forkulles, f.eks. polyakrylnitril. For å gi best mulig stivhet
oppvarmes fibrene i inert atmosfære til opptil 3000 °C.
Kunstig grafitt kan
fremstilles på forskjellige måter. Pyrolyttisk grafitt fås ved å spalte lette
hydrokarboner (metan, etan, benzen) ved en grafittoverflate under lavt trykk og
temperaturer på ca. 2000 °C. Retortegrafitt og glanskarbon er harde, sistnevnte
nesten som diamant, men består av små grafittkrystaller. Retortegrafitten fås
ved koksbrenning når avgassene fra kullet spaltes ved retorteoverflaten. Den
har god elektrisk ledningsevne og brukes i elektroder. Glanskarbon fås ved å la
en metan- eller lysgassflamme brenne mot glasert porselen eller en metallflate
som er oppvarmet til 800 °C. Her er krystallene ytterst små, bare 20 Å, og
danner en sprø, metallglinsende overflate som er hard, nesten som diamant, og
kjemisk meget motstandsdyktig.
Kunstige diamanter
fremstilles ved å utsette grafitt for meget høyt trykk. Da General Electric i
1955 annonserte at de kunne lage kunstige diamanter steg aksjene på en dag med
mer enn 300000000 dollar. Med spesialkonstruerte stempler hvor alt trykket
konsentreres i en smal spiss lagde GE små industridiamanter uten
smykkesteinskvalitet, men gode nok til urverk og slipeutstyr. GE's stempler var
maskinelt drevne, men andre har fremstilt diamanter med stempler som er drevet
av eksplosjoner.
Demonstrasjonsforsøk:
En mengde interessante
demonstrasjoner kan gjøres med karbon og karbonforbindelser. Prøv f.eks. med
denne: Ta en hvit, feilfri diamant og legg den på bunnen av en hvit
porselensskål med bunnen opp som du setter under en klokke fylt med oksygen.
Under klokken skal det også stå en åpen skål med en mettet løsning av
bariumhydroksyd. Med sollys og et brennglass av stor diameter setter du fyr på
diamanten. Kjenn den synkende følelsen i maven når den brenner med en blekblå
flamme til det ikke er noe igjen av den, ikke så mye som et askespon. (Hvis
diamanten ikke er så perfekt vil det danne seg aske.) Se overflaten av
bariumhydroksydløsningen bli hvit som følge av at det felles bariumkarbonat, et
bevis på at det var karbon i diamanten.
C + O2 = CO2. Ba2+ +
2 OH- + CO2 = BaCO3 (s) + H2O.
Lag til en ny
bariumhydroksydløsning, ta et sugerør og pust ut gjennom det ned i løsningen.
Den samme reaksjonen skjer, et bevis på at det er det samme i deg som i
diamanten. Hell opp et glass selters og tøm litt bariumhydroksydløsning oppi
den. Hva skjer?
Karbondioksyd er mye
tyngre enn luft og kan oppbevares i kortere tid i et beger uten lokk. For
laboratorieforsøk kan karbondioksyd lages ved å varme opp natron eller helle
saltsyre over natron eller kalkstein eller et annet karbonat. Bariumkarbonatet
som dannes ved testene kan filtreres fra løsningen og brukes til å fremstille
gassen ved tilsetting av syre. Også naturlig kalkstein er fullt ut god nok til
slike forsøk. Fyll f.eks. et litersglass et par cm opp fra bunnen med knust
kalkstein og hell saltsyre over til det ikke utvikles mer gass. Nå er glasset fullt
av karbondioksyd, som kan helles fra dette glasset til andre glass som om den
var en væske, men helt usynlig, og den kan brukes til forskjellige forsøk. Prøv
f.eks. følgende:
Bøy til trappetrinn av
sinkplate eller snekre dem av tre eller liknende. Fest korte stearinlys på
trinnene og sett den ned i et litersglass. Tenn lysene og hell så karbondioksyd
ned i glasset. Se lysene slukne ett og ett, nedenfra og oppover. Tenn på et
magnesiumspon, slipp det ned i glasset og se det fortsette å brenne. Magnesium
er en av de få substanser som kan nyttiggjøre seg oksygenet i karbondioksydet.
Hvis du har sadistiske tilbøyeligheter kan du slippe en mus ned i glasset og se
den snappe etter pusten og langsomt kveles. (Et mye beskrevet forsøk i eldre
kjemi- og biologibøker.) Men hva skjer hvis du har en rimelig stor grønn plante
i glasset når du slipper musa oppi?
Stapp et reagensrør
fullt av sagflis, tett det med en hullkork og inn i korkhullet stikker du et
rør eller en rørkonstruksjon med en utvidelse nedsenket i kaldt vann og en
tilspisset åpning mot friluft. Når du varmer reagensrøret med en bunsenflamme
begynner sagflisa å forkulles. I den nedsenkede utvidelsen danner det seg væske
og fra rørspissen strømmer det ut gass som kan antennes. Væsken skiller seg i
to skikt, det nederste ganske mørkt og det øvre lysere. Til slutt er sagflisa
omdannet til trekull. Den mørke væsken som fortetter seg i røret er tretjære,
hovedsakelig bestående av tunge hydrokarboner, mens den lysere er treeddik, i
det vesentligste eddiksyre. Gassen som strømmer ut er lettere hydrokarboner og
prosessen kalles tørrdestillasjon. Med litt finere apparatur kan du skille ut
en rekke bestanddeler av avgassene fra forkullingen, fra gammelt av en mye
brukt industriell prosess, som også er brukt på en del andre karbonholdige
substanser, f.eks. steinkull og bein.
Fyll et reagensrør med
ammoniakk og sett det opp ned i en skål med kvikksølv. Ta litt ferskt trekull
fra det forrige forsøket, la det kjøles ned, men ikke vent til det er helt
kaldt. Gi det en oppgløding hvis det ikke er ferskt. Løft opp røret, legg
trekullet på kvikksølvet og sett røret over igjen. Merk hvor mye kvikksølvet
stiger i røret mens trekullet (aktivt kull) absorberer ammoniakken. Dette
demonstrerer hvilken absorpsjonsevne aktivt kull har.
Heksemel
(kråkefotsporer) er noe som de fleste apoteker fremdeles selger, (selv om de
ikke bruker det til å trille piller i lenger). Det er et uhyre finfordelt stoff
og kan brukes til en del interessante forbrenningseksperimenter. Legg f.eks. en
liten haug på et metallstykke og tenn på. Den brenner vanlig, som et stykke tre
eller et stearinlys. Hell deretter litt over en flamme fra ca. 1/2 meters
høyde. Det blander seg med luften og blir omtrent usynlig, til det antennes med
et kraftig blaff. Mye brukt til teatereffekter.
Sukker brenner vanligvis
ikke. Men strø litt sigarettaske på en sukkerbit og tenn på. Asken virker som
katalysator for forbrenningsprosessen.
Mange organiske stoffer
er gode syre-baseindikatorer. Plukk noen blåbær og kok litt saft av dem.
Tilsett eddik. Hva skjer? Trekk litt sterk te. Tilsett noen dråper eddik. Hva
skjer? Tilsett så lut eller natron (nok til å nøytralisere eddiken pluss litt
til). Hva skjer nå? Rasp opp ei rå potet og la den ligge i lufta. Hva skjer.
Hell litt eddik over den og se hva som skjer nå.
Fenolftalein er en
indikator som gir en blodliknende rødfarge ved basisk reaksjon. Dette kan
utnyttes til noen iøynefallende forsøk. Hell f.eks. en fenolftaleinløsning på
huden og la den tørke. Den gir ikke noen spesiell fargereaksjon. Deretter
dypper du en kniv i en svak lutløsning og fører den over det stedet på huden
hvor du har den tørkede indikatoren. Det danner seg en illevarslende rød strek.
En klut eller bomullsdott som er dyppet i lut gir også en iøynefallende
reaksjon når den strykes over den indikatorbelagte huden.
Det er enkelt å lage en
rekke velluktende estere ved å blande en alkohol og en syre, tilsette litt
konsentrert svovelsyre og varme opp. Esteren kan renses for svovelsyre ved ekstraksjon.
Bruk en ekstraksjonsflaske som kan tappes fra bunnen. Tilsett vann og eter
(dietyleter) og rist godt. Svovelsyren løser seg best i vannet mens esteren
løser seg i den upolare eteren. Tapp ut vannfraksjonen med svovelsyre, tilsett
mer rent vann og rist. Gjenta et par ganger til for å få bort alle syrerestene.
Esteren renses for eter ved svak oppvarming til all eteren er kokt bort og kan
nå brukes som luktstoff eller kunstig tilsetning i mat. Det er forbløffende
hvor mye naturlig vellukt som kan imiteres på denne måten.
En annen måter å lage
estere på er direkte ved å blande et syreklorid og en alkohol som nevnt
tidligere. Det dannes litt ester spontant også når en alkohol og en syre
blandes. Siden dette er en likevektsreaksjon kan man få fullstendig omdannelse
ved å fjerne den dannede esteren fra blandingen, f.eks. ved ekstraksjon -
estere er langt bedre løselig i upolare løsningsmidler som eter enn både syrene
og alkoholene. En annen mulighet er destillasjon, hvis esteren har lavere
kokepunkt enn reaktantene, noe som forekommer. Dessuten kan reaksjonen som
andre likevektsreaksjoner katalyseres, d.v.s. likevekten flyttes i retning av
produktet med en katalysator. Sterke syrer virker katalyserende på
esterdannelse. Det finnes også enzymer som kan katalysere esterdannelse, og
hvis man bruker enzymer imiterer man jo fullstendig den naturlige
produksjonsformen, slik at aromastoffet kanskje ikke er så kunstig likevel?
Aldolkondensasjon er en
klassisk reaksjon som kan gi artige resultater. Skaff 5 ml fersk acetaldehyd og
50 ml fersk benzaldehyd. Ikke la dem stå og oksydere vekk før du starter
forsøket. Lukt på aldehydene og merk hvordan de lukter. Preparer 10 ml 0,1 M
NaOH i et 100 ml begerglass, løs acetaldehydet i det og pøs på med
benzaldehydet. Legg merke til om lukten forandrer seg noe særlig. Du har
fremstilt 2-hydroksy-3-fenylpropanal, C6H5CH(OH)CH2CHO,
ved aldolkondensasjon. Hell oppi 10 ml 10 M NaOH, rør litt i blandingen og legg
merke til lukten. Produktet spalter av et molekyl vann og resultatet er C6H5CH=CHCHO
eller kanelaldehyd. Demonstrer reaksjonsgangen med molekylmodeller.
Lag nylon ved å løse
adipinsyre, HOOCCH2CH2CH2CH2COOH, i
1,1,1-trikloretan i et begerglass, løs heksan-1,6-diamin, H2NCH2CH2CH2CH2CH2CH2NH2,
i vann og hell det forsiktig over adipinsyreløsningen. Mellom de to lagene
danner det seg nylon som du kan dra ut til en tråd ved å gripe tak i den med en
tang eller liknende.
Kalsiumkarbid kan kjøpes
ferdig eller lages ved å oppvarme kalsiummetall med trekull uten at det er noen
fuktighet til stede. Av karbidet fås acetylen når det tilsettes vann. Av
acetylen og hydrogenklorid (saltsyredamp) kan du fremstille vinylklorid. Lag en
oppsats for vinylkloridproduksjon ved å fylle en kolbe med kalsiumkarbid og en
med koksalt tilsatt en rikelig mengde konsentrert svovelsyre. Sett en kork med
to huller i kalsiumkarbidkolben og en med ett hull i koksaltkolben. Fra hver av
disse korkene skal et rør føres gjennom en kork inn i et bredt, horisontalt
rør. Gjennom det andre hullet i karbidkolben skal det settes et rør med trakt
hvor det dryppes vann slik at det utvikles acetylen. Varm opp koksaltkolben til
det utvikles hydrogenklorid. Gassene føres sammen i reaksjonsrøret hvor det er
plassert en katalysator slik at de reagerer til vinylklorid. Fra den andre
enden av reaksjonsrøret føres vinylkloridet inn i et kjølerør som på forhånd er
godt ompakket med tørris, slik at vinylkloridet kondenserer og drypper ned i en
oppsamlingsbeholder.
Vinylkloridet har
kokepunkt på -14 °C og må oppbevares godt nedkjølt eller i trykkflaske for at
det ikke skal dunste vekk. Vinylkloridet polymeriserer til polyvinylklorid
(PVC), et av de mest brukte plaststoffene, når det utsettes for trykk under
nærvær av en katalysator som natriumperoksyd. Polyvinylkloridet kan støpes og
formes i mange fasonger og kan varmes opp til det smelter uten å brenne, en
universalplast med ufattelig holdbarhet og vanvittig mange bruksområder. Men
polyvinylklorid er giftig og nedbrytes uhyre sakte av naturlige
nedbrytningsprosesser, og er derfor også et av de riktig store
forurensningsproblemene.
Eter er et nyttig stoff
til forskjellige ekstraksjoner av upolare forbindelser i organiske substanser.
Ta f.eks. litt havremel og rist i et reagensglass med eter. Filtrer og hell
filtratet over i et urglass og la det stå til eteren er dampet bort. Det som er
igjen i urglasset er havrefett. Det kan gjøres med andre melsorter også, men
havre har mye høyere fettinnhold. Mange interessante eterekstraksjoner kan
gjøres med råmaterialer fra planteriket.
En enkel analyse av mel
kan gjøres som følger: ta et godt kvantum mel, helst hvete- eller rugmel, og
legg det i et klede. Lerret er best, men bruk gjerne et kjøkkenhåndkle eller
annet grovmasket stoff. Pakk melet godt inn i kledet og kna det riktig vel og lenge
i et kar med rent vann. Et fint pulver tyter ut mellom trådene i tøyet og
legger seg i bunnen av karet. Dette er stivelse, som samles opp ved å filtrere
vannet. Hvis du koker vannet etter at stivelsen er filtrert bort, skjærer det
seg og det flyter opp små osteaktige fnokker. Dette er planteproteiner som
koagulerer ved kokingen. Også proteinene kan filtreres ut, gjerne i avkjølt
tilstand. Smak på vannet. Du finner at det smaker søtt. Det er også sukker i
melet. Og hvis du åpner posen ser du at den inneholder et grålig, seigt stoff
som kan trekkes ut i tråder. Dette er såkalt gluten, også kalt kleber,
plantelim eller kleim, et stoff som mange har problemer med å fordøye, men som
gjør melet elastisk og eltbart med vann.
Trypsin er et enzym som
hører til proteasene, de proteinoppløsende enzymene. Det finnes i magesekken og
er også å få kjøpt på apoteket. Oppløs litt trypsin i vann og slipp en kjøttbit
nedi løsningen. Se hvordan kjøttet gradvis oppløser seg.
Ta en bakteriekultur og
oppløs cellemembranene med 1% natriumdodekylsulfat. Tilsett det dobbelte
volumet etanol eller isopropanol og vent til det danner seg skinnende, gråhvite
tråder: DNA, livets kode, som kan snurres opp på en glasstav og beundres av
alle som vil vite svaret på livets gåte.
Noen karbonforbindelser:
![]() Cementitt, et jernkarbid. Grå,
kubiske krystaller med tetthet 7,694 g/cm3 og sm.p. 1837 °C.
Uløselig i vann, men løses i syrer. Hardt og sprøtt. Opptrer i mange typer stål
og støpejern. Kan løse mange andre karbiddannende metaller, f.eks. mangan og
nikkel i teknisk stål, men vanskeligere krom og molybden.
Cementitt, et jernkarbid. Grå,
kubiske krystaller med tetthet 7,694 g/cm3 og sm.p. 1837 °C.
Uløselig i vann, men løses i syrer. Hardt og sprøtt. Opptrer i mange typer stål
og støpejern. Kan løse mange andre karbiddannende metaller, f.eks. mangan og
nikkel i teknisk stål, men vanskeligere krom og molybden.
![]() Karbondioksyd
("kullsyre"), en fargeløs gass med en svakt stikkende lukt og sur
smak. Tetthet 1,977 g/l (0 °C). Smelter ved 56,6 °C i 5,2 atmosfærers trykk.
Under vanlig trykk fordamper den ved 78,5 °C uten å smelte (sublimerer). Fast
karbondioksyd kalles (derfor) tørris. Løses ganske lett i kaldt vann, tyngre i
varmt (3,48 g/liter vann ved 0 °C, bare 0,97 g/l vann ved 40 °C), sett derfor
brusflaskene i kjøleskapet hvis du vil unngå søl. Er også løselig i alkohol og
aceton. Etanolaminer løser karbondioksyd så godt at de brukes til å vaske
gassen bort fra gassblandinger, noe som er viktig i klimapolitisk henseende.
Karbondioksyd
("kullsyre"), en fargeløs gass med en svakt stikkende lukt og sur
smak. Tetthet 1,977 g/l (0 °C). Smelter ved 56,6 °C i 5,2 atmosfærers trykk.
Under vanlig trykk fordamper den ved 78,5 °C uten å smelte (sublimerer). Fast
karbondioksyd kalles (derfor) tørris. Løses ganske lett i kaldt vann, tyngre i
varmt (3,48 g/liter vann ved 0 °C, bare 0,97 g/l vann ved 40 °C), sett derfor
brusflaskene i kjøleskapet hvis du vil unngå søl. Er også løselig i alkohol og
aceton. Etanolaminer løser karbondioksyd så godt at de brukes til å vaske
gassen bort fra gassblandinger, noe som er viktig i klimapolitisk henseende.
![]() Kalsiumkarbonat eller naturlig
kalkspatt. Fargeløse, trigonale krystaller, tetthet 2,710 g/cm3 (18
°C). Smelter ved 1339 °C ved høyt trykk i karbondioksydatmosfære. Dekomponerer
ellers ved 898,6 °C. Tungt løselig i vann, 0,00014 mol/l ved 25 °C, 0,00018 ved
75 °C. Løses lett i syre og ammoniumklorid. Vann som er mettet med
karbondioksyd blir surt nok til å løse ca. 80 ganger så mye kalsiumkarbonat som
rent vann. Hvis man feller karbonat ved å tilføre karbondioksyd vil noe av
bunnfallet kunne løses igjen ved tilførsel av mer karbondioksyd.
Kalsiumkarbonatet har en overgang til rombisk krystallform ved 520 °C
(aragonitt). Kalkspattkrystaller har en karakteristisk dobbeltbrytning. Legger
du en av dem over en blyantstrek ser du streken dobbelt gjennom krystallen.
Kalsiumkarbonat eller naturlig
kalkspatt. Fargeløse, trigonale krystaller, tetthet 2,710 g/cm3 (18
°C). Smelter ved 1339 °C ved høyt trykk i karbondioksydatmosfære. Dekomponerer
ellers ved 898,6 °C. Tungt løselig i vann, 0,00014 mol/l ved 25 °C, 0,00018 ved
75 °C. Løses lett i syre og ammoniumklorid. Vann som er mettet med
karbondioksyd blir surt nok til å løse ca. 80 ganger så mye kalsiumkarbonat som
rent vann. Hvis man feller karbonat ved å tilføre karbondioksyd vil noe av
bunnfallet kunne løses igjen ved tilførsel av mer karbondioksyd.
Kalsiumkarbonatet har en overgang til rombisk krystallform ved 520 °C
(aragonitt). Kalkspattkrystaller har en karakteristisk dobbeltbrytning. Legger
du en av dem over en blyantstrek ser du streken dobbelt gjennom krystallen.
![]() Nikkeltetrakarbonyl. Fargeløs,
flyktig, brennbar væske som krystalliserer som fargeløse nåler. Tetthet 1,32
g/cm3 (17 °C). Sm.p. -25 °C, Kok.p. 43 °C. Tungt løselig i vann,
0,0011 mol/l ved 9,8 °C. Løses i kongevann, alkohol, eter, benzen,
salpetersyre, uløselig i fortynnede syrer og alkalier.
Nikkeltetrakarbonyl. Fargeløs,
flyktig, brennbar væske som krystalliserer som fargeløse nåler. Tetthet 1,32
g/cm3 (17 °C). Sm.p. -25 °C, Kok.p. 43 °C. Tungt løselig i vann,
0,0011 mol/l ved 9,8 °C. Løses i kongevann, alkohol, eter, benzen,
salpetersyre, uløselig i fortynnede syrer og alkalier.
![]() Bly(II)acetat, et hvitt,
krystallinsk stoff med tetthet 3,25 g/cm3 (20 °C) og sm.p. 280 °C.
En av de få blyforbindelsene som er lettløselig i vann, 1,37 mol/l ved 20 °C og
hele 6,70 mol/l ved 50 °C. Løses også i glyserol, meget tungt løselig i
alkohol. Krystalliserer hydratisert fra vannløsning. Trihydratet kalles også
blysukker og smaker svært søtt, men med en metallisk ettersmak. OBS! Meget
giftig! Reagerer med karbondioksydet i luft til tungtløselig blykarbonat. En
blyacetatløsning kan løse store mengder bly(II)oksyd, som ellers er tungt
løselig i vann. En slik løsning kalles basisk blyacetat eller blyeddik og er et
kompleks av blyacetat og en eller flere enheter blyhydroksyd.
Bly(II)acetat, et hvitt,
krystallinsk stoff med tetthet 3,25 g/cm3 (20 °C) og sm.p. 280 °C.
En av de få blyforbindelsene som er lettløselig i vann, 1,37 mol/l ved 20 °C og
hele 6,70 mol/l ved 50 °C. Løses også i glyserol, meget tungt løselig i
alkohol. Krystalliserer hydratisert fra vannløsning. Trihydratet kalles også
blysukker og smaker svært søtt, men med en metallisk ettersmak. OBS! Meget
giftig! Reagerer med karbondioksydet i luft til tungtløselig blykarbonat. En
blyacetatløsning kan løse store mengder bly(II)oksyd, som ellers er tungt
løselig i vann. En slik løsning kalles basisk blyacetat eller blyeddik og er et
kompleks av blyacetat og en eller flere enheter blyhydroksyd.
![]() Natriumpalmitat, myke, hvite,
voksaktige krystaller. Sm.p. 270 °C. Løses lett i vann, ca. 0,3 mol/l.
Forekommer i såpe (bl.a. Palmolive.) Bidrar til å gjøre såpevann til et
løsningsmiddel for fett, olje o.a. ting som vann vanligvis ikke løser.
Natriumpalmitat, myke, hvite,
voksaktige krystaller. Sm.p. 270 °C. Løses lett i vann, ca. 0,3 mol/l.
Forekommer i såpe (bl.a. Palmolive.) Bidrar til å gjøre såpevann til et
løsningsmiddel for fett, olje o.a. ting som vann vanligvis ikke løser.
![]() Tetraetylbly, tetraetylplumban
eller 3,3-dietyl-3-plumbopentan, en fargeløs væske med tetthet 1,659 g/cm3
(11 °C), sm.p. -136,80 °C og kok.p. 91 °C. Dekomponerer ved 200 °C. Brenner i
luft med en oransje flamme med grønn utkant. Uløselig i vann. Løses i benzen,
bensin, alkohol og eter. Mye brukt som tilblanding til bilbensin og har derfor
gitt oss det verste av alle forurensningsproblemer med tungmetaller.
Tetraetylbly, tetraetylplumban
eller 3,3-dietyl-3-plumbopentan, en fargeløs væske med tetthet 1,659 g/cm3
(11 °C), sm.p. -136,80 °C og kok.p. 91 °C. Dekomponerer ved 200 °C. Brenner i
luft med en oransje flamme med grønn utkant. Uløselig i vann. Løses i benzen,
bensin, alkohol og eter. Mye brukt som tilblanding til bilbensin og har derfor
gitt oss det verste av alle forurensningsproblemer med tungmetaller.
![]() Metan, en fargeløs, brennbar gass
med tetthet 0,5547 g/l (0 °C), 0,466 g/cm3 som væske ved
kokepunktet. Sm.p. -182,48 °C, kok.p. -164 °C. Løselig i vann og en rekke
organiske løsningsmidler. Brenner i luft med knapt lysende flamme. Eksplosiv i
blanding med luft. Finnes i avgassene fra mange vulkaner, er en hovedbestanddel
av naturgass fra oljekilder, dannes når mange organiske substanser råtner ved
dårlig lufttilgang, bl.a. i myr- og sumpstrøk og i bunnslam i sjøer (sumpgass),
og i gasslommer i kulleier (gruvegass) hvor den har forårsaket mange
skjebnesvangre eksplosjonsulykker.
Metan, en fargeløs, brennbar gass
med tetthet 0,5547 g/l (0 °C), 0,466 g/cm3 som væske ved
kokepunktet. Sm.p. -182,48 °C, kok.p. -164 °C. Løselig i vann og en rekke
organiske løsningsmidler. Brenner i luft med knapt lysende flamme. Eksplosiv i
blanding med luft. Finnes i avgassene fra mange vulkaner, er en hovedbestanddel
av naturgass fra oljekilder, dannes når mange organiske substanser råtner ved
dårlig lufttilgang, bl.a. i myr- og sumpstrøk og i bunnslam i sjøer (sumpgass),
og i gasslommer i kulleier (gruvegass) hvor den har forårsaket mange
skjebnesvangre eksplosjonsulykker.
 Benzen, også kalt bensen, benzol,
bensol eller fen. En fargeløs væske som fryser til fargeløse rombiske prismer.
Tetthet 0,87865 g/cm3 (20 °C), sm.p. 5,5 °C, kok.p. 80,1 °C. Tungt
løselig i vann, løses lett i alkohol, eter, aceton, kloroform og eddiksyre. Har
en karakteristisk, ikke ubehagelig lukt. Brenner i luft med sterkt lysende og
sotende flamme. Giftig. Molekylstrukturen er en mellomting mellom den som er
skissert til venstre her, og en hvor alle dobbeltbindingene mellom karbonene er
skiftet ut med enkle og omvendt. Alle karbon-karbonbindingene er egentlig
"halvannenbindinger", de deler ikke to elektronpar, men halvannet.
Dette gir en spesielt stabil struktur, og benzen reagerer som et mettet
hydrokarbon i mange henseende, det tar vanskelig opp hydrogen f.eks. Fenomenet
kalles resonansstabilisering, siden strukturen er en mellomting mellom to
strukturer man tidligere forestilte seg at den resonansvibrerte imellom.
Benzen, også kalt bensen, benzol,
bensol eller fen. En fargeløs væske som fryser til fargeløse rombiske prismer.
Tetthet 0,87865 g/cm3 (20 °C), sm.p. 5,5 °C, kok.p. 80,1 °C. Tungt
løselig i vann, løses lett i alkohol, eter, aceton, kloroform og eddiksyre. Har
en karakteristisk, ikke ubehagelig lukt. Brenner i luft med sterkt lysende og
sotende flamme. Giftig. Molekylstrukturen er en mellomting mellom den som er
skissert til venstre her, og en hvor alle dobbeltbindingene mellom karbonene er
skiftet ut med enkle og omvendt. Alle karbon-karbonbindingene er egentlig
"halvannenbindinger", de deler ikke to elektronpar, men halvannet.
Dette gir en spesielt stabil struktur, og benzen reagerer som et mettet
hydrokarbon i mange henseende, det tar vanskelig opp hydrogen f.eks. Fenomenet
kalles resonansstabilisering, siden strukturen er en mellomting mellom to
strukturer man tidligere forestilte seg at den resonansvibrerte imellom.
 Etanol, også kalt etylalkohol
eller bare alkohol. En fargeløs væske med tetthet 0,7893 g/cm3 (20
°C), fryser ved -117,3 °C og koker ved 78,5 °C. Blandbar i alle forhold med
vann, eter og aceton, kloroform og eddiksyre, løselig også i benzen. Sterkt
hygroskopisk og umulig å holde vannfri i kontakt med luften hvis den inneholder
den minste mengde av fuktighet. Minsker bemerkelsesverdig i volum når den
blandes med vann. 52 ml etanol og 48 ml vann gir f.eks. 96,3 ml etanolløsning.
Brenner i luft med en blålig flamme. Lukter ikke ubehagelig, men har en sterk,
skarp smak. Giftig. Dannes som produkt ved mange gjæringsprosesser, både i
naturen og kulturen.
Etanol, også kalt etylalkohol
eller bare alkohol. En fargeløs væske med tetthet 0,7893 g/cm3 (20
°C), fryser ved -117,3 °C og koker ved 78,5 °C. Blandbar i alle forhold med
vann, eter og aceton, kloroform og eddiksyre, løselig også i benzen. Sterkt
hygroskopisk og umulig å holde vannfri i kontakt med luften hvis den inneholder
den minste mengde av fuktighet. Minsker bemerkelsesverdig i volum når den
blandes med vann. 52 ml etanol og 48 ml vann gir f.eks. 96,3 ml etanolløsning.
Brenner i luft med en blålig flamme. Lukter ikke ubehagelig, men har en sterk,
skarp smak. Giftig. Dannes som produkt ved mange gjæringsprosesser, både i
naturen og kulturen.
 Glyserol eller 1,2,3-propantriol,
også kalt glyserin, en fargeløs, tykk, sirupsaktig væske som stivner til
rombiske, plateformede krystaller. Tetthet 1,2613 g/cm3 (20 °C).
Smeltepunkt 20 °C, kokepunkt 290 °C, spaltes delvis under kokingen. Blandbar i
alle forhold med vann og alkohol, tungt løselig i eter, kloroform,
karbontetraklorid og karbondisulfid. Smaker søtt. Meget viktig i biokjemien.
Alt fett er estere av glyserol og forskjellige fettsyrer. Mange lipider,
fettaktige stoffer, inneholder også glyserol, deriblant de viktige lecitinene.
Glyserol eller 1,2,3-propantriol,
også kalt glyserin, en fargeløs, tykk, sirupsaktig væske som stivner til
rombiske, plateformede krystaller. Tetthet 1,2613 g/cm3 (20 °C).
Smeltepunkt 20 °C, kokepunkt 290 °C, spaltes delvis under kokingen. Blandbar i
alle forhold med vann og alkohol, tungt løselig i eter, kloroform,
karbontetraklorid og karbondisulfid. Smaker søtt. Meget viktig i biokjemien.
Alt fett er estere av glyserol og forskjellige fettsyrer. Mange lipider,
fettaktige stoffer, inneholder også glyserol, deriblant de viktige lecitinene.
 Glukose eller druesukker, et
fargeløst, krystallinsk stoff med smeltepunkt 146 °C. Løses lett i vann og
alkohol, tungt i aceton. Smaker søtt, men langt fra så søtt som vanlig
rørsukker. Det vanligste monosakkaridet i naturen. De to andre er galaktose,
som er nokså likt glukose, men har de OH-gruppene som er tegnet ytterst til
venstre og høyre på figuren over ringplanet i stedet for under, samt fruktose,
som også likner på glukose, men bare har fem atomer i ringen og en
hydroksymetylgruppe på begge nabokarbonene til ringoksygenet. Alle tre har lik
sammensetning med 6 C 12 H og 6 O. De kan slås sammen til disakkarider som
maltose med to enheter glukose, laktose med en glukose og en galaktose og det
vanlige rørsukkeret, som helst kalles sukrose, med en glukose og en fruktose.
Stivelse er glukose i lange kjeder, som er det vanlige glukoselagringsmediet i
planter. I dyr lagres glukose bl.a. i muskelvev som glykogen, kortere og mer
forgrenede kjeder. Cellulose er svært lange glukosekjeder som plantene bruker
til strukturoppbygning. Vektmessig er det mer cellulose i biosfæren enn av noen
annen karbonforbindelse. Glukose har også to stereoisomerer, en høyre- og en
venstredreiende. Bare den høyredreiende, som også kalles dekstrose, forekommer
i naturen. Ringen kan spaltes ved at hydrogenatomet på OH-gruppen lengst til
høyre på figuren overføres til ringoksygenet og karbonet til høyre avslutter
kjeden med en aldehydgruppe. Molekylet er fortsatt glukose, men nå i
aldoseform, ikke ringform.
Glukose eller druesukker, et
fargeløst, krystallinsk stoff med smeltepunkt 146 °C. Løses lett i vann og
alkohol, tungt i aceton. Smaker søtt, men langt fra så søtt som vanlig
rørsukker. Det vanligste monosakkaridet i naturen. De to andre er galaktose,
som er nokså likt glukose, men har de OH-gruppene som er tegnet ytterst til
venstre og høyre på figuren over ringplanet i stedet for under, samt fruktose,
som også likner på glukose, men bare har fem atomer i ringen og en
hydroksymetylgruppe på begge nabokarbonene til ringoksygenet. Alle tre har lik
sammensetning med 6 C 12 H og 6 O. De kan slås sammen til disakkarider som
maltose med to enheter glukose, laktose med en glukose og en galaktose og det
vanlige rørsukkeret, som helst kalles sukrose, med en glukose og en fruktose.
Stivelse er glukose i lange kjeder, som er det vanlige glukoselagringsmediet i
planter. I dyr lagres glukose bl.a. i muskelvev som glykogen, kortere og mer
forgrenede kjeder. Cellulose er svært lange glukosekjeder som plantene bruker
til strukturoppbygning. Vektmessig er det mer cellulose i biosfæren enn av noen
annen karbonforbindelse. Glukose har også to stereoisomerer, en høyre- og en
venstredreiende. Bare den høyredreiende, som også kalles dekstrose, forekommer
i naturen. Ringen kan spaltes ved at hydrogenatomet på OH-gruppen lengst til
høyre på figuren overføres til ringoksygenet og karbonet til høyre avslutter
kjeden med en aldehydgruppe. Molekylet er fortsatt glukose, men nå i
aldoseform, ikke ringform.
 Dietyleter, etyleter eller bare
eter, en flyktig, meget ildsfarlig fargeløs væske med tetthet 0,71378 g/cm3
(20 °C), sm.p. -116,2 °C, kok.p. 34,51 °C. Blandbar i alle forhold med alkohol,
benzen og kloroform, løses lett i aceton, men meget tungt i vann. Løser mange
organiske substanser som fett, oljer, harpiks o.l. og er p.g.a. den dårlige
blandbarheten med vann mye brukt som ekstraksjonsmiddel. Eterdamper i
luftblanding er eksplosive. Danner peroksyder når den utsettes for lys, og
disse er også eksplosive og giftige. Virker bedøvende og har vært brukt i
medisinen. Eter koker på hånden, og med en fordampningsvarme på 391 J/g føles
det iskaldt å dryppe en eterdråpe på huden og la den koke vekk.
Dietyleter, etyleter eller bare
eter, en flyktig, meget ildsfarlig fargeløs væske med tetthet 0,71378 g/cm3
(20 °C), sm.p. -116,2 °C, kok.p. 34,51 °C. Blandbar i alle forhold med alkohol,
benzen og kloroform, løses lett i aceton, men meget tungt i vann. Løser mange
organiske substanser som fett, oljer, harpiks o.l. og er p.g.a. den dårlige
blandbarheten med vann mye brukt som ekstraksjonsmiddel. Eterdamper i
luftblanding er eksplosive. Danner peroksyder når den utsettes for lys, og
disse er også eksplosive og giftige. Virker bedøvende og har vært brukt i
medisinen. Eter koker på hånden, og med en fordampningsvarme på 391 J/g føles
det iskaldt å dryppe en eterdråpe på huden og la den koke vekk.
 Eukalyptol eller cajeputol eller
1,8-cineol, en seig, fargeløs væske med tetthet 0,9267 g/cm3 (20 °C),
frysepunkt 1 °C og kokepunkt 176,4 °C. Uløselig i vann, men løses i alkohol,
eter og kloroform, samt i fett. Har sterk og behagelig lukt og smak. Et av
mange virksomme stoffer i eukalyptusolje som finnes i barken og bladene på trær
av eukalyptusfamilien og er anerkjent og mye brukt både i natur- og
skolemedisinen, særlig som slimløsende middel ved forkjølelse og bronkitt.
Drypp et par dråper i en bolle med varmt vann, legg et håndkle over hodet og
rundt bollen og dra inn!
Eukalyptol eller cajeputol eller
1,8-cineol, en seig, fargeløs væske med tetthet 0,9267 g/cm3 (20 °C),
frysepunkt 1 °C og kokepunkt 176,4 °C. Uløselig i vann, men løses i alkohol,
eter og kloroform, samt i fett. Har sterk og behagelig lukt og smak. Et av
mange virksomme stoffer i eukalyptusolje som finnes i barken og bladene på trær
av eukalyptusfamilien og er anerkjent og mye brukt både i natur- og
skolemedisinen, særlig som slimløsende middel ved forkjølelse og bronkitt.
Drypp et par dråper i en bolle med varmt vann, legg et håndkle over hodet og
rundt bollen og dra inn!
 Formaldehyd eller metanal er en
fargeløs gass med stikkende lukt. Smeltepunkt -92 °C og kokepunkt -21 °C.
Tetthet 0,815 g/cm3 ved kokepunktet. Blandbar i alle forhold med
eter, aceton og benzen. Løselig også i vann, alkohol og kloroform. En vanligvis
ca. 40 % vannløsning kalles formalin og brukes mye som desinfeksjons- og
konserveringsmiddel. Giftig. Kan lett polymeriseres, enten til rader med
metoksygrupper avsluttet av en aldehydgruppe, eksempel: CH3OCH2OCH2OCHO,
eller i basisk miljø til blandinger av forskjellige karbohydrater. De førstnevnte
polymerene kalles også polyoksymetylener og brukes til desinfaksjon ved at de
spaltes til formaldehyd ved oppvarming, iallfall hvis kjedene er litt lengre
enn den ovennevnte.
Formaldehyd eller metanal er en
fargeløs gass med stikkende lukt. Smeltepunkt -92 °C og kokepunkt -21 °C.
Tetthet 0,815 g/cm3 ved kokepunktet. Blandbar i alle forhold med
eter, aceton og benzen. Løselig også i vann, alkohol og kloroform. En vanligvis
ca. 40 % vannløsning kalles formalin og brukes mye som desinfeksjons- og
konserveringsmiddel. Giftig. Kan lett polymeriseres, enten til rader med
metoksygrupper avsluttet av en aldehydgruppe, eksempel: CH3OCH2OCH2OCHO,
eller i basisk miljø til blandinger av forskjellige karbohydrater. De førstnevnte
polymerene kalles også polyoksymetylener og brukes til desinfaksjon ved at de
spaltes til formaldehyd ved oppvarming, iallfall hvis kjedene er litt lengre
enn den ovennevnte.
 2-pentyl-3-fenylpropenal eller
1-fenyl-1-hepten-2-karboksaldehyd eller a
-m-amyl-kanelaldehyd eller jasminaldehyd. Oljeaktig, ytterst velluktende væske
med tetthet 0,9718 g/cm3 (20 °C) og kokepunkt 174-175 °C. Uløselig i
vann, men løses i alkohol og eter. Forekommer i naturen som duftstoff i
blomstene til jasminium grandiflorium fra Himalaya og jasminium odoratissimum
fra Madeira og Kanariøyene, kan utvinnes i produktet jasminolje og brukes mye i
parfymeindustrien.
2-pentyl-3-fenylpropenal eller
1-fenyl-1-hepten-2-karboksaldehyd eller a
-m-amyl-kanelaldehyd eller jasminaldehyd. Oljeaktig, ytterst velluktende væske
med tetthet 0,9718 g/cm3 (20 °C) og kokepunkt 174-175 °C. Uløselig i
vann, men løses i alkohol og eter. Forekommer i naturen som duftstoff i
blomstene til jasminium grandiflorium fra Himalaya og jasminium odoratissimum
fra Madeira og Kanariøyene, kan utvinnes i produktet jasminolje og brukes mye i
parfymeindustrien.

 Vinsyre eller
2,3-dihydroksybutandisyre. Et hvitt, krystallinsk stoff med tetthet 1,7598 g/cm3,
smeltepunkt 171-174 °C. Lett løselig i vann og alkohol, tungt i eter, løselig
også i aceton, ikke løselig i benzen. Vinsyre viser også stereoisomeri, dataene
over gjelder for den høyredreiende, d-vinsyre, som er den vanligste i naturen.
Druesyre er en racemisk, optisk inaktiv blanding av både d- og l-vinsyre, som i
sammen med den rene høyredreiende er vanlig i saften av mange planter, særlig
druer. Meso-vinsyre er en tredje form som er symmetrisk om et plan og derfor heller
ikke er optisk aktiv. Estere og salter av vinsyre kalles tartrater og flere
salter har vært kjent fra gammel tid. Alle planter er rike på kalium og siden
kaliumhydrogentartrat er lite løselig i en vann-alkoholblanding gir det en
utfelling som kalles vinstein når druesaft gjærer. Brekkvinstein er
kalium-antimonyltartrat som siden 1600-tallet har vært brukt som brekkmiddel
mot forgiftning. Seignettes salt er et natrium-kaliumtartrat og lages ved å
behandle vinstein med natronlut.
Vinsyre eller
2,3-dihydroksybutandisyre. Et hvitt, krystallinsk stoff med tetthet 1,7598 g/cm3,
smeltepunkt 171-174 °C. Lett løselig i vann og alkohol, tungt i eter, løselig
også i aceton, ikke løselig i benzen. Vinsyre viser også stereoisomeri, dataene
over gjelder for den høyredreiende, d-vinsyre, som er den vanligste i naturen.
Druesyre er en racemisk, optisk inaktiv blanding av både d- og l-vinsyre, som i
sammen med den rene høyredreiende er vanlig i saften av mange planter, særlig
druer. Meso-vinsyre er en tredje form som er symmetrisk om et plan og derfor heller
ikke er optisk aktiv. Estere og salter av vinsyre kalles tartrater og flere
salter har vært kjent fra gammel tid. Alle planter er rike på kalium og siden
kaliumhydrogentartrat er lite løselig i en vann-alkoholblanding gir det en
utfelling som kalles vinstein når druesaft gjærer. Brekkvinstein er
kalium-antimonyltartrat som siden 1600-tallet har vært brukt som brekkmiddel
mot forgiftning. Seignettes salt er et natrium-kaliumtartrat og lages ved å
behandle vinstein med natronlut.
 Benzylacetat eller eddiksyrebenzylester,
en fargeløs væske som lukter fersken. Tetthet 1,0550 g/cm3 (20 °C),
smeltepunkt -51,5 °C, kokepunkt 215,5 °C. Blandbar i alle forhold med alkohol,
løselig også i eter og aceton, tungt løselig i vann. Finnes ikke overraskende i
naturen i ferskener og er årsaken til den karakteristiske aromaen.
Benzylacetat eller eddiksyrebenzylester,
en fargeløs væske som lukter fersken. Tetthet 1,0550 g/cm3 (20 °C),
smeltepunkt -51,5 °C, kokepunkt 215,5 °C. Blandbar i alle forhold med alkohol,
løselig også i eter og aceton, tungt løselig i vann. Finnes ikke overraskende i
naturen i ferskener og er årsaken til den karakteristiske aromaen.
 Østron, follikulin,
ketohydroksyøstrin eller 1,3,5-østratrien-3-ol-17-on. Et hvitt, krystallinsk
stoff med tetthet 1,236 g/cm3 og smeltepunkt 260-262 °C. Løselig i
aceton, dioksan og pyrimidin, tungt løselig i alkohol, eter, benzen og
kloroform, uløselig i vann. Forekommer i kvinner (særlig når de er villige) -
et hormon som regulerer menstruasjons- og brunstsyklusen for alt hunkjønn i
verden. Et av østrogenene, som også omfatter østriol og østradiol, alle kjemisk
nært beslektede stoffer som tilhører steroidene, en stor familie kjemikalier
med bl.a. hormonelle funksjoner.
Østron, follikulin,
ketohydroksyøstrin eller 1,3,5-østratrien-3-ol-17-on. Et hvitt, krystallinsk
stoff med tetthet 1,236 g/cm3 og smeltepunkt 260-262 °C. Løselig i
aceton, dioksan og pyrimidin, tungt løselig i alkohol, eter, benzen og
kloroform, uløselig i vann. Forekommer i kvinner (særlig når de er villige) -
et hormon som regulerer menstruasjons- og brunstsyklusen for alt hunkjønn i
verden. Et av østrogenene, som også omfatter østriol og østradiol, alle kjemisk
nært beslektede stoffer som tilhører steroidene, en stor familie kjemikalier
med bl.a. hormonelle funksjoner.
 Etylmerkaptan, etantiol, også
kalt etylhydrosulfid og etyltioalkohol. En fargeløs, flyktig væske med en lukt
som ikke lett glemmes. Tetthet 0,8391 g/cm3 (20 °C), smeltepunkt
-144,4 °C, kokepunkt 35 °C. Løses i alkohol, eter, aceton og fortynnede baser.
Bare tungt løselig i vann.
Etylmerkaptan, etantiol, også
kalt etylhydrosulfid og etyltioalkohol. En fargeløs, flyktig væske med en lukt
som ikke lett glemmes. Tetthet 0,8391 g/cm3 (20 °C), smeltepunkt
-144,4 °C, kokepunkt 35 °C. Løses i alkohol, eter, aceton og fortynnede baser.
Bare tungt løselig i vann.
 Anilin, fenylamin eller
aminobenzen, en fargeløs, giftig væske med eiendommelig lukt og skarp,
brennende smak. Tetthet 1,02173 g/cm3 (20 °C), smeltepunkt -6,3 °C,
kokepunkt 184,13 °C. Blandbar i alle forhold med alkohol, eter, aceton og
benzen. Løselig også i vann, kloroform og nafta. Blir ofte brunfarget av forurensninger
hvis den blir stående. Danner krystallinske salter med syrer, f.eks.
anilinklorid, C6H5NH3Cl, også kalt anilinsalt.
Utgangspunkt for en mengde industriprodukter, fargestoffer, plaster, medisiner
etc.
Anilin, fenylamin eller
aminobenzen, en fargeløs, giftig væske med eiendommelig lukt og skarp,
brennende smak. Tetthet 1,02173 g/cm3 (20 °C), smeltepunkt -6,3 °C,
kokepunkt 184,13 °C. Blandbar i alle forhold med alkohol, eter, aceton og
benzen. Løselig også i vann, kloroform og nafta. Blir ofte brunfarget av forurensninger
hvis den blir stående. Danner krystallinske salter med syrer, f.eks.
anilinklorid, C6H5NH3Cl, også kalt anilinsalt.
Utgangspunkt for en mengde industriprodukter, fargestoffer, plaster, medisiner
etc.
 2,4,6-trinitrotoluen, TNT, også
kalt trinitrotoluol, trinol og trotyl. Et lysegult, krystallinsk stoff med
tetthet 1,654 g/cm3, som smelter ved 82 °C og eksploderer ved 240
°C. Lett løselig i aceton, benzen, toluen og pyrimidin, løses også i eter og
varm alkohol, tungt løselig i kald, uløselig i vann. Det lave smeltepunktet
gjør stoffet lettere å støpe og forme enn andre sprengstoffer. TNT er et av de
mest ulykksalige kjemiske stoffer, et kraftig sprengstoff som hovedsakelig har
hatt militært bruk. Det dominerende sprengstoffet i bomber, miner, torpedoer og
granater i begge de to verdenskrigene.
2,4,6-trinitrotoluen, TNT, også
kalt trinitrotoluol, trinol og trotyl. Et lysegult, krystallinsk stoff med
tetthet 1,654 g/cm3, som smelter ved 82 °C og eksploderer ved 240
°C. Lett løselig i aceton, benzen, toluen og pyrimidin, løses også i eter og
varm alkohol, tungt løselig i kald, uløselig i vann. Det lave smeltepunktet
gjør stoffet lettere å støpe og forme enn andre sprengstoffer. TNT er et av de
mest ulykksalige kjemiske stoffer, et kraftig sprengstoff som hovedsakelig har
hatt militært bruk. Det dominerende sprengstoffet i bomber, miner, torpedoer og
granater i begge de to verdenskrigene.
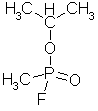 Sarin eller
isopropyl-metylfluorofosfonat er en fargeløs og luktløs væske med smeltepunkt
-56 °C, kokepunkt 147 °C og tetthet 1,089 g/cm3. Blandbar i alle
forhold med vann. Meget giftig. Inaktiverer enzymet acetylcholinesterase, som
hindrer blokkering av nerveimpulser. Brukt som nervegass i krig av Irak og i
terrorangrep av den japanske sekten Aum Shinrikyo. Oppdaget i Tyskland 1939 og
satt i masseproduksjon like før krigens slutt. Forbindelsen pyridin-2-aldoksim-metjodid
(PAM) ble utviklet spesielt som motgift mot sarin.
Sarin eller
isopropyl-metylfluorofosfonat er en fargeløs og luktløs væske med smeltepunkt
-56 °C, kokepunkt 147 °C og tetthet 1,089 g/cm3. Blandbar i alle
forhold med vann. Meget giftig. Inaktiverer enzymet acetylcholinesterase, som
hindrer blokkering av nerveimpulser. Brukt som nervegass i krig av Irak og i
terrorangrep av den japanske sekten Aum Shinrikyo. Oppdaget i Tyskland 1939 og
satt i masseproduksjon like før krigens slutt. Forbindelsen pyridin-2-aldoksim-metjodid
(PAM) ble utviklet spesielt som motgift mot sarin.
 Serin eller
2-amino-3-hydroksypropionsyre. Krystalliserer i heksagonale prismer eller nåler
med tetthet ca. 1,6 g/cm3, som dekomponerer ved oppvarming til 228
°C. Løses lett i vann, uløselig i alkohol, eter, benzen og eddiksyre. En
aminosyre som har særlig viktige funksjoner i fosfoproteiner hvor
fosfatgruppene forestres til OH-gruppene i seriner, og i glykoproteiner hvor
karbohydrater bindes til disse OH-gruppene. Inngår også i noen fosfolipider
hvor den går med til syntesen av sfingosin, som har flere viktige funksjoner i
nervesystemets kjemi.
Serin eller
2-amino-3-hydroksypropionsyre. Krystalliserer i heksagonale prismer eller nåler
med tetthet ca. 1,6 g/cm3, som dekomponerer ved oppvarming til 228
°C. Løses lett i vann, uløselig i alkohol, eter, benzen og eddiksyre. En
aminosyre som har særlig viktige funksjoner i fosfoproteiner hvor
fosfatgruppene forestres til OH-gruppene i seriner, og i glykoproteiner hvor
karbohydrater bindes til disse OH-gruppene. Inngår også i noen fosfolipider
hvor den går med til syntesen av sfingosin, som har flere viktige funksjoner i
nervesystemets kjemi.



 Pyrimidin, også kalt miazin eller
1,3-diazin. En fargeløs væske eller krystallinsk stoff med en ubehagelig,
gjennomtrengende lukt. Smeltepunkt 22 °C, kokepunkt 123,5-124 °C. Blandbar med
vann i alle forhold og gir basiske løsninger. Løses også i alkohol. Danner
skjelettet til en rekke biologisk og på andre måter viktige stoffer, blant
annet uracil eller pyrimidin-2,4-dion, thymin (5-metyluracil) og cytosin
(6-aminouracil), som inngår i nukleinsyrer.
Pyrimidin, også kalt miazin eller
1,3-diazin. En fargeløs væske eller krystallinsk stoff med en ubehagelig,
gjennomtrengende lukt. Smeltepunkt 22 °C, kokepunkt 123,5-124 °C. Blandbar med
vann i alle forhold og gir basiske løsninger. Løses også i alkohol. Danner
skjelettet til en rekke biologisk og på andre måter viktige stoffer, blant
annet uracil eller pyrimidin-2,4-dion, thymin (5-metyluracil) og cytosin
(6-aminouracil), som inngår i nukleinsyrer.
 Purin eller
7-imidazo[4,5-d]pyrimidin. Et krystallinsk stoff med smeltepunkt 216-217 °C.
Løses lett i vann og varm alkohol, løses også i aceton. Tungt løselig i eter og
kloroform. Gir basisk reaksjon. Danner skjelettet til en stor mengde særlig
biologisk viktige stoffer. Adenin (6-aminopurin) og guanin
(6-hydroksy-2-aminopurin) som inngår i nukleinsyrer og noen viktige nukleotider
er av særlig betydning, men også urinsyre (2,6-dihydroksypurin-8-on) et
nedbrytningsprodukt av nukleinsyrer, xantin (purin-2,6-dion) et mellomstadium i
denne nedbrytingen, teobromin (3,7-dimetylxantin) som finnes i kakaobønner, og
koffein (1,3,7-trimetylxantin), som finnes i te og kaffe. Sjekk tallene på
tegningen og se hvor de forskjellige substituentene sitter i de forskjellige
stoffene. Merk at dobbeltbindingen mellom 7 og 8 er flyttet til plassen mellom
8 og 9 i noen av dem slik at det er 7'er-nitrogenet som har plass til en
substituent i stedet for 9'eren.
Purin eller
7-imidazo[4,5-d]pyrimidin. Et krystallinsk stoff med smeltepunkt 216-217 °C.
Løses lett i vann og varm alkohol, løses også i aceton. Tungt løselig i eter og
kloroform. Gir basisk reaksjon. Danner skjelettet til en stor mengde særlig
biologisk viktige stoffer. Adenin (6-aminopurin) og guanin
(6-hydroksy-2-aminopurin) som inngår i nukleinsyrer og noen viktige nukleotider
er av særlig betydning, men også urinsyre (2,6-dihydroksypurin-8-on) et
nedbrytningsprodukt av nukleinsyrer, xantin (purin-2,6-dion) et mellomstadium i
denne nedbrytingen, teobromin (3,7-dimetylxantin) som finnes i kakaobønner, og
koffein (1,3,7-trimetylxantin), som finnes i te og kaffe. Sjekk tallene på
tegningen og se hvor de forskjellige substituentene sitter i de forskjellige
stoffene. Merk at dobbeltbindingen mellom 7 og 8 er flyttet til plassen mellom
8 og 9 i noen av dem slik at det er 7'er-nitrogenet som har plass til en
substituent i stedet for 9'eren.
 Adenin eller 6-aminopurin
krystalliserer i blad eller nåler, sublimerer ved 220 °C og dekomponerer ved
360-365 °C. Lett løselig i syrer og baser og varmt vann. Tungt løselig i kaldt
vann og alkohol. Uløselig i eter og kloroform. Reagerer basisk i vann. Viktig
del av arvestoffet (nukleinsyrer) og energiomsetningen (ATP). Finnes også fritt
i noen planter, teblad, sukkerroer og humle. Kan dannes spontant av blåsyre
under visse betingelser.
Adenin eller 6-aminopurin
krystalliserer i blad eller nåler, sublimerer ved 220 °C og dekomponerer ved
360-365 °C. Lett løselig i syrer og baser og varmt vann. Tungt løselig i kaldt
vann og alkohol. Uløselig i eter og kloroform. Reagerer basisk i vann. Viktig
del av arvestoffet (nukleinsyrer) og energiomsetningen (ATP). Finnes også fritt
i noen planter, teblad, sukkerroer og humle. Kan dannes spontant av blåsyre
under visse betingelser.
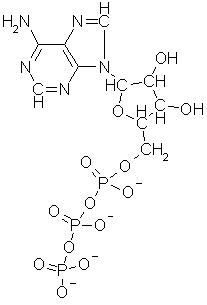 Adenosintrifosfat, ATP. Formen
til venstre eksisterer i basisk løsning. I sur løsning er ikke fosfatenhetene
ioniserte og har hydrogenatomer på de markerte oksygenene, mens nitrogenene på
adeninringen tar opp hydrogen og opptrer kationisk. Men i nøytral løsning slik
som i kroppsvæskene er begge deler ioniserte, med protoner fra fosfatenhetene
overført til nitrogenene. På denne måten er ATP selvioniserende, slik som
aminosyrene, og det har som dem god vannløselighet. Det kan renfremstilles som
en gråhvit, geléaktig masse. ATP er et nukleotid, og er sammensatt av adenosin,
en forbindelse av adenin og sukkerarten ribose, pluss tre fosfatenheter. Det
spesielle med ATP er at hvis det ytterste leddet av fosfatkjeden hydrolyseres
slik at en vanlig ortofosfatgruppe kommer løs, slippes det fri hele 30,5 kJ/mol
fri energi. Årsaken til dette er delvis det at fosfatenhetene som nevnt er
ioniserte og likt ladet, slik at de frastøter hverandre, og delvis det at en
fri ortofosfatenhet har fire likeverdige resonansformer, mens trifosfatet bare
har en usannsynlig en i tillegg til den som er tegnet over. Hvis man da har en
reaksjon tilgjengelig som kan avgi 30,5 kJ/mol eller mer, har man da en fin
mulighet til å lagre energi som en ATP-enhet og transportere den i vannløselig
form. Dette benytter da også du og jeg og alle vi levende organismer oss av.
ATP er den universelle energi-"valutaen" for alt liv, fra virus til
blåhvaler. Hver gang kroppen har behov for at en eller annen reaksjon skal
skje, f.eks. de som fører til at muskler trekker seg sammen eller til at celler
deler seg, dannes det så mange ATP som trengs ved energilagrene, glykogen,
blodsukker eller fett, og transporteres dit det er behov for dem. For alle
energikrevende reaksjoner som biokjemikerne har oversikt over kjenner de også
"kostnadene" i form av hvor mange enheter ATP som brukes til å få dem
til å gå, og de vet også hvor mye ATP som dannes ved de reaksjonene som brukes
til energiinnvinning, f.eks. ved fotosyntesen eller fordøyelsen. Arvestoff
består også av nukleotider, nokså like ATP i strukturen, og er trolig utviklet
fra ATP.
Adenosintrifosfat, ATP. Formen
til venstre eksisterer i basisk løsning. I sur løsning er ikke fosfatenhetene
ioniserte og har hydrogenatomer på de markerte oksygenene, mens nitrogenene på
adeninringen tar opp hydrogen og opptrer kationisk. Men i nøytral løsning slik
som i kroppsvæskene er begge deler ioniserte, med protoner fra fosfatenhetene
overført til nitrogenene. På denne måten er ATP selvioniserende, slik som
aminosyrene, og det har som dem god vannløselighet. Det kan renfremstilles som
en gråhvit, geléaktig masse. ATP er et nukleotid, og er sammensatt av adenosin,
en forbindelse av adenin og sukkerarten ribose, pluss tre fosfatenheter. Det
spesielle med ATP er at hvis det ytterste leddet av fosfatkjeden hydrolyseres
slik at en vanlig ortofosfatgruppe kommer løs, slippes det fri hele 30,5 kJ/mol
fri energi. Årsaken til dette er delvis det at fosfatenhetene som nevnt er
ioniserte og likt ladet, slik at de frastøter hverandre, og delvis det at en
fri ortofosfatenhet har fire likeverdige resonansformer, mens trifosfatet bare
har en usannsynlig en i tillegg til den som er tegnet over. Hvis man da har en
reaksjon tilgjengelig som kan avgi 30,5 kJ/mol eller mer, har man da en fin
mulighet til å lagre energi som en ATP-enhet og transportere den i vannløselig
form. Dette benytter da også du og jeg og alle vi levende organismer oss av.
ATP er den universelle energi-"valutaen" for alt liv, fra virus til
blåhvaler. Hver gang kroppen har behov for at en eller annen reaksjon skal
skje, f.eks. de som fører til at muskler trekker seg sammen eller til at celler
deler seg, dannes det så mange ATP som trengs ved energilagrene, glykogen,
blodsukker eller fett, og transporteres dit det er behov for dem. For alle
energikrevende reaksjoner som biokjemikerne har oversikt over kjenner de også
"kostnadene" i form av hvor mange enheter ATP som brukes til å få dem
til å gå, og de vet også hvor mye ATP som dannes ved de reaksjonene som brukes
til energiinnvinning, f.eks. ved fotosyntesen eller fordøyelsen. Arvestoff
består også av nukleotider, nokså like ATP i strukturen, og er trolig utviklet
fra ATP.
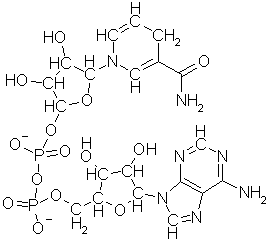 Nikotinamid-adenin-dinukleotid
eller blant venner NAD. Også en forbindelse som er beslektet med og
sannsynligvis har utviklet seg fra ATP. Spiller en stor rolle i mange
stoffskifteprosesser, som hydriddonor. Nikotinamidringen øverst avgir lett det
ene av hydrogenatomene til høyre fordi ringen dermed kan resonansstabiliseres,
med (billedlig) annenhver dobbelt- og enkeltbinding som i en benzenring.
Nitrogenet til venstre i ringen får dermed fire bindinger og blir positivt
ladet. Formen som er avbildet her betegnes som NADH, mens den kalles NAD+ etter
å ha avgitt et hydrogen. NAD er derfor ikke en syre, som avgir positivt ladde
hydrogen og blir negativt selv, her er ladningsforholdene motsatt. NAD er
særlig viktig i redoksprosessene i kroppen, hvorav de energigivende
respirasjonsprosessene er noen av de viktigste. NADH kan redusere ketoner og
aldehyder til alkoholer mens NAD+ oksyderer. Mange giftige og kreftfremkallende
stoffer nøytraliseres av NAD i kroppens egne forsvarsmekanismer.
Nikotinamid-adenin-dinukleotid
eller blant venner NAD. Også en forbindelse som er beslektet med og
sannsynligvis har utviklet seg fra ATP. Spiller en stor rolle i mange
stoffskifteprosesser, som hydriddonor. Nikotinamidringen øverst avgir lett det
ene av hydrogenatomene til høyre fordi ringen dermed kan resonansstabiliseres,
med (billedlig) annenhver dobbelt- og enkeltbinding som i en benzenring.
Nitrogenet til venstre i ringen får dermed fire bindinger og blir positivt
ladet. Formen som er avbildet her betegnes som NADH, mens den kalles NAD+ etter
å ha avgitt et hydrogen. NAD er derfor ikke en syre, som avgir positivt ladde
hydrogen og blir negativt selv, her er ladningsforholdene motsatt. NAD er
særlig viktig i redoksprosessene i kroppen, hvorav de energigivende
respirasjonsprosessene er noen av de viktigste. NADH kan redusere ketoner og
aldehyder til alkoholer mens NAD+ oksyderer. Mange giftige og kreftfremkallende
stoffer nøytraliseres av NAD i kroppens egne forsvarsmekanismer.



fire bokstaver i
alfabetet, en for hver base, A=adenin, C=cytosin, G=guanin, T=thymin.
Bokstavene grupperes tre og tre i ord, også kalt kodoner, slik at det kan
dannes 4*4*4=64 forskjellige kombinasjoner av baser i kodonene. Som i
menneskespråket er det ikke alle de mulige bokstavkombinasjonene i ordene som
benyttes. Det er bare 20 aminosyrer, og de fleste av de 44 kodonene som er til
overs fungerer som ekstrakodoner for en av de 20. Dermed fås en viss
beskyttelse mot mutasjoner, siden det ikke nødvendigvis alltid byttes ut en
aminosyre når en base blir forandret. Den korte DNA-sekvensen på tegningen over
koder for de to siste aminosyrene i det før beskrevne kveg-insulinet, de to
øverste på illustrasjonen. Det er kjeden til høyre på tegningen her som har
kodonene. De til venstre kalles antikodoner og fungerer som mal for nye kodoner
når dobbeltspiralen splittes opp for å dupliseres ved celledelingen. Det første
kodonet er AAA, de tre øverste nukleotidene, alle med basen adenin, og det
koder for aminosyren lysin, NH2CH[(CH2)4NH2]COOH.
De tre neste er GCA, som koder for alanin, NH2CH(CH3)COOH,
mens de tre siste er TAG, som koder for slutt. Insulin er et ganske lite
protein, men med sine 51 proteiner trenger det 153 kodoner i genet som det
bygges etter. Det gir genet en molekylvekt på drøye 90000. For proteiner av mer
gjennomsnittlig størrelse er det tidobbelte ingen umulighet, og et kromosom,
som består av en sammenhengende rekke gener kan ha molekylvekter på flere
millioner eller en absoluttvekt på over et hundre tusendels picogram for et
eneste molekyl. DNA kan renfremstilles som skinnende gråhvite tråder som er
løselige i vann, men ikke i alkohol, og kan nøstes opp utfelt fra en
alkoholløsning.
BIOLOGI
Karbon er livets essens. Intet liv på denne kloden kan klare seg uten det og
trolig heller ikke noe liv på noen andre kloder. Stabiliteten av de kovalente
bindingene mellom karbonatomer og hydrogen, nitrogen, oksygen, svovel og ikke
minst mellom dem og andre karbonatomer og de enorme variasjoner av forbindelser
med enkle og doble bindinger, alifatiske kjeder og aromatiske ringer,
karboksylsyrer, aminer og andre aktive grupper gir en rikdom av
oppbygningsmuligheter som ingen andre grunnstoffer kan stille opp med.
Karbonkretsløpet i naturen
starter med karbondioksyd som frigjøres i vulkanutbrudd eller oksydasjon av
uorganiske eller organiske karbonholdige materialer. Gjennom fotosyntesen i
alger og grønne landplanter konverteres det til enkle karbohydrater som er
energikilde for plantene og utgangspunkt for syntese av andre stoffer.
Overskuddsenergien lagres som fett og polysakkarider som spises av dyr, og
dyrene omdanner dem videre til andre former. Både dyr og planter forbrenner
sukker og andre stoffer ved respirasjonen og returnerer noe av det karbonet de
har inntatt som karbondioksyd til lufta igjen. Resten utsondres som
avfallsstoffer, og når livet er slutt blir organismen selv et avfallsstoff som
spises av insekter og bakterier, men som også kan gå ut av kretsløpet hvis de
avleires på steder hvor insektene og bakteriene ikke kan få tak i dem.
Noen av disse
avleiringene kan så komme ned i Jordas indre igjen i subduksjonssoner hvor en
jordskorpeplate skyves under en annen og flyte rundt i mantelen til karbonet
sprøytes ut av en vulkan som karbondioksyd eller karbonatittlava igjen. Andre
ganger kan det hende at avleiringer som har vært utenfor kretsløpet i lengre
eller kortere tid kommer inn i det igjen ved at en organisme får tak i dem og
utnytter dem på en eller annen måte. Dette skjer i stor stil i våre dager.
Hva er små gutter laget
av? Inne i hver eneste av cellene til lille Emil ligger svaret, for i
cellekjernene er arbeidstegningene som forteller hvordan små gutter skal
bygges. Lille Emil er ikke laget av drops, sjokolade og salte peanøtter, nei.
For de samme arbeidstegningene forteller også hvordan drops, sjokolade, salte
peanøtter, potetgull, kakaomelk, pølser med lompe, Urge og andre godterier skal
forvandles til det som lille Emil er laget av.
I en eukaryotisk
organisme som Emil er cellene omgitt av en membran, og de inneholder også en
kjerne som er omgitt av samme type membran. Det er inne i denne kjernen at
arbeidstegningene befinner seg, kromosomene. Kromosomene varierer i form og
antall fra livsform til livsform. Emil har 46 stykker av dem. I kromosomene er
nukleinsyre (latin nucleus = kjerne), DNA (deoksyribonukleinsyre), viklet opp
på basiske proteiner som kalles histoner og har holdt seg forbløffende
uforandret gjennom livets utviklingshistorie, en av de 5 histontypene i erter
skiller seg fra det samme histonet i kveg på bare 2 av de 102 aminosyrene.
Nukleinsyren og histonet sammen kalles kromatin, og fordeler seg i klumper som
kalles nukleosomer. Nukleosomene er igjen stablet til kromosomer på en måte som
ikke er helt godt kjent, muligens som en spiral rundt en sentral proteinkjerne.
Dette arrangementet brukes av alle kjente kjerneceller.
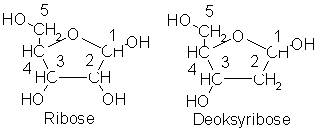 Nukleinsyrer består av lange
kjeder av nukleotider. Et nukleotid består av en sukkerart, ribose eller
deoksyribose, koblet sammen med en fosfatgruppe forestret i 5-posisjonene, og
med en heterosyklisk nitrogenbase koblet til posisjon 1. En sammensetning av
bare base og sukker kalles nukleosid. Når nukleotidene kobles sammen til
nukleinsyrer forestres OH-gruppen i 3-posisjonen i sukkeret med fosfatgruppen i
det neste nukleotidet. Kjeden har altså to forskjellige ender, en hvor det
sitter en fosfatgruppe på et sukker i 5-posisjonen og en hvor en OH-gruppe i
3-posisjonen til et sukker er fri.
Nukleinsyrer består av lange
kjeder av nukleotider. Et nukleotid består av en sukkerart, ribose eller
deoksyribose, koblet sammen med en fosfatgruppe forestret i 5-posisjonene, og
med en heterosyklisk nitrogenbase koblet til posisjon 1. En sammensetning av
bare base og sukker kalles nukleosid. Når nukleotidene kobles sammen til
nukleinsyrer forestres OH-gruppen i 3-posisjonen i sukkeret med fosfatgruppen i
det neste nukleotidet. Kjeden har altså to forskjellige ender, en hvor det
sitter en fosfatgruppe på et sukker i 5-posisjonen og en hvor en OH-gruppe i
3-posisjonen til et sukker er fri.
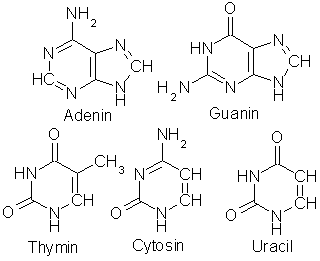 Det er basene som er det variable
og informasjonsbærende elementet i nukleinsyrene. I DNA er det bare fire
forskjellige, to purinliknende, adenin og guanin, og to pyrimidinliknende,
thymin og cytosin. RNA er en annen slags nukleinsyre (ribonukleinsyre), som
inneholder ribose i stedet for deoksyribose og bruker uracil i stedet for
thymin. I hver base er det det nederste hydrogenet på tegningen som er koblet
til sukkermolekylet. Nukleosider som er bygd opp av base og ribose heter
adenosin, guanidin, thymidin, cytidin og uridin, og navnet på nukleotidene som
også inneholder fosfat fås bare ved å legge til leddet -fosfat, adenosinfosfat,
guanidinfosfat o.s.v. I DNA er nukleosidene sammensatt av base og dekosyribose
og heter deoksyadenosin, deoksyguanosin, deoksythymidin og deoksycytidin, og de
fosforylerte nukleotidene heter deoksyadenosinfosfat, deoksyguanosinfosfat
o.s.v. Men når nukleotidene er koblet sammen til nukleinsyrer betegner man dem
gjerne med forbokstavene til basene, A, G, T og C i DNA og A, G, U og C i RNA.
I en nukleinsyrekjede er endepunktene forskjellige. Når man regner opp en
sekvens av nukleotider i en nukleinsyre begynner man alltid fra fosfatenden av
nukleinsyrekjeden, fordi det er denne retningen DNA bygges opp i under
celledelingen og den samme retningen bygges proteinene opp i under proteinsyntesen.
Det er basene som er det variable
og informasjonsbærende elementet i nukleinsyrene. I DNA er det bare fire
forskjellige, to purinliknende, adenin og guanin, og to pyrimidinliknende,
thymin og cytosin. RNA er en annen slags nukleinsyre (ribonukleinsyre), som
inneholder ribose i stedet for deoksyribose og bruker uracil i stedet for
thymin. I hver base er det det nederste hydrogenet på tegningen som er koblet
til sukkermolekylet. Nukleosider som er bygd opp av base og ribose heter
adenosin, guanidin, thymidin, cytidin og uridin, og navnet på nukleotidene som
også inneholder fosfat fås bare ved å legge til leddet -fosfat, adenosinfosfat,
guanidinfosfat o.s.v. I DNA er nukleosidene sammensatt av base og dekosyribose
og heter deoksyadenosin, deoksyguanosin, deoksythymidin og deoksycytidin, og de
fosforylerte nukleotidene heter deoksyadenosinfosfat, deoksyguanosinfosfat
o.s.v. Men når nukleotidene er koblet sammen til nukleinsyrer betegner man dem
gjerne med forbokstavene til basene, A, G, T og C i DNA og A, G, U og C i RNA.
I en nukleinsyrekjede er endepunktene forskjellige. Når man regner opp en
sekvens av nukleotider i en nukleinsyre begynner man alltid fra fosfatenden av
nukleinsyrekjeden, fordi det er denne retningen DNA bygges opp i under
celledelingen og den samme retningen bygges proteinene opp i under proteinsyntesen.
I et deoksynukleotid er
det bare en OH-gruppe på deoksyribosen som er ledig for sammenkobling, siden
1-eren er opptatt med basen og 5-eren er opptatt med nukleotidets egen
fosfatgruppe. Men i ribose er det ledige OH-grupper i både 2- og 3-posisjonen,
med større risiko for feil, og man kan spekulere om det er derfor DNA er brukt
i stedet for RNA til informasjonslagring i de fleste organismer. En fri
OH-gruppe kan også være utsatt for kjemiske angrep, og derfor kan også RNA sies
å være en anelse mindre stabil enn DNA, noe som kan bety mye i årmillionenes
løp. Det er bare noen virus som bruker RNA i stedet for DNA. Årsaken til at DNA
bruker thymin (5-metyluracil) i stedet for uracil har også med stabiliteten å
gjøre. Cytosin er litt ustabil og kan spontant miste aminogruppen og forvandles
til uracil. Denne skaden kunne ikke oppdages hvis uracil hørte naturlig hjemme
i DNA. Men siden DNA bruker thymin i stedet blir uracilet avslørt av det
naturlige DNA-politiet og byttet ut med cytosin igjen.
Med dette alfabetet på
bare fire bokstaver er altså hele konstruksjons- og funksjonsbeskrivelsen til
menneskekroppen og alle andre mulige og umulige kropper bygd opp. Det skjer ved
at disse fire bokstavene kombineres i grupper eller ord på tre bokstaver, et
kodon. Og disse kodonene, som det er 64 mulige av, koder for 20 forskjellige
aminosyrer som kan settes sammen til proteiner på et uendelig antall
forskjellige måter. Disse proteinene blir dermed utrolig fleksible og brukes
både til byggemateriale og som verktøy til å utføre alle mulige funksjoner i
livet.
I kromosomene ligger
DNAet alltid sammenkoblet i en dobbeltspiral med en annen streng DNA som har en
komplementær sekvens av nukleotider, der hvor det ene DNAet har A, G, T og C,
har det andre henholdsvis T, C, A og G. Derfor passer de nøyaktig inn i
hverandre og kan fungere som mal og støttepunkt for hverandre. To av disse
komplementære basene som passer inn i hverandre på hver sin komplementære
DNA-streng kalles et basepar. I dobbeltspiralen er de to enkeltstrengene koblet
motsatt vei, d.v.s. at i begge endepunktene slutter den ene med en OH-gruppe i
3-posisjonen på deoksyribosen mens den andre slutter med en fosfatgruppe på
5-karbonet i deoksyribosen.
Når en celle deler seg
trenger begge dattercellene en kopi av DNAet, og derfor vikles det opp under
celledelingen, de to strengene skilles fra hverandre og et enzymkompleks
syntetiserer to nye DNA-strenger som er komplementære med hver av de to andre.
Polymerisering av DNA skjer automatisk i en vannløsning som inneholder en enkel
DNA-streng, et DNA-polymerase-enzym og et godt utvalg frie nukleotider. Disse
råvarenukleotidene er trifosfater, og energien som fås ved å spalte av to
fosfatgrupper fungerer som drivkraft for reaksjonen.
I tarmbakterien Escherichia
Coli styres DNA-kopieringen eller replikasjonen av 8 proteiner. Det såkalte
rep-proteinet eller helikasen splitter opp dobbeltspiralen mens DNA-gyrase
løser opp de spenningene som oppstår i dobbeltspiralen når den vikles opp ved å
kutte av DNAet på egnede steder og skjøte det sammen igjen etter at det har
dreid seg rundt en omdreining. Gyrasen kan visstnok også hjelpe til med
oppsplittingen ved å kutte og dreie på DNAet slik at det oppstår nye spenninger
som får det til å vikle seg opp før det skjøtes sammen igjen. Når DNAet er
splittet, binder det såkalte SS-bindende proteinet seg til enkelttrådene slik
at de blir mer stabile. Fordi DNA-polymeraser er bygd for å sjekke det DNA-et
de har laget og derfor ikke kan starte fra ingenting lager en primase et stykke
RNA etter modell av DNA-tråden på signal fra det såkalte dnaB-proteinet.
DNA-polymerase III syntetiserer nytt DNA med RNA-sekvensen som startpunkt ved å
koble til et nukleotid som passer til modellen der det befinner seg. Deretter
sjekker det om det har gjort feil, og i såfall kobler det fra det gale
nukleotider og prøver igjen. DNA-polymerase I fjerner RNA-sekvensen når det
ikke er bruk for den lenger og fyller igjen de åpningene som blir igjen etter
den. Fordi de to DNA-strengene i dobbeltspiralen er koblet motsatt og
DNA-polymerase III bare kan lage DNA i 3 til 5-retningen kan det ikke lage DNA
kontinuerlig i den strengen som er koblet motsatt, men lager korte strenger i
3-5-retningen etterhvert som spiralen splittes opp. Disse korte strengene blir så
skjøtt sammen av enzymet DNA-ligase.
E. Coli er en bakterie
som vokser og formerer seg raskt og egner seg glimrende for biokjemiske
studier. Replikasjonssystemet dens er bedre kjent enn for noen andre
organismer, men i grunntrekkene ser det ut til at det er påfallende likt for
samtlige.
E. Coli har også en
DNA-polymerase II, som det ennå ikke er helt klart hvordan den bruker, men den
trer i aktivitet når DNAet blir skadet, og har sikkert noe med reparasjoner å
gjøre. DNA-skader oppstår temmelig ofte, og derfor må organismene ha noe å
fikse dem med. Diverse kjemiske substanser, ioniserende stråling og
ultrafiolett lys kan skade DNA, basene kan bli endret eller ødelagt,
esterkjeden i ryggraden kan brytes og det kan oppstå kovalente bindinger mellom
de to DNA-trådene i dobbeltspiralen. Når du soler deg treffer de ultrafiolette
strålene fra Sola thyminbaser som sitter ved siden av hverandre mange steder i
DNAet i huden din og adderer dem til hverandre over dobbeltbindingen i ringen.
Basene sitter vanligvis pent i parallelle plan på tvers av lengdeaksen av DNA,
men når to av dem bindes til hverandre blir det uorden i dette, og DNAet blir
ubrukelig på dette punktet. Da vil en spesifikk endonuklease som har en
affinitet til slike thymin-dimerer binde seg til det skadde punktet og bryte
fosfatesterkjeden et par baser fra skaden, slik at den skadde delen spriker ut
fra dobbeltspiralen. En DNA-polymerase erstatter så det skadde stykket og
kobler det helt av der hvor det begynner å sprike. Til slutt blir det nye DNA-stykket
koblet sammen med resten av DNA-ligase.
Det finnes endonukleaser
som kan finne og starte reparasjon av mange typer skader. Så lenge bare den ene
strengen av DNA er skadd er det enkelt å reparere på grunnlag av den andre. Men
hvis begge basene i et basepar ødelegges er det verre, for en celle kan ikke gå
inn i en annen celle og hente informasjon fra det uskadde DNAet der. Det kan
også hende at skadene er så omfattende at de vanlige reparasjonsmekanismene
bare fungerer så noenlunde. Heldigvis har DNAet mange ikke-kodende sekvenser
som kan skades uten at det gjør noe. Koden er dessuten slik at flere liknende
koder står for den samme aminosyren, så et basepar kan forandres uten at det
nødvendigvis betyr noe for proteinsyntesen. Hvis et gen likevel skulle bli
ødelagt betyr det ikke noe for de andre genene, for alle er markert med sine
egne start- og stoppkoder. Endelig fungerer mange av aminosyrene i de fleste
proteiner bare som fyllmateriale, så hvis en enkelt aminosyre byttes ut, betyr
det ikke nødvendigvis noe for funksjonene til proteinet, og hvis det betyr noe
likevel, fører det ikke nødvendigvis til at proteinet fungerer noe særlig
dårligere. Det kan til og med føre til at det fungerer bedre.
Hvis et av proteinene
som er livsviktig for cellen blir ødelagt, kan cellen dø, slik at det ikke
betyr noe for resten av kroppen. Hvis et av proteinene som ligger i cellens
overflate blir forandret kan det hende at den oppfattes som fremmed av
immunsystemet, slik at det dreper den. Hvis cellen blir mindre funksjonsdyktig
av forandringen kan det hende at den blir ødelagt av de belastningene kroppen
utsettes for. Hvis ikke noe av dette hjelper, har kroppen fått en genetisk
skade som kanskje gjør den merkbart mindre funksjonsdyktig, kanskje ikke. Det
skal mye til om en enkelt celle kan gjøre noe for kroppsfunksjonene som helhet.
Ved ekstrem uflaks kan det hende at de proteinene som styrer cellens innordning
i kroppssystemet skades, slik at den kommer ut av kontroll. Da kan den begynne
å dele seg ukontrollert, slik at det oppstår en svulst, som kan være god- eller
ondartet. Kroppen vil kunne registrere den som fremmed og forsøke å innkapsle
den slik at den blir ufarlig, og klarer kanskje å uskadeliggjøre eller drepe
den. Men hvis ikke, kan det føre til at hele kroppen går til grunne.
For hvert av proteinene
som kroppen trenger er det et gen i kromosomene som forteller hvordan det skal
settes sammen, aminosyre for aminosyre. Signalet til produksjonen kan gis på
forskjellige måter, f.eks. kan et hormon eller et stoff som det trengs et
protein for å behandle binde seg til et bestemt reguleringsprotein som er laget
for å skjerme startsekvensen til genet og løsne det fra genet, en
signalsubstans som produseres ved visse kjemiske forhold i cellen kan bindes
til en såkalt promotorsekvens som begunstiger proteinproduksjonen, eller et
produkt som det nye proteinet lager kan binde seg til regulatorproteinet og få
det til å skjerme startsekvensen. Produksjonen av enkelte aminosyrer reguleres
ganske finurlig ved at genene for de enzymene som produserer dem har en
attenuatorsekvens som består av flere kopier av koden for den aminosyren, og
bare når det er så lite av denne aminosyren at produksjonen av denne sekvensen
går i stå, fortsetter produksjonen med resten av genet.
Det er RNA som spiller
hovedrollen i proteinbyggingen. Denne jobben fordeles på tre typer RNA som
kalles budbærer-RNA, overførings-RNA og ribosomer. Et stort enzym som kalles
RNA-polymerase og er oppdelt i flere smådeler med forskjellige funksjoner finner
fram til den DNA-sekvensen som markerer starten på genet, vikler opp DNAet i en
lengde av ca. 10 basepar og begynner å produsere en RNA-kopi av genet. Denne
kopien kalles budbærer-RNA. Den kopieres i retning fra OH-enden til fosfatenden
av DNA-tråden, men resultatet er koblet motsatt, RNAet begynner med en
fosfatende og slutter med en OH-ende. Helt i begynnelsen har den et G- eller
A-nukleotid med tre fosfatgrupper (altså et guanidintrifosfat eller
adenosintrifosfat), som fungerer som startpunkt for syntesen. Syntesen
avsluttes når polymerasen treffer på et stoppsignal på DNAet. RNA-polymerase
trenger Mg2+- eller til nød Mn2+-ioner for å fungere.
Denne genmodellen
fraktes vanligvis ut av cellekjernen (hvis cellen har en kjerne), gjerne i mer
eller mindre sterkt modifisert tilstand. Her bygges proteinene ved hjelp av
minst 20 forskjellige molekyler av overførings-RNA. Alle er på 73 til 93
nukleotider og har fire komplementaritets-sekvenser slik at de kan krølles
sammen til dobbeltspiraler i fire sekvenser med tre åpne løkker mellom
sekvensene. I sammenkrøllet stand likner molekylet på en L, hvor de to løse
endene ligger i den ene enden, den midterste løkka ligger i den andre og de to
andre møtes i vinkelen. Molekylet inneholder en rekke modfiserte baser, dihydrouracil,
thymin, pseudouracil, metylguanin, dimetylguanin og metylinosin. I den
midterste løkka står det ut tre baser som er spesielle for hver av variantene
av overførings-RNA. Dette er kodeordet som skal passe til et tilsvarende
kodeord på budbærer-RNAet. De tre basene på overførings-RNAet kalles
antikodonet mens de tre på budbærer-RNAet kalles kodonet. Hvis kodonet f.eks.
er UAC er antikodonet AUG. I motsatt ende stikker en løs ende ut som består av
sekvensen CCA, og den siste ribosen (som altså er bundet til adenin) har
forestret en aminosyre i 3-posisjonen, nemlig den som det aktuelle antikodonet
koder for. Den tredje basen i antikodonet er ofte inosin, et modifisert adenin
hvor aminogruppen er oksydert og det sitter et karbonyl der i stedet. Inosinet kan
danne basepar med både cytosin, adenin og uracil, derfor er bare de to første
baseparene helt spesifikke for mange av aminosyrene.
Noen ganger fører en
mutasjon i genmaterialet til at proteinene som produseres ikke blir
funksjonsdyktige. Som et forsvar mot slike mutasjoner blir noen ganger
overførings-RNAene mutert selv, f.eks. hvis det kommer en stoppkode midt i et
gen, kan det dannes et overførings-RNA som leser stoppkoden som en kode for
aminosyren tyrosin, og den kommer i tillegg til det vanlige tyrosin-RNAet. Hvis
et kodon forandres slik at det koder for en annen aminosyre kan det oppstå et
overførings-RNA som leser den gamle aminosyren for det nye kodonet, i tillegg
til de overførings-RNAene som leser det nye kodonet på vanlig måte. Hvis det kommer
inn et nytt basepar i genet kan det oppstå et overførings-RNA som har et
firebasers antikodon. Dette kan skape problemer fordi de nye overførings-RNAene
konkurrerer med de gamle om de samme kodonene, men hvis tapet er mindre enn
gevinsten ved det at det opprettholdes en viss produksjon av det egentlig
bortmuterte proteinet overlever organismen og kan i sjeldne tilfelle overføre
RNA-tendensene sine til etterkommerne.
En gruppe på minst 20
enzymer som kalles aktiveringsenzymer kobler riktig aminosyre til det riktige
overførings-RNAet. Når to aminosyrer er ganske like, som valin og isoleucin (se
under) kan enzymet koble feil opptil 1 av bare rundt 3000 ganger, men det
sjekker adenylatet for feilkoblinger og kan finne på å bruke særegenheter ved
det spesifikke overførings-RNAet til å spalte adenylatet igjen. Mange av
aktiveringsenzymene har både syntese- og hydrolysepunkter, i syntesepunktene
får bare de aminosyrene som ikke er for store plass, mens i hydrolysepunktene,
hvor en adenylatbinding kan brytes, er det bare plass til de aminosyrene som er
for små. Når enzymet har lagd et adenylat i syntesepunktet blir det ført inn i
hydrolysepunktet for sjekking. Hvis det er for stort til å komme inn der klarer
det seg unna hydrolysen og blir ført videre til overførings-RNAet.
Selve proteinbyggingen
skjer i ribosomene, som selv består av ca. 55 forskjellige proteiner og 3-4
ganske store RNA-molekyler, som utgjør hoveddelen av massen. Både dette og
overførings-RNAet produseres etter modell av DNA-gener på andre stadier av
prosessen. Både ribosomgenene og genene til histonene som brukes til å pakke
sammen kromosomer er naturlig nok noen av de viktigste genene og befinner seg i
spesialiserte regioner på kromosomet hvor de blir gjentatt opptil hundre
ganger. I celler med kjerne produseres de også av sine egne RNA-polymeraser.
Ribosomene er satt
sammen av to ulike store halvkuler. De to halvkulene kan skilles fra hverandre,
men ribosomene har den merkelige egenskap at de selv om de deles opp i
enkeltmolekylene de består av, setter de seg sammen igjen på riktig måte hvis
delene føres sammen igjen. Det er den minste halvdelen av ribosomet som først
kobler seg til startsekvensen på budbærer-RNAet, som kan være så mye som 25
baser fra enden som lesingen starter fra, den enden hvor fosfatet er bundet i
5-posisjonen på ribosen, og består av en kodonsekvens som danner basepar med en
sekvens RNA i ribosomet, samt kodonet AUG, eller sjeldnere GUG. Ribosomet har
to hulrom hvor et overførings-RNA får plass, og i starten får et spesielt
initiator-RNA plass i det ene hulrommet, P-(peptidyl-)punktet. Initiator-RNAet
har antikodonet UAC, som danner basepar med startkodonet. Det har med seg en
modifisert aminosyre, formylmethionin, HCONHCH(CH2CH2SCH3)COOH.
Nå kommer resten av ribosomet på plass, og i det andre hulrommet på ribosomet,
A-(aminoacyl-)punktet, er det plass til et overførings-RNA som passer til den
neste koden på budbærer-RNAet. Et protein som kalles
"forlengelsesfaktor-Tu" leverer den rette kandidaten til ribosomet. Aminosyrene
som henger på overførings-RNAene stikker ut av ribosomet i motsatt ende av
budbærer-RNAet, og et enzym som kalles peptidyl-transferase og finnes i
ribosomet danner en peptidbinding mellom aminogruppen til den sist ankomne
aminosyren og syregruppen til molekylet som er festet i P-punktet og løsner det
fra RNAet som er festet der. Et annet protein som kalles forlengelsesfaktor G
forskyver ribosomet til det neste ledige kodonet på budbærer-RNAet samtidig som
det avkoblede RNA-molekylet forskyves ut av P-punktet og det sist ankomne
overførings-RNAet, som er tilkoblet den hittil syntetiserte peptidkjeden,
flyttes fra A-punktet til P-punktet. Dermed kan neste runde begynne. Syntesen
slutter når ribosomet kommer til en stoppkode som kan være UAA, UGA eller UAG.
Normale celler har ikke overførings-RNA som passer til disse kodonene, i stedet
er det visse proteiner, frigjøringsfaktorene som binder seg til stoppkodene og
frigjør den ferdige peptidkjeden.
For at peptidkjeden skal
bli til et protein eller et virksomt peptid, trengs som oftest, iallfall i
kjerneceller, en god del etterbehandling. Det er de færreste proteiner og
peptider som folder seg sammen i riktig konfigurasjon av seg selv og ikke
trenger noen kjemiske modifikasjoner av noen slag. Først må formylmetioninet
som syntesen startet med fjernes, gjerne sammen med noen overflødige aminosyrer
i aminoenden. Tverrforbindelser mellom ulike deler av kjeden kan lages ved å
oksydere cystein for å danne disulfidbroer. Noen aminosyrer kan modifiseres for
å få fram egenskaper som man ikke får med standardaminosyrene, eller det kan
kobles på sukker slik at man får glykoproteiner eller fosfatgrupper slik at man
får fosfoproteiner. Mange proteiner må ha et annet molekyl, en prostetisk
gruppe bundet til seg for at det skal fungere. Noen proteiner eller peptider må
spaltes et eller flere steder for å kunne fungere. F.eks. produseres insulin
som en sammenhengende streng som bindes til seg selv med tre disulfidbroer,
deretter spaltes det av en løkke slik at det blir to parallelle strenger med
disulfidbroer mellom.
Skrapesyke hos sau,
kugalskap hos kveg og Creutzfeld-Jacob-syndrom hos mennesker kommer av
feilfolding av proteiner. Noen sterkt modifiserte proteiner kan opptre i former
som er kjemisk mer stabile enn de som er korrekt foldet. Det antas at hvis et
feil foldet protein møter et korrekt, men mindre stabilt av samme slag, kan det
syke proteinet påvirke det friske til å omfolde seg slik at det ikke fungerer
riktig lenger. På denne måten kan proteinet fungere som en ny type smittestoff
som kalles prioner, og spre sykdommen fra dyr til dyr.
Vår verden har vært
utsatt for en lang rekke store katastrofer gjennom tidene, og derfor er nesten
alle livsformer uhyre opptatt av å skaffe seg så mye genetisk variasjon som
mulig for at noen av slekten kanskje skal bli utstyrt for å overleve
katastrofen. Selv de enkleste bakterier møtes når de føler for det og har det
sikkert godt når de strekker et rør mellom hverandre som de utveksler DNA
igjennom. Bakterier har jo det siste århundret vært utsatt for en rekke
katastrofer som vi kaller antibiotika, men er visstnok i ferd med å løse
problemet. Standardmetoden for flercellede vesener er kjønnet formering, hvor
enkeltkromosomer fra det ene individet møter enkeltkromosomer fra det andre og kombineres
til et fullt sett kromosompar med egenskaper fra begge foreldrene. Noen
livsformer sparer all den energien som går med til dette og bruker den i stedet
til å produsere uhorvelig mange kloner av seg selv, for eksempel
løvetannplanten, men har til gjengjeld ofte en mekanisme for å produsere
uvanlig mange mutanter. Alt dette er basert på rekombinasjon av DNA, som
foregår ved at to DNA-kjeder som inneholder tilsvarende (homologe) gener føres
sammen, en av strengene i hver kjede kuttes, krysses over og spleises med
tilsvarende streng på den andre DNA-kjeden, eller begge strengene kan krysses
over. Hvis du f.eks. har arvet gener for gult hår, blå øyne, krokete nese,
utholdende muskulatur og blodtype A fra den ene av foreldrene dine og brunt
hår, grønne øyne, klumpete nese, rask muskulatur og blodtype B fra den andre,
vil kjønnscellene dine gjerne komme til å inneholde anlegg for blå øyne, brunt
hår, klumpete nese, utholdende muskulatur og blodtype A eller blå øyne, gult
hår, krokete nese, utholdende muskulatur og blodtype B, for eksempel. I dag har
vitenskapen lært å ape etter denne teknikken, og bytter gener mellom de
forskjelligste organismer etter forgodtbefinnende så snart de mener at de har
funnet ut hvordan genet fungerer og hvordan de kan utnytte det. Mer om dette
senere.
Løse nukleotider er ikke
bare råstoff for DNA- og RNA-produksjon. Som nevnt spiller adenosintrifosfat
(ATP) en nøkkelrolle i energiomsetningen ved at difosfatversjonen av molekylet
tar opp energi fra energiproduserende prosesser ved å binde et tredje
fosfatgruppe (fosforylering) og blir tilgjengelig for å avlevere energien igjen
ved hydrolyse (defosforylering) hvis det er behov for den der molekylet
tilfeldigvis befinner seg. Men mange andre løse nukleotider spiller også
viktige roller i kroppskjemien, alle er ribonukleotider og ikke
deoksyribonukleotider. Guanosintrifosfat (GTP) dannes ved fosforylering under
sukkerforbrenningen i ett av trinnene i sitronsyresyklusen, det forbrukes på
tilsvarende måte under nyproduksjon av sukker, glukoneogenese, samt ved
sammenkoblingen av de to delene av ribosomene under proteinsyntesen og brukes
til signalforsterking ved synsprosessen. Uridintrifosfat (UTP) brukes til
aktivering av molekyler som skal bindes til andre molekyler i diverse synteser.
Cytidintrifosfat (CTP) brukes til samme formål under syntese av fosfolipider,
hovedbestanddelen av celleveggene.
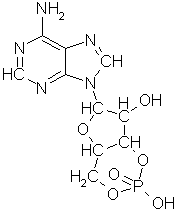 Syklisk adenosinmonofosfat (cAMP)
er et interessant modifisert nukleotid som brukes til en rekke viktige
funksjoner i kroppen. En av de viktigste er som forsterkning av signalene fra
hormoner som ikke trenger inn i cellene. Disse hormonene fester seg til en
hormonreseptor som sitter i cellemembranen og stimulerer enzymet
adenylatsyklase som sitter på innsiden av membranen slik at det dannes cAMP
inne i cellen. For hvert hormonmolekyl dannes det mange cAMP, slik at effekten
forsterkes. cAMP virker generelt ved at det binder seg til spesielle enzymer
som er inaktive hvis de ikke er bundet til cAMP. Stimuleringen av
adenylatsyklasen skjer når et tredje membranprotein får tilført et molekyl
guanosintrifosfat, som så sakte hydrolyseres til difosfatet slik at
stimuleringen opphører hvis det ikke kommer et nytt hormonmolekyl til
reseptorproteinet. Alkaloidene koffein og theofyllin, som finnes i kaffe og te,
virker stimulerende fordi de hemmer fosfodiesterasen, slik at cAMP brytes ned
saktere og hormonvirkningene forlenges. Kolerabakterier inneholder et giftstoff
som setter GTP-bindingsproteinet ut av funksjon slik at det ikke kan
hydrolysere GTP. Dermed opphører ikke stimuleringen av adenylatsyklasen i det
hele tatt og det produseres store mengder cAMP i cellen, og slimhinnenecellene
i tarmen, som har ionetransport som en av sine oppgaver, slipper ut store
mengder natriumioner og vann, slik at kroppen raskt uttørkes.
Syklisk adenosinmonofosfat (cAMP)
er et interessant modifisert nukleotid som brukes til en rekke viktige
funksjoner i kroppen. En av de viktigste er som forsterkning av signalene fra
hormoner som ikke trenger inn i cellene. Disse hormonene fester seg til en
hormonreseptor som sitter i cellemembranen og stimulerer enzymet
adenylatsyklase som sitter på innsiden av membranen slik at det dannes cAMP
inne i cellen. For hvert hormonmolekyl dannes det mange cAMP, slik at effekten
forsterkes. cAMP virker generelt ved at det binder seg til spesielle enzymer
som er inaktive hvis de ikke er bundet til cAMP. Stimuleringen av
adenylatsyklasen skjer når et tredje membranprotein får tilført et molekyl
guanosintrifosfat, som så sakte hydrolyseres til difosfatet slik at
stimuleringen opphører hvis det ikke kommer et nytt hormonmolekyl til
reseptorproteinet. Alkaloidene koffein og theofyllin, som finnes i kaffe og te,
virker stimulerende fordi de hemmer fosfodiesterasen, slik at cAMP brytes ned
saktere og hormonvirkningene forlenges. Kolerabakterier inneholder et giftstoff
som setter GTP-bindingsproteinet ut av funksjon slik at det ikke kan
hydrolysere GTP. Dermed opphører ikke stimuleringen av adenylatsyklasen i det
hele tatt og det produseres store mengder cAMP i cellen, og slimhinnenecellene
i tarmen, som har ionetransport som en av sine oppgaver, slipper ut store
mengder natriumioner og vann, slik at kroppen raskt uttørkes.
cAMP finnes også i
bakterier, og har tydeligvis en flere milliarder år lang forhistorie som
reguleringsmolekyl. Bakteriene lager cAMP når de har brukt opp glukosen sin og
må stimulere syntesen av visse proteiner for å utnytte andre energikilder. Den
er altså opprinnelig et sultsignal, og brukes også til å stimulere nedbrytning
av lagrede polysakkarider i flercellede organismer (f.eks. glykogen i muskler
og lever) når hormoner som glukagon og adrenalin melder at det er behov for
energi.
cAMP hører til en liten
gruppe substanser som brukes til kommunikasjon inne i cellene. Virkningen av
mange hormoner og andre stoffer som brukes til kommunikasjon mellom cellene
bygger på at de binder seg til et protein på utsiden som fungerer som reseptor.
Reseptorproteiner setter så i gang prosesser på innsiden, og hvis den delen av
cellen som skal påvirkes ikke er direkte tilgjengelig startes det produksjon av
kommunikasjonsstoffer som cAMP. Slike kommunikasjonsmidler kan fungere på to
grunnleggende måter, enten ved at de binder seg til mottakerproteinet og endrer
form på det, som i muskelceller når kalsium binder seg til troponin C-proteinet
slik at de fibrene som det ligger mellom forskyver seg i forhold til hverandre,
eller (mer vanlig) ved at de aktiviserer et proteinkinase-enzym, som
fosforylerer et protein slik at det endrer form (og dermed funksjon).
Et tilsvarende
nukleotid, syklisk guanosinmonofosfat (cGMP), ser ut til å ha liknende
funksjoner i synsprosessene. Et par andre slike kommunikasjonsstoffer er
inositoltrifosfat og diacylglyseroler, som dannes ved å spalte visse
fosfolipider i cellemembranen, og dessuten forskjellige ioner.
Inositoltrifosfatet er spesialist på å frigjøre lagret kalsium fra cellenes
endoplasmiske nettverk, noe som kan gi opphav til diverse reaksjoner, f.eks.
spyttsekresjon, frigjøring av glukose fra leveren eller dannelse av det
overflatelaget på eggceller som beskytter egget mot flere sædceller etter
befruktningen. Inositoltrifosfatet virker sammen med diacylglyserolet, som
holder seg i cellemembranen og aktiviserer enzymet C-kinase, som i sin tur
aktiviserer andre proteiner.
Proteiner består som
nevnt av kjeder av aminosyrer. Generelt sett er det bare 20 aminosyrer å velge
mellom, hver med sine trebokstavers koder i DNA. Illustrasjonen til venstre
viser strukturen, navnet, de tre- og enbokstavskodene som er konvensjonelle å
bruke når man skal beskrive lengre sekvenser av aminosyrer i proteiner og
peptider, samt DNA-kodene. I tillegg til de 61 DNA-kodene på tegningene kommer
tre stoppkoder, TAA, TAG og TGA. Dessuten brukes Asx og B som konvensjonell
bokstavkode for asparaginsyre eller asparagin når man ikke vil spesifisere
akkurat hvilken, og det samme gjelder Glx og Z for glutaminsyre eller glutamin.
 Mye av vitsen med aminosyrene er
at sidegrenene har forskjellige egenskaper som er avgjørende for oppbygningen
og funksjonene til proteinene de er bestanddeler av. De upolare aminosyrene
glycin, alanin, valin, leucin, isoleucin, prolin og fenylalanin gjør proteinet
vannfrastøtende og fettiltrekkende der hvor de forekommer på overflaten, og har
stor betydning for formen og den tredimensjonale oppbygningen av proteinet.
Glycin utgjør 1/3 av aminosyrene i kollagen, et seigt bindevevsprotein, og er
den eneste som får plass inne i de stramme kveilene det er bygd opp av. Fritt
glycin er også et av utgangspunktene for produksjon av porfyriner, det
metallbindende molekylet i hemoglobin og klorofyll. Størstedelen av resten av
kollagenet består av prolin og hydroksylert prolin.
Mye av vitsen med aminosyrene er
at sidegrenene har forskjellige egenskaper som er avgjørende for oppbygningen
og funksjonene til proteinene de er bestanddeler av. De upolare aminosyrene
glycin, alanin, valin, leucin, isoleucin, prolin og fenylalanin gjør proteinet
vannfrastøtende og fettiltrekkende der hvor de forekommer på overflaten, og har
stor betydning for formen og den tredimensjonale oppbygningen av proteinet.
Glycin utgjør 1/3 av aminosyrene i kollagen, et seigt bindevevsprotein, og er
den eneste som får plass inne i de stramme kveilene det er bygd opp av. Fritt
glycin er også et av utgangspunktene for produksjon av porfyriner, det
metallbindende molekylet i hemoglobin og klorofyll. Størstedelen av resten av
kollagenet består av prolin og hydroksylert prolin.
 De andre aminosyrene har polare
grupper på sidegrenene og virker vanntiltrekkende og fettavstøtende hvis de
forekommer på overflaten, noe de vanligvis gjør. Serin og treonin har
alkoholgrupper på sidegrenene og tyrosin har en fenolgruppe. Serinet har særlig
viktige funksjoner i fosfoproteiner hvor fosfatgruppene forestres til
OH-gruppene i serinet, og i glykoproteiner hvor karbohydrater bindes til disse
OH-gruppene. Inngår også i noen fosfolipider hvor den går med til syntesen av
sfingosin, som har flere viktige funksjoner i nervesystemets kjemi. Treonin
binder også gjerne karbohydrater i glykoproteiner. Som serin foreligger den
ofte fosforylert i andre proteiner. Tyrosin er som fri aminosyre utgangspunkt
for produksjon av en rekke viktige substanser, bl.a. flere av de viktigste
nevrotransmitterne og pigmentstoffet melanin. Albinisme skyldes at kroppen
mangler enzymet tyrosinase som omdanner tyrosin til melanin. De tre aromatiske
aminosyrene er fenylalanin, tyrosin og tryptofan. Sistnevnte har en
purinliknende struktur i sidegrenen og gir den fra seg når det skal lages
forbindelser med slik struktur.
De andre aminosyrene har polare
grupper på sidegrenene og virker vanntiltrekkende og fettavstøtende hvis de
forekommer på overflaten, noe de vanligvis gjør. Serin og treonin har
alkoholgrupper på sidegrenene og tyrosin har en fenolgruppe. Serinet har særlig
viktige funksjoner i fosfoproteiner hvor fosfatgruppene forestres til
OH-gruppene i serinet, og i glykoproteiner hvor karbohydrater bindes til disse
OH-gruppene. Inngår også i noen fosfolipider hvor den går med til syntesen av
sfingosin, som har flere viktige funksjoner i nervesystemets kjemi. Treonin
binder også gjerne karbohydrater i glykoproteiner. Som serin foreligger den
ofte fosforylert i andre proteiner. Tyrosin er som fri aminosyre utgangspunkt
for produksjon av en rekke viktige substanser, bl.a. flere av de viktigste
nevrotransmitterne og pigmentstoffet melanin. Albinisme skyldes at kroppen
mangler enzymet tyrosinase som omdanner tyrosin til melanin. De tre aromatiske
aminosyrene er fenylalanin, tyrosin og tryptofan. Sistnevnte har en
purinliknende struktur i sidegrenen og gir den fra seg når det skal lages
forbindelser med slik struktur.
 De fleste aminosyrer er uladde,
men de basiske lysin, arginin og histidin er positivt ladet og de sure
asparaginsyre og glutaminsyre er negativt ladet ved normal pH i kroppsvæsker.
Denne ladningen spiller en viktig rolle i mange biokjemiske prosesser. Lysin
brukes i likhet med cystein til å danne tverrforbindelser mellom peptidkjeder
for å strukturere proteinet og gi det styrke. I elastin, et elastisk protein
som bygger mange viktige strukturer i kroppen, kobles 4 lysiner i fire
forskjellige kjeder sammen til desmosin eller isodesmosin. Den lange sidekjeden
i lysin er også nyttig for å koble til aktive grupper i noen enzymer, de aktive
grupper har gjerne en karboksylgruppe, gjerne også på en lang sidekjede, den
bindes med en amidbinding til aminogruppen i lysinet og enzymet får en lang
aktiv (prostetisk) gruppe med god bevegelighet og rekkevidde. Arginin avgir
gruppen -NH-C(:NH)-NH2 når det skal lages urinstoff. Den
heterosykliske ringen i histidin kan avgis for produksjon av flere viktige
stoffer, og ved dekarboksylering kan den frie aminosyren omdannes til histamin,
som spiller en viktig rolle når kroppen reagerer på skader, men også er aktivt
i forbindelse med allergier.
De fleste aminosyrer er uladde,
men de basiske lysin, arginin og histidin er positivt ladet og de sure
asparaginsyre og glutaminsyre er negativt ladet ved normal pH i kroppsvæsker.
Denne ladningen spiller en viktig rolle i mange biokjemiske prosesser. Lysin
brukes i likhet med cystein til å danne tverrforbindelser mellom peptidkjeder
for å strukturere proteinet og gi det styrke. I elastin, et elastisk protein
som bygger mange viktige strukturer i kroppen, kobles 4 lysiner i fire
forskjellige kjeder sammen til desmosin eller isodesmosin. Den lange sidekjeden
i lysin er også nyttig for å koble til aktive grupper i noen enzymer, de aktive
grupper har gjerne en karboksylgruppe, gjerne også på en lang sidekjede, den
bindes med en amidbinding til aminogruppen i lysinet og enzymet får en lang
aktiv (prostetisk) gruppe med god bevegelighet og rekkevidde. Arginin avgir
gruppen -NH-C(:NH)-NH2 når det skal lages urinstoff. Den
heterosykliske ringen i histidin kan avgis for produksjon av flere viktige
stoffer, og ved dekarboksylering kan den frie aminosyren omdannes til histamin,
som spiller en viktig rolle når kroppen reagerer på skader, men også er aktivt
i forbindelse med allergier.
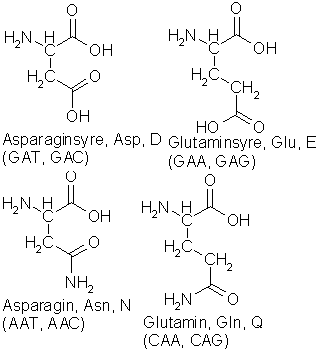 Som fri aminosyre er
asparaginsyre utgangspunkt for produksjon av pyrimidinbasene thymin, cytosin og
uracil, og er med på å gjendanne arginin når den er brukt til å produsere
urinstoff. Glutaminsyre finnes i muskelvev og bidrar til å gi kjøttet den
karakteristiske smaken. Natriumsaltet utnyttes også som smaksforsterker. Som
fri aminosyre brukes den til produksjon av flere forskjellige andre aminosyrer,
samt nevrotransmitteren g-aminobutyrat (GABA) eller
4-aminosmørsyre. Asparagin binder karbohydrater i noen glykoproteiner og finnes
i store mengder i noen planter, bl.a. asparges. Glutamin kan avgi aminogrupper
i biokjemiske synteser og lager tverrforbindelser med lysin i proteinet fibrin
når blodet skal klumpe seg.
Som fri aminosyre er
asparaginsyre utgangspunkt for produksjon av pyrimidinbasene thymin, cytosin og
uracil, og er med på å gjendanne arginin når den er brukt til å produsere
urinstoff. Glutaminsyre finnes i muskelvev og bidrar til å gi kjøttet den
karakteristiske smaken. Natriumsaltet utnyttes også som smaksforsterker. Som
fri aminosyre brukes den til produksjon av flere forskjellige andre aminosyrer,
samt nevrotransmitteren g-aminobutyrat (GABA) eller
4-aminosmørsyre. Asparagin binder karbohydrater i noen glykoproteiner og finnes
i store mengder i noen planter, bl.a. asparges. Glutamin kan avgi aminogrupper
i biokjemiske synteser og lager tverrforbindelser med lysin i proteinet fibrin
når blodet skal klumpe seg.
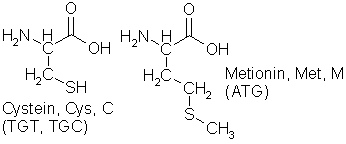 Cystein har som hovedoppgave å
lage tverrforbindelser. Disse er ikke så sterke som de til lysin og glutamin,
men har stor betydningen for den tredimensjonale strukturen til proteinet, den
er også mye mindre krevende å lage og bryte med en enkel redoksprosess.
Metionin har som hovedoppgave å avgi metylgrupper i syntesen. Den frie
aminosyren brukes også av mange organismer som startpunkt i proteinsyntesen.
Cystein har som hovedoppgave å
lage tverrforbindelser. Disse er ikke så sterke som de til lysin og glutamin,
men har stor betydningen for den tredimensjonale strukturen til proteinet, den
er også mye mindre krevende å lage og bryte med en enkel redoksprosess.
Metionin har som hovedoppgave å avgi metylgrupper i syntesen. Den frie
aminosyren brukes også av mange organismer som startpunkt i proteinsyntesen.
Alle proteiner som lille
Emil spiser blir nedbrutt i sine enkelte aminosyrer for bruk til oppbygningen
av hans egne proteiner. Men hvis han spiser mer protein enn han trenger, blir
aminosyrene brukt i forbrenningen, de kan verken lagres eller utskilles slik de
er. Mesteparten av aminogruppene blir omdannet til urinstoff og skilt ut i urinen,
mens karbonkjedene blir omdannet slik at de kan gå inn i
forbrenningsprosessene. Også fettsyrer og glukose kan lages av aminosyrer.
Nedbrytningen skjer
først og fremst i leveren. Aminosyrene mister vanligvis a -aminogruppen sin, den som brukes til å danne peptidbindinger,
ved at den overføres til a
-ketoglutarat, -OOC-CO-CH2-CH2-COO-
som er et av mellomproduktene av forbrenningen, og derfor finnes i store
mengder. Resultatet er glutamat, -OOC-C(NH2)-CH2-CH2-COO-,
og en a -keto-aminosyre. Glutamatet blir
så oksydert til a -ketoglutarat igjen og et
ammoniumion.
Ammoniumionet kan brukes
i organisk syntese, men hvis det ikke er bruk for det blir det omdannet til et
stoff som kan skilles ut i urinen. Landpattedyr omdanner det til urinstoff.
Fugler og krypdyr som lever på land omdanner det til urinsyre, mens mange
vanndyr skiller ut ammonium direkte. Urinstoffproduksjonen skjer i
urinstoffsyklusen, et biokjemisk kretsløp hvor urinstoff dannes ved hydrolyse
av arginin slik at det dannes ornitin, NH2CH(CH2CH2CH2NH2)COOH.
Ammonium og karbondioksyd omdannes til karbamoylfosfat, NH2COPO42-
ved hjelp av ATP, og resten av syklusen går ut på å bygge opp arginin av
ornitin og karbamoylfosfat. Underveis omdannes også asparaginsyre, NH2CH(CH2COOH)COOH
til fumarsyre HOOCCH:CHCOOH for å tilføre den tredje aminogruppen i argininet.
Fumarsyre omdannes til oksaloeddiksyre, HOOCCOCH2COOH, i
sitronsyresyklusen, der oksygenforbrenningen foregår, og oksaloacetatet blir
til asparaginsyre igjen ved å bytte til seg en a -aminogruppe fra en annen aminosyre som skal nedbrytes.
Alle de deaminerte a -ketosyrene omdannes til et produkt som kan gå inn i denne
sitronsyresyklusen for at de skal kunne forbrennes. Denne prosessen er et
viktig bidrag til effektiviteten av syklusen, siden tilførselen av aminosyrer
sikrer at det alltid er rikelig tilgang til mellomproduktene. Av alle
mellomproduktene er det faktisk bare sitronsyren selv som ikke kan lages mer
eller mindre direkte av en aminosyre. Leucin, lysin, fenylalanin, tyrosin og
tryptofan kan gi opphav til aceteddiksyre, CH3COCH2COOH,
som bundet til koenzym A lett omdannes til to enheter acetyl-koenzym A, som
fungerer som den vanlige brennstofftilførselen til syklusen. Isoleucin, leucin
og tryptofan kan gi opphav til acetyl-koenzym A direkte. Alanin, glycin,
cystein, serin og treonin kan gi pyrodruesyre, CH3COCOOH, som er det
vanligste forstadiet til acetyl-koenzym A. Glutaminsyre, glutamin, histidin,
prolin og arginin kan gi a
-ketoglutarat, isoleucin, metionin, treonin og valin kan gi ravsyre, HOOCCH2CH2COOH,
tyrosin, fenylalanin og asparaginsyre kan gi fumarsyre og asparagin og
asparaginsyre oksaloeddiksyre, alle bestanddeler av selve syklusen. Flere av
aminosyrene opptrer flere steder her fordi de deles opp under
omdannelsesprosessen.
Det er karakteristisk
for proteiner at de har en veldefinert tredimensjonal struktur. En utstrukket
eller tilfeldig sammenfoldet peptidkjede har ingen biologisk funksjon. En
fundamental struktur er a-spiralen, med 3,6 aminosyrer pr.
omdreining og en avstand på 1,5 Å langs spiralaksen mellom hver aminosyre. Den
stabiliseres av hydrogenbindinger mellom NH- og CO-gruppene i peptidbindingene.
En slik a-spiral kan danne fibre alene
eller flettes sammen i kabler, og den er også et svært vanlig strukturelement i
proteiner med mindre regelmessig struktur. Den fungerer bare hvis alle
aminosyrene er enten høyre- eller venstredreiende. En annen vanlig periodisk
struktur er b -skiktet, hvor aminosyrekjeden
er nesten helt rettet ut, med 3,5 Å mellom hver aminosyre, og det kan dannes
skikt av slike kjeder som stabiliseres av hydrogenbindinger mellom NH-grupper i
en streng og CO-grupper i neste. Her vender annenhver aminosyre NH- og
CO-gruppene sine mot en av nabostrengene og annenhver aminosyre mot den andre.
Det finnes enkelte proteiner som så å si bare består av ark på ark av
slike b -skikt, men viktigere er det at
skikt på 2-3 strenger eller deromkring er et hyppig strukturelement i mange
proteiner med komplisert struktur. De kan også være koblet til a -spiraler. Som nevnt er disulfidbroer mellom cysteiner viktig for
strukturen av proteinet, liksom de sterke koblingene mellom lysin og glutamin.
De sistnevnte dannes bare når proteinet allerede stort sett er ferdig
konfigurert, men disulfidbroene dannes tidlig og er viktige for selve
konfigureringsprosessen. Vanligvis er det den termodynamisk mest stabile
konfigurasjonen som er den biologisk aktive, slik at det egentlig er
aminosyrerekkefølgen som bestemmer konfigurasjonen og den stort sett dannes av
seg selv etter proteinsyntesen. Men det finnes unntak, som nevnt.
En tredje viktig
periodisk struktur er kollagenspiralen. Alle flercellede organismer inneholder
bindevevsproteinet kollagen, som i pattedyr utgjør mer enn en fjerdedel av alt
protein. Kollagenet er den viktigste fiberstrukturen i hud, bein, brusk, sener,
blodårer og tenner. Det bidrar også til å dirigere cellene i veksten og holde
dem sammen i atskilte enheter og finnes i nesten alle organer. Det er uløselig
i vann og danner fibre med høy strekkfasthet. Karakteristisk er også innholdet
av noen modifiserte aminosyrer, hydroksyprolin og hydroksylysin.
Hydroksylysinet binder karbohydrater i OH-gruppen, ofte disakkaridet laktose.
Alle varianter av
kollagen er bygd opp av spiraler uten interne hydrogenbindinger som dannes
spontant av kjeder av aminosyrer med store sidegrener, som f.eks. prolin, som
det er mye av i kollagen, fordi de store sidegrenene ellers er i veien for
hverandre. Her er det nøyaktig 3 aminosyrer pr. omdreining, og 3,12 Å mellom
hver aminosyre. Tre slike spiraler kobles sammen til kabler, og disse kablene
er også snodd, med nesten 3,3 aminosyrer pr. omdreining og 2,9 Å mellom hver
aminosyre. Inne i denne kabelen er det nokså dårlig plass, og for at det skal
være mulig å lage den i det hele tatt, har hver av kjedene glycin, den minste
av aminosyren, i den posisjonen som vender inn mot de andre kjedene. Alle
kollagenvarianter inneholder omtrent 33 % glycin. Strukturen er stabilisert med
hydrogenbindinger mellom NH på glycinet og CO på de andre kjedene.
En kollagenstruktur
bygges ved at disse kablene legges på rekke med et mellomrom mellom seg, og
andre kabler ligger inntil i liknende rekker, men litt forskjøvet slik at de
akkurat overlapper mellomrommene i naborekken. Disse mellomrommene danner
utgangspunktet når brusk omdannes til bein ved at det krystalliseres ut
kalsiumfosfat. Både i bein og andre strukturer blir kollagenet seigere og
hardere med tiden ved at det dannes tverrforbindelser. Aminogruppene i lysin
oksyderes til aldehyder som så begår aldolkondensasjon med hverandre. Noen
ganger kan disse aldolene også reagere med histidin fra andre nabogreiner.
Prosessen tar noen tid, og unge individer av de fleste dyr er merkbart mykere
og mindre seige enn eldre i konsistensen.
Kollagen er svært
motstandsdyktig mot enzymangrep, men enkelte bakterier inneholder enzymer,
kollagenaser, som spalter kollagen i småstykker og hjelper dem til å trenge
dypt inn i det infiserte vevet. Noen mikroparasitter bruker også slike enzymer
til å trenge inn gjennom huden, mens rumpetroll, insektlarver og andre
organismer som ødelegger sitt eget vev under utviklingen produserer svært
spesialiserte kollagenaser.
Elastin er et annet
fiberprotein som utgjør hovedbestanddelen av kroppens elastiske fibre. Det kan
strekkes til flere ganger sin opprinnelige lengde og vender raskt tilbake til
utgangstilstanden når det slippes igjen. Mesteparten av alt bindevev inneholder
elastin sammen med kollagen og polysakkarider. Store mengder er det i blodårer,
særlig i aorta like ved hjertet, og i leddbåndene. Gressetere har leddbånd i
nakken som er spesielt rike på elastin. Som kollagen har elastin en
spiralstruktur med glycin i 1/3 av aminosyreposisjonene og prolin som en
tallrik bestanddel. Men elastin inneholder enda færre polare aminosyrer og
mange upolare, alifatiske som alanin, valin, leucin og isoleucin. Det er ikke
noe hydroksylysin og bare få proliner er modifisert til hydroksyprolin.
Strukturen er litt mer komplisert enn i kollagenet. Det finnes lange sekvenser
hvor hver femte aminosyre er prolin og andre sekvenser som bare inneholder
lysin og alanin. I disse sekvensene dannes det tverrforbindelser mellom to
eller fire lysingrener i nabospiraler, trolig bidrar dette til at elastinet mer
effektivt vender tilbake til opprinnelig struktur når det er strukket.
Muskler består av
parallelle fibre, noen smale og noen brede. De brede består for det meste av
proteinet myosin, de smale av proteinene aktin, tropomyosin og troponin. Den
ene enden av aktinfibrene er festet til vegger av alfa-aktinin og fibrene
strekker seg ut i to retninger fra veggene mens myosinfibrene ligger fritt
mellom aktinfibrene. Det er når de myosinfibrene glir inn mellom aktinfibrene
at muskelen trekker seg sammen. Myosinet har enzymvirkning og fungerer som en
ATPase, d.v.s. de hydrolyserer ATP slik at energien frigjøres. Det er bygd opp
som en lang alfa-dobbeltspiral med et hode i enden på hver av enkeltspiralene.
Til hvert av hodene er det festet to mindre kjeder. Enzymaktiviteten sitter i hodene
og det er også de som binder seg til aktinet i de smale fibrene. I fibrene
ligger myosinmolekylene tvunnet i en spiralstruktur slik at det ligger en
spiral av myosinhoder ut mot endene mens alfaspiralendene ligger tvunnet rundt
hverandre i et "hodeløst" område på 1500 Å i midten. Aktinet består
av små kuler på ca. 42 kD, som ligger etter hverandre som perler på en snor, to
slike perlekjeder er snodd rundt hverandre i en dobbelt spiralstruktur som gjør
en hel omdreining hvert 720. Å. Myosinhodene binder seg spontant til aktin, men
sterkere til ATP, så hvis det er ATP til stede skiller de seg fra hverandre.
Når myosinhodet har bundet ATP ligger det skrått i forhold til aktinkjeden. Men
etter hydrolysen har det skiftet retning og står vinkelrett på aktinkjeden.
Hydrolyseproduktene (ADP og fosfat), er fremdeles festet til hodet, men hindrer
ikke at det bindes til aktin lenger. Når myosinhodet er bundet til aktinkjeden
igjen, frigjøres produktene, og hydrolyseenergien som har vært lagret i
myosinet gjør hodet istand til å vri seg på skrå igjen slik at myosinfiberen
trekkes inn mellom aktinkjedene, og så kan et nytt ATP bindes og det begynner
igjen. Noen av myosinhodene befinner seg utenfor aktinkjedene når muskelen er
helt utstrakt, og muskelen blir derfor sterkere når den trekker seg sammen
inntil alle er innenfor og kraften ikke kan øke lenger. Hver gang et ATP
forbrukes blir kjedene forskjøvet ca. 50 Å i forhold til hverandre. En
myosinfiber har ett til flere hundre hoder og en vanlig sammentrekning bruker 40
eller flere slike ATP-hydrolysesykluser, så en eneste fiber forbruker minst
4000 ATP på en eneste sammentrekning. Muskelbruk er den mest energikrevende av
alle biologiske prosesser, og et menneske som er i hardt fysisk arbeid bruker
mer enn 80 % av sine energiressurser til muskelsammentrekningene. Alle andre
livsprosesser må nøye seg med de øvrige knappe 20.
Myosinet trenger
magnesiumioner for å gjennomføre denne hydrolysesyklusen. Men for å regulere
hele muskelsystemet trengs kalsiumioner. Tropomyosin er et dobbelt
alfaspiralsnodd protein som når muskelen er avslappet ligger rundt aktinkjedene
og er kjemisk bundet til aktin-myosinbindingspunktene. Hver tropomyosintråd er
ca. 385 Å lang og de enkelte trådene bindes sammen av et troponin-kompleks, som
består av tre globulære proteiner. Når et av disse proteinene (troponin C)
opptar et kalsiumion trekker komplekset seg sammen slik at tropomyosintrådene
strammes, trekkes bort fra bindingspunktene og inn i furene mellom de to
spiralsnodde perlekjedene av aktin, slik at aktinet igjen kan bindes til
myosin. I hvilende muskler ligger kalsiumet gjemt i det sarkoplasmiske
nettverket, som omgir fiberbuntene. Ved hjelp av en pumpe som drives av ATP
(også hvilende muskler bruker energi) senkes Ca-konsentrasjonen til 0,000001 M
utenfor nettverket, mens den heves til 0,001 M der inne. Kalsiumionene bindes
til et surt protein som kalles kalsekvestrin og kan binde opptil 40
kalsiumioner. Vanligvis er det en spenningsforskjell på 75 mV mellom ytter- og
innersiden av yttermembranen til en muskelcelle. Men når det kommer en
nerveimpuls til muskelen blir yttermembranen avpolarisert, og dette forplanter
seg gjennom rør som går tvers gjennom det sarkoplasmiske nettverket og slipper
fri kalsiumionene slik at de kan trekke bort troponinet og myosinet begynner på
hydrolysesyklusen, binde, vri, slippe, binde, vri, slippe...
 ATP-innholdet i muskler holder
bare til en brøkdel av et sekunds arbeid. Derfor inneholder musklene til
virveldyr et reservoar av fosfokreatin, hvor fosfatbindingen er enda mer
energirik enn i ATP og fosfatgruppen kan overføres til det ADP som er igjen
etter ATPene av enzymet kreatinkinase. Noen virvelløse dyr bruker den liknende
forbindelsen fosfoarginin i stedet. Dermed kan man arbeide intenst i et
20-talls sekunder eller mer. Ikke få sprintere og mellomdistanseløpere spiser
kreatin, selv om det ikke er bevist at det hjelper noe. Men når fosfokreatinet
er i ferd med å brukes opp synker ATP-konsentrasjonen og konsentrasjonen av ADP
og AMP (adenosinmonofosfat, som dannes når to ADP slås sammen og gir ett ATP og
ett AMP) samt fritt fosfat stiger. Dette er et signal til å starte opp
sukkerforbrenningen og øke oksygeninntaket. Rødt kjøtt er farget av myoglobin,
som binder oksygen, og cytokrom, som katalyserer oksydasjonen, og er mer aerobt
enn det hvite kjøttet, som inneholder mindre av disse proteinene.
ATP-innholdet i muskler holder
bare til en brøkdel av et sekunds arbeid. Derfor inneholder musklene til
virveldyr et reservoar av fosfokreatin, hvor fosfatbindingen er enda mer
energirik enn i ATP og fosfatgruppen kan overføres til det ADP som er igjen
etter ATPene av enzymet kreatinkinase. Noen virvelløse dyr bruker den liknende
forbindelsen fosfoarginin i stedet. Dermed kan man arbeide intenst i et
20-talls sekunder eller mer. Ikke få sprintere og mellomdistanseløpere spiser
kreatin, selv om det ikke er bevist at det hjelper noe. Men når fosfokreatinet
er i ferd med å brukes opp synker ATP-konsentrasjonen og konsentrasjonen av ADP
og AMP (adenosinmonofosfat, som dannes når to ADP slås sammen og gir ett ATP og
ett AMP) samt fritt fosfat stiger. Dette er et signal til å starte opp
sukkerforbrenningen og øke oksygeninntaket. Rødt kjøtt er farget av myoglobin,
som binder oksygen, og cytokrom, som katalyserer oksydasjonen, og er mer aerobt
enn det hvite kjøttet, som inneholder mindre av disse proteinene.
Også andre celler med
bevegelige strukturer som f.eks. hvite blodlegemer, flimmerhåret i tarmene og
fosterceller på vandring til sine bestemmelsessteder bruker aktin og myosin.
Aktinet i primitive encellede dyr som slimsopper er også forbløffende likt
muskelaktinet hos virveldyrene, så dette proteinet er tydeligvis svært
motstandsdyktig mot evolusjon. Denne bevegelsesmekanismen må ha oppstått tidlig
og blitt det universelle midlet til bevegelse for eukaryotiske dyr og bare
blitt videreutviklet og vokst seg større med de voksende dyrene. Den finstemte
og følsomme muskelmekanikken til pattedyr og fugler bygger på de samme
reaksjonene mellom aktin og myosin som de eldste soppdyrene og ormene brukte
for 2 milliarder år siden. Aktinet utgjør en vesentlig andel av proteinet i
alle dyreceller og spiller en viktig rolle for strukturstabiliteten foruten at
de gjør cellen i stand til å utføre bevegelser, enten ved hjelp av myosin eller
ved at aktintråder festes til yttermembranene og andre strukturer i cellen og
løsnes igjen i en syklus. Planter har ikke muskler, men de bruker aktin til å
forme celler i vekst. Prokaryotene, de kjerneløse cellene, har ikke aktin eller
myosin.
En annen type tråder som
spiller en liknende rolle er såkalte mikrotubuler, som består av proteinene
alfa- og beta-tubulin. De har en diameter på ca. 240 Å, betydelig mer enn
aktintrådene (70 Å). De er også hule, og er bygd opp som en tett spiral av
avvekslende alfa- og betaenheter. Mikrotubuler er viktige for celledelingen,
siden de brukes til å dra de kopierte kromosomene fra hverandre, men også i
andre tilfelle der indre bestanddeler av cellen trenger å flyttes brukes
mikrotubuler, f.eks. ved en del kjemiske produksjonsprosesser der det først
lages en sekk kjemikalier som så skal slippes ut i omgivelsene. Mikrotubuler er
også hovedbestanddelen av cilier og flageller hos kjerneceller, hårliknende
utvekster som brukes av mange celler til diverse formål. Ciliene er en slags
årer som beveger en væskestrøm forbi en celle og bl.a. vifter urenheter ut av
lungene. Flageller brukes av frie celler som spermier og protozoer til
fremdriftsmiddel. Cilier og flageller har identisk indre struktur hos alle
levende vesener med kjerner i cellene. De består av et sentralt par
mikrotubuler omgitt av 9 par sammenvokste tubuler, hvor den ene, subfiber A,
har et helt rundt tverrsnitt mens den andre (B) sitter utenpå på den ene siden
av A. På den andre siden sitter det et enzym, en ATPase, som spalter ATP og får
fibrene til å forskyve seg i forhold til hverandre, slik at strukturen bøyes.
Membranproteiner ligger
nedsenket i cellevegger og andre membraner i cellene. De er globulære proteiner
og konstruert slik at når de er riktig sammenfoldet vil den delen som er inne i
membranen ha en stor del upolare, vannavstøtende aminosyrer på overflaten, mens
den delen som skal stikke ut, enten på den ene eller begge sider av membranen,
vil ha en stor del polare, vanntiltrekkende aminosyrer. Hvis proteinet kommer
ut av stilling og får litt av den vannavstøtende delen ut i vannet eller
omvendt, vil den på grunn av frastøtingen automatisk regulere seg på plass
igjen. Membranproteiner kan danne åpning mot omverdenen, kan pumpe molekyler
eller ioner ut og inn av cellen, kan reagere på fysiske impulser eller bestemte
molekyler i omgivelsene, kan overføre energi eller ha enzymfunksjon. Mange av
dem er glykoproteiner, hvor aminosyrene serin, treonin eller asparagin er
bundet til et eller flere sukkermolekyler, vanligvis glykosidene
N-acetylglukosamin eller N-acetylgalaktosamin. Sukkermolekylene befinner seg
alltid på den ytre overflaten og hjelper proteinene til å holde seg på plass
med sin sterke tiltrekning til vannet i omgivelsene. De spiller også sannsynligvis
en viss rolle for immunsystemets gjenkjennelsesfunksjoner ettersom det er mulig
å oppnå vide variasjoner i sammensetningen av sukkerkjedene.
En av de viktigste
oppgavene for membranproteinene er transport av en del substanser ut og inn av
cellene. Det foregår mye slik transport, også uten hjelp av membranproteinene.
Transportprosessene regulerer cellevolumet og den indre surhetsgraden og
ionesammensetningen til et gunstig nivå for enzymaktiviteten, de trekker inn
brennstoff og byggesteiner fra omgivelsene og kaster ut uønskede, giftige
substanser, de setter opp potensialforskjeller som gjør nerve- og muskelceller
følsomme for impulser. De fleste dyreceller inneholder mer kalium og mindre
natrium enn omgivelsene. Denne ionegradienten settes opp av et aktivt
pumpesystem som drives ved hydrolyse av ATP. Gradienten er svært viktig for
livsfunksjonene, den regulerer cellevolumet, gjør nerve- og muskelceller
følsomme for elektriske impulser og er viktige for transporten av sukker og
aminosyrer inn og ut av cellene. Av ATP-forbruket til et hvilende dyr (eller
menneske) går faktisk mer enn en 1/3 til denne pumpefunksjonen. Pumpemekanismen
består av proteiner som ligger i membranen og stikker ut på begge sider av den,
og den virker ved at proteinet binder ATP i en bestemt asparaginsyre på utsiden
i nærvær av magnesium og tre natriumioner. Proteinet har enzymatisk hydrolytisk
virkning på ATP og bruker trolig energien som frigjøres ved hydrolysen til å
forandre form slik at det lukker seg om ionene og åpner seg igjen på innsiden
av membranen. Den avhydrolyserte fosfatgruppen er fremdeles bundet til
proteinet, men avspaltes i nærvær av to kaliumioner, og energigevinsten ved
denne hydrolysen får proteinet til å lukke seg om kaliumionene og ta tilbake
sin opprinnelige form med åpning på utsiden. Det virker hemmende på mekanismen
hvis det er femverdig vanadium i form av vanadat inne i cellen, fordi vanadatet
konkurrerer ut fosfatet som det likner i fasongen, men er vanskeligere å spalte
av. Visse steroider som finnes i planteverdenen har en umettet fematomers
karbon-oksygenring som er avledet av krotonsyre, CH3CH:CHCOOH, og
hemmer pumpen når de binder seg til utsiden. Flere av dem, som bl.a. omfatter
digitalis-gruppen, brukes til hjertemedisin, når pumpen hemmes øker natriumkonsentrasjonen
i cellene og kalsium følger etter, slik at alle muskler virker kraftigere,
sterkere hjerteslag er den vesentlige fordelen for pasientene. Musklenes
kalsiumlager (det sarkoplasmiske nettverket) pumper inn kalsiumioner med en
ATP-drevet pumpe som fungerer etter samme prinsipp som Na-K-pumpen.
En slik Na-K-pumpe
brukes ved transport av glukose og aminosyrer inn i dyreceller. Den pumper ut
natriumioner slik at det oppstår et osmotisk trykk og nye natriumioner slipper
inn gjennom spesialiserte porter andre steder på cellen i følge med sukkeret
eller aminosyrene. En liknende mekanisme pumper kloridioner i tynntarmen.
Bakterier bruker et liknende system for å pumpe inn sukker og andre nyttige
molekyler gjennom membranen. Her er vanligvis pumpemekanismen en
"protonpumpe", som ved hjelp av elektrontransporten i åndingssystemet
er i stand til å pumpe ut protoner eller riktigere hydroniumioner (H3O+),
slik at pH inne i cellen faller og den får en indre negativ ladning. Dette
trekker hydroniumioner inn igjen gjennom spesialiserte proteiner som samtidig
tar inn sukkermolekyler og gjerne fosforylerer dem for å hindre at de slipper
ut gjennom cellemembranen igjen.
Membranproteiner brukes
også til å formidle kommunikasjon mellom celler. Noen bakterier og også
mitokondrier og kloroplaster i flercellede dyr og planter har kanaler gjennom
membranen laget av proteinet porin, som slipper molekyler med diameter mindre
enn 10 Å igjennom. Mange celler står i forbindelse med naboceller gjennom
porter som er laget av 6 proteinbunter og kan åpnes og lukker ved at de vris i
forhold til hverandre. Tydeligvis kan de lukkes ved å binde kalsiumioner, for
de er åpne når kalsiumkonsentrasjonen er under 0,0000001 M og helt lukket når
den er over 0,00005 M. Gjennom slike kanaler kan ioner og polare molekyler på
under ca. 1 kD ferdes fritt mellom cellene, mens proteiner, nukleinsyrer og
polysakkarider er for store. Slike porter er viktige i celler som skal arbeide
synkront, f.eks. i hjertemuskulaturen, og for ernæringen av celler som ikke har
en blodåre i nærheten, som f.eks. i knokkelvev og øyelinser.
En type celler som
kommuniserer på en mer indirekte måte er nervecellene. De leder elektriske
signaler gjennom nevronene sine og overfører signalet gjennom synapser med
andre nerveceller i endene av nevronene, eller til andre celler, f.eks.
muskelceller, eller de kan motta signaler fra sanseceller. Nevronene eller
nerveutløperne er beskyttet og isolert fra omverdenen av membranskikt som
kalles myelin og er tvunnet rundt nevronet i flerfoldige lag. En nerveimpuls
starter når membranen til en nervecelle blir avpolarisert på et mottakersted,
som kan være en synapse eller en kobling til en sansecelle. Denne elektriske
begivenheten føres videre langs nevronet ved hjelp av Na-K-pumper, som i
hviletilstanden er langt mer åpne for K+-ioner enn for Na+-ioner
og holder potensialet over membranen rundt -60 mV, som er nær verdien på -75 mV
som hadde vært potensialet hvis membranen bare hadde vært åpen for K+,
mens en membran som bare er åpen for Na+ har et potensiale på +30
mV. Potensialendringen fra den første avpolariseringen forplanter seg av seg
selv til nærmeste Na-K-pumpe, og når potensialet der har gått ned til -40 mV
reagerer den ved å åpne natriumkanalen, natriumioner strømmer inn i cellen og
avpolariserer membranen ytterligere, slik at flere Na-K-pumper i nærheten åpner
Na-kanalene sine. Potensialet blir positivt på et millisekund og når det når
likevektspotensialet for natriumioner på +30 mV stanser natriumstrømmen.
Samtidig åpner kaliumkanalene seg helt, kaliumioner strømmer ut og trekker
potensialet den andre veien, det ligger på -75 mV etter 2 millisekunder og
stabiliserer seg på -60 etter noen millisekunder til. Disse forandringene
forplanter seg langs hele utløperen til de når neste synapse eller
kontaktpunkt. Bare ca. en milliondel av alkaliionene i en nervecelle utveksles
i løpet av en slik nerveimpuls.
Slike Na-porter er nokså
spesifikke på natriumioner, de har tilsynelatende et tverrsnitt på 5 Å, som er
akkurat nok til å slippe gjennom et natriumion hydratisert med et vannmolekyl,
og akselerer etter alt å dømme transporten ved hjelp av hydrogenbindinger med
oksygenatomer i kanalen og karboksylgrupper som har ioneaffinitet til
metallionene. Hydratiserte litiumioner har rikelig med plass, og dette antas å
være årsaken til at litium har gunstig effekt mot depresjon. På nerveutløperne
ligger natriumkanalene konsentrert i såkalte Ranvier-noder, med ca. 2
millimeters mellomrom, hvor tettheten av kanaler er ca. 10000 pr. kvadratmikrometer.
Slike noder er de eneste stedene hvor myelinbeskyttede nerveutløpere har
direkte kontakt mellom membranen og de utenforliggende kroppsvæskene.
En slik avpolarisering
som fører til en nerveimpuls starter gjerne når visse ioneporter i et
forbindelsespunkt mellom to nerveceller utsettes for en transmittersubstans,
som kan være forskjellige ladde molekyler, ofte acetylcholin, CH3-COO-CH2-CH2-N+-(CH3)3,
som kobler seg til kanalproteinet og åpner det for gjennomstrømming av Na- og
K-ioner. Acetylcholinet produseres i den ene nervecellen og lagres i sekker
eller vesikler, som åpner seg mot omverdenen når det ankommer en nerveimpuls.
Hvis tilstrekkelig mange acetylcholinmolekyler passerer det 500 Å store
mellomrommet mellom nerveutløperne og binder seg til mottakercellens
reseptorer, synker potensialet over membran dens nok til at den ovennevnte
prosessen settes i gang, og impulsen føres videre. Enzymet acetylcholinesterase
hydrolyserer siden det bundne acetylcholinet, slik at potensialet kan
gjenopprettes.
Acetylcholinesterasen er
et svært hurtigvirkende enzym, som er bundet i reseptormembranen og
hydrolyserer et molekyl acetylcholin på 40 mikrosekunder(!) Dette er en
forutsetning for at synapser skal kunne overføre så mye som 1000 impulser i
sekundet. Det er tettpakket med både esterasemolekyler og
acetylcholinreseptorer på synapsemembranen, over 10000 av hver pr.
kvadrat-mikrometer (altså en milliondels kvadratmillimeter). Mange naturlige
gifter er giftige fordi de virker forstyrrende på dette systemet. Acetylcholin
brukes også til å overføre impulser fra nerver til muskelceller. I vanlige,
stripete skjelettmuskelceller åpner acetylcholinet natriumkanalene, slik at
muskelen trekker seg raskt og kraftig sammen. Men på de glatte
tarmmuskelcellene lukker de visse kaliumporter slik at muskelen trekker seg
sammen gradvis og langvarig.
 En rekke andre ladde organiske
forbindelser brukes også som nevrotransmittere. En rekke av dem lages i kroppen
med aminosyren tyrosin, som utgangspunkt og kalles katecholaminer. Tyrosinet
hydroksyleres til dopa, som i sin tur dekarboksyleres til dopamin, som
hydroksyleres til noradrenalin, en nevrotransmitter i det sympatiske
nervesystemet som virker på de musklene som trekker sammen blodårene og dermed
øker blodtrykket. Noradrenalin er også et hormon som produseres i binyrene og
øker hjertefrekvensen, utvider luftrørene i lungene og gjør arm- og
beinmusklene sterkere under stressituasjoner. Mangel på noradrenalin har
sammenheng med depresjon, og depresjoner kan derfor ofte lettes ved å tilføre
medisiner som øker tilgjengeligheten noradrenalin og serotonin, en annen viktig
nevrotransmitter. Noradrenalin metyleres til adrenalin, et annet hormon som
produseres i binyrene og får de perifere blodårene til å trekke seg sammen,
blodtrykket til å øke og hjerteslagene til å bli kraftigere. Katecholaminer
inaktiveres ved metylering av ring-hydroksylgruppen i posisjon 3, eller
deaminering til aldehyder.
En rekke andre ladde organiske
forbindelser brukes også som nevrotransmittere. En rekke av dem lages i kroppen
med aminosyren tyrosin, som utgangspunkt og kalles katecholaminer. Tyrosinet
hydroksyleres til dopa, som i sin tur dekarboksyleres til dopamin, som
hydroksyleres til noradrenalin, en nevrotransmitter i det sympatiske
nervesystemet som virker på de musklene som trekker sammen blodårene og dermed
øker blodtrykket. Noradrenalin er også et hormon som produseres i binyrene og
øker hjertefrekvensen, utvider luftrørene i lungene og gjør arm- og
beinmusklene sterkere under stressituasjoner. Mangel på noradrenalin har
sammenheng med depresjon, og depresjoner kan derfor ofte lettes ved å tilføre
medisiner som øker tilgjengeligheten noradrenalin og serotonin, en annen viktig
nevrotransmitter. Noradrenalin metyleres til adrenalin, et annet hormon som
produseres i binyrene og får de perifere blodårene til å trekke seg sammen,
blodtrykket til å øke og hjerteslagene til å bli kraftigere. Katecholaminer
inaktiveres ved metylering av ring-hydroksylgruppen i posisjon 3, eller
deaminering til aldehyder.
Forskjellige
nevrotransmittere kan ha forskjellig virkning i synapsene. Mottakernevronet kan
ha en rekke forskjellige kanaler som kan åpnes eller lukkes av et
nevrotransmittermolekyl og la ioner som klorid, kalium, natrium og kalsium
slippe gjennom. Nerveceller og andre celler med spesialiserte funksjoner kan ha
sine egne reseptorer som er følsomme for spesielle nevrotransmittere. Så godt
som alle medisiner som brukes i psykiatri og nevrologi virker ved å blokkere
eller forbedre virkningen av en eller flere nevrotransmittere, og det samme
gjelder de narkotiske stoffene. Betablokkere senker blodtrykket ved å blokkere
visse reseptorer i hjertemuskulaturen.
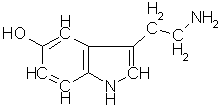 Serotonin er en nevrotransmitter
som lages ved å dekarboksylere aminosyren treonin. Den har spesielt viktige
oppgaver i hjernen og serotoninmangel kan føre til depresjoner og Parkinsons
sykdom, mens for høyt serotoninnivå kan føre til schizofreni. Serotonin virker
også hormonelt ved å trekke sammen de perifere blodårene. Blodplater som levrer
seg avgir serotonin og bidrar dermed både til å stanse blødningen og dempe
smertene.
Serotonin er en nevrotransmitter
som lages ved å dekarboksylere aminosyren treonin. Den har spesielt viktige
oppgaver i hjernen og serotoninmangel kan føre til depresjoner og Parkinsons
sykdom, mens for høyt serotoninnivå kan føre til schizofreni. Serotonin virker
også hormonelt ved å trekke sammen de perifere blodårene. Blodplater som levrer
seg avgir serotonin og bidrar dermed både til å stanse blødningen og dempe
smertene.
Mange peptider fungerer
som nevrotransmittere, spesielt i hjernen. Gode eksempler er enkefalinene, som
begge består av fem aminosyrer, tyrosin-glycin-glycin-fenylalanin og så
methionin i den ene og leucin i den andre. Begge virker som opiater, d.v.s. at
de overfører impulser til spesielle reseptorer i synapsene som får organismen
til å føle velvære.
Vasopressin er et
komplisert molekyl som fungerer både som hormon og nevrotransmitter. Som hormon
produseres det av hypofysen og øker blodtrykket ved å trekke sammen blodårene
og øker også nyrenes evne til å gjenoppta vann. Som nevrotransmitter brukes det
i hjernen, og spiller trolig en rolle i hukommelsesfunksjonene.
Gamma-aminosmørsyre, NH2-(CH2)3-COOH,
lages ved dekarboksylering av aminosyren glutaminsyre, NH2-CH(CH2-CH2-COOH)COOH.
Den virker som en signaldempende eller hemmende nevrotransmitter ved at den lar
flere kaliumioner slippe gjennom mottakermembranen.
På 1990-tallet ble det
oppdaget at det uorganiske nitrogenmonoksydet (NO) også er en viktig
nevrotransmitter, som har spesiell betydning for den seksuelle
ereksjonsfunksjonen, men også ser ut til å spille en rolle ved de forandringene
som skjer med synapsene i hjernen under læring. Molekylet er reaktivt og har
kort levetid i organismen, så det trenger ikke ryddes vekk aktivt slik som de
andre nevrotransmitterne. Det virker ved at det går inn i mottakernevronet
gjennom et membranprotein og stimulerer enzymet guanylatsyklase til å produsere
cAMP. Molekylet har også forbløffende mange andre funksjoner i organismen.
Sanseceller genererer
nerveimpulser på diverse intrikate måter. I det menneskelige øyet er netthinnen
dekket av to slags sanseceller, "tapper" og "staver".
Stavene er svært følsomme, de kan reagere på bare ett enkelt foton. Tappene er
ikke så følsomme, men er til gjengjeld bygd for å registrere farger. Stavene
inneholder lag på lag av dobbeltmembraner, som er besatt med mengdevis av
rhodopsin-molekyler. Rhodopsin er et membranprotein som er sammensatt av
proteinet opsin og den prostetiske gruppen 11-cis-retinal. Retinal er et
isoprenoid med en 9 atomer lang karbonkjede som inneholder 4 dobbeltbindinger.
Derfor er det også sterkt farget, og har en sterk lysabsorpsjonsevne. Rhodopsin
har en ekstinksjonskoeffisient ved absorpsjonstoppen 5000 Å på 40000/cm/M,
d.v.s. at i en løsning som er 1 molar på rhodopsin svekkes lyset til 1/40000 av
den opprinnelige styrken hvis det skinner gjennom 1 cm av løsningen. Pattedyr
trenger retinol, også kjent som vitamin A for å lage retinalet sitt. Retinalet
lages ved å oksydere alkoholgruppen til aldehyd med enzymet
retinoldehydrogenase, mens enzymet retinalisomerase 'bender' molekylet i
11-posisjonen til 11-cis retinal. Retinalet er bundet til proteinmolekylet med
en schiff-base-binding mellom aldehydgruppen og en aminogruppe.
Yttermembranen til
stavcellene er besatt med ionepumper som forbruker mye ATP til å pumpe Na-ioner
ut av cellen. I mørke diffunderer disse ionene inn igjen i en jevn strøm
gjennom åpne porter i membranen. Disse portene holder seg bare åpne hvis det er
mye av nukleotidet syklisk guanosinmonofosfat (cGMP) i stavcellen. cGMP
produseres jevnlig av enzymet guanylcyclase, som ikke påvirkes av lyset.
Når et foton av rett
energi treffer dobbeltbindingen i retinalmolekylet i 11-posisjonen blir
molekylet isomerisert tilbake til trans-konfigurasjonen igjen. Trans-retinalet
løsner fra opsinproteinet (fotolyse av rhodopsin). Det fotolyserte rhodopsinet
aktiviserer enzymet transducin, som igjen aktiviserer et annet enzym,
fosfodiesterase, som bryter ringstrukturen i cGMP slik at det ikke kan holde
natriumportene åpne. Ett eneste fotolysert rhodopsin aktiviserer hundrevis av
fosfodiesterasemolekyler, som hvert bryter ned hundrevis cGMP-molekyler, slik
at det blir en betydelig forsterkningseffekt. Hvert fosfodiesterasemolekyl
bryter ned ca. 1000 cGMP i sekundet.
Dessuten ser det ut til
å være en annen mekanisme som virker i samme retning. Rhodopsinet er et
membranprotein som sitter i avsnørte dobbeltmembranstykker som ligger som
skiver i lag på lag på tvers av stavcellen. Fotolysen fører til at opsinet
endrer konfigurasjon slik at en mengde kalsiumioner som er lagret inne i
dobbeltmembranene slipper ut. Trolig tetter disse ionene de åpne
natriumportene, slik at yttermembranen raskt polariseres av de aktive
natriumpumpene. I en stavcelle som er tilvendt mørke kan et eneste foton
frigjøre en million kalsiumioner.
Trans-retinalet løsner
fra opsinmolekylet og isomeriseres tilbake igjen av retinal isomerase slik at
det kan brukes om igjen.
Synsprosessene har
påfallende fellestrekk med det som skjer når et hormon blir bundet til
reseptorer i ytterveggene på en celle og det starter en forsterkende
reaksjonskaskade i cellen, og synet er antakelig utviklet fra en slik
hormonmekanisme.
Fargesyn er basert på
tapper i netthinnen. Allerede i 1802 slo en viss Thomas Young frampå med at
fargesynet bygde på tre fundamentale reseptorer, og idag vet vi at det er tre
slags tappceller i det menneskelige øyet, hver av dem er mest følsomme for lys
av en av de tre grunnfargene, blå, grønn og rød. Alle typene inneholder
rhodopsin med 11-cis-retinal som lysfanger, men opsinet er utstyrt atomgrupper
som modifiserer lysfølsomheten til retinalet slik at det blir tre
absorpsjonstopper på ca. 6100, 5300 og 4500 Å. Fargeblindhet skyldes at en av
tappetypene mangler eller at lysfølsomheten er forskjøvet slik at den ligger
nærmere en av de andre tappene. Ca. 1% av alle menn har ingen eller dårlig
oppfattelse av rødt og 2 % har problemer med grønt.
Foruten de strukturelle
proteinene og membranproteinene finnes en god del plasmaproteiner som flyter
fritt i plasmaet. En klasse av dem er de globulære eller kuleformede
proteinene, som har forskjellige funksjoner, men en spesielt viktig gruppe er
immunoglobulinene, også kalt antistoffer. De lages av dyr til forsvar mot
fremmede makromolekyler, som f.eks. proteiner, polysakkarider og nukleinsyrer.
Slike fremmede stoffer kalles antigener og for hvert antigen som påtreffes i
kroppen lages et spesifikt antistoff mot det molekylet. Små fremmede molekyler
fører ikke til noen slik reaksjon, vanligvis er slike molekyler noe kroppen kan
nyttiggjøre seg, men hvis de er bundet til et av disse makromolekylene kan det
dannes et antistoff mot akkurat den kombinasjonen.
Antistoffer lages i
plasmaceller, som er omdannede B-lymfocytter. De består generelt av en nøytral
del og to antigenbindende deler som hver består av to peptidkjeder. Der hvor de
tre delene møtes er de to kjedene i den nøytrale delen bundet til hverandre med
en disulfidbro og til hver sin av de lengste kjedene i de antigenbindende
delene med en peptidbinding mens de to kjedene i den antigenbindende delen er
bundet til hverandre med en disulfidbro. I den antigenbindende delen har hver
av disse kjedene en konstant og en variabel del. I DNAet som koder for kjedene
er det ett gen for den konstante, mens det er en rekke gener for de
forskjellige variantene av den variable. Dessuten settes de variable også
sammen av to deler som kan kombineres etter forgodtbefinnende og sammenkoblingsmåten
er også variabel, slik at det blir enda flere varianter, trolig over 10
millioner, men en plasmacelle er konstruert slik at den bare kan produsere en
av variantene. Det er sensasjonelt nok DNAet selv som endres i disse cellene
for å spesialisere dem til å produsere akkurat det ene antistoffet. Fra den
tidligste begynnelsen av et dyrs liv produseres alle mulige kombinasjoner, men
de B-lymfocyttene som påtreffer antigener før de er modne dør. Dermed
elimineres de lymfocyttene som produserer antistoffer for dyrets egne
makromolekyler. Når de er modne blir de derimot stimulert av å treffe et
antigen, de blir til plasmaceller som produserer store mengder immunoglobulin
og begynner å dele seg. Det er fem typer immunoglobulin, som alle produseres av
de samme cellene og skiller seg fra hverandre med forskjellige konstante deler.
Den ene, immunoglobulin M, produseres mest de to første ukene etter en
infeksjon, deretter overtar immunoglobulin G (også kalt gammaglobulin). IgM har
en masse på omtrent 1000 kD, mens igG er mindre, omtrent 150 kD. Molekylet av
G-globulinet har en slags trebladet propellform, men med et fleksibelt hengsel,
slik at de tre delene kan bevege seg i forhold til hverandre. To av delene kan
binde antigener, slik at det kan dannes utstrakte nettverk av sammenhengende
antigener og antistoffer. En fremmed celle som bindes av immunoglobin G vil
oftest sprekke og dø når et proteinkompleks som kalles komplementet binder seg
til den tredje delen av immunoglobulinet. Immunoglobin A, som ligger på 180-500
kD, skilles ut i spytt, tårer og tarm- og lungeslimhinnesekreter og danner det
ytterste forsvaret mot fremmedstoffene. Immunoglobulin D (175 kD) er det ikke
kjent hva som er vitsen med og det siste, immunoglobin E (200 kD) ser ut til
bare å være til bry, siden det spiller en hovedrolle i allergireaksjoner.
En rekke andre
bestanddeler inngår også i immunsystemet. B-lymfocyttene er avhengig av
samarbeide med en rekke andre celler for å fungere, og er ikke virksomme mot
virus når de ligger skjult i kroppens egne celler. Men virusene legger ofte
igjen proteindekselet sitt på utsiden når de går inn i cellen, og dette
benyttes av en underart av en annen lymfocytt, T-cellene, som har reseptorer på
overflaten som produseres på omtrent samme måte som antistoffene og derfor er
like variable. Disse cellene kan ødelegge de av kroppens egne celler som har
slike virusrester på overflaten.
Disse T-cellene har også
reseptorer som passer til en tredje type variabelt protein, nemlig
hovedhistokompatibilitetskompleks-proteinene, eller MHC blant venner. Disse
proteinene sitter på overflaten av alle kroppens celler og er like for alle
cellene i en organisme, men vanligvis forskjellige fra individ til individ. De
tjener som kjennemerke for kroppens egne celler, og transplantert vev hvor
MHC-proteinene er for forskjellige fra kroppens egne blir betraktet som fremmed
og angrepet av immunsystemet. Det er flere forskjellige typer eller klasser av
MHC-proteiner. Hos nære slektninger er de som regel ganske like (men ikke alltid),
og transplantasjoner mellom nære slektninger vil derfor oftere være vellykket
enn ellers.
Hemoglobin er et middel
som virveldyrene bruker til å kompensere for den dårlige løseligheten av
oksygen i vann. En liter blod uten hemoglobin kan løse 5 ml oksygengass, men
med hemoglobinet frakter den en kvart liter! Myoglobinet, som finnes i
musklene, fungerer som et reserveforråd av oksygen og hjelper til med å
transportere oksygenet rundt i musklene. Begge er proteiner, av den globulære
typen, men til oksygentransporten har de knyttet et annet molekyl (prostetisk
gruppe), nemlig hem, et porfyrinderivat som inneholder sykliske aminer med sure
hydrogener som kan binde et metallatom, i dette tilfellet jern, som gir både
blodet og musklene (kjøttet) den røde fargen:
 Porfyrinet er et plant molekyl
med mange dobbeltbindinger som har sterk resonansstabilisering, særlig når den
har bundet metall. Når jernet i midten er toverdig kan det også binde et
oksygenmolekyl. Jernet kan også oksyderes til treverdig, men fungerer da ikke
som oksygenbærer. Jernet er kompleksbundet til de 4 nitrogenatomene. I
kompleksforbindelser har jern 6 posisjoner hvor det kan danne bindinger med
andre atomer. Den femte, utenfor porfyrinplanet, opptas av et nitrogenatom på
aminosyren histidin i proteinet. Den sjette, på motsatt side, står fri til det
ene atomet i oksygenmolekylet. Det henger et annet histidin like over denne
plassen, som vanskeliggjør binding av andre molekyler som skader
oksygenopptaket, som karbonmonoksyd, cyanid, karbontetraklorid og DDT, for
eksempel. Dette histidinet bidrar også til å hindre at to hem-grupper kan
møtes, noe som kan føre til at jernatomene oksyderes hvis et av dem har bundet
oksygen. Hemet og andre porfyriner (som klorofyll) lages av aminosyren glycin
og ravsyre, et av mellomproduktene i sukkermetabolismen. Når et rødt blodlegeme
dør blir hemet i hemoglobin spaltet og rullet opp til en kjede av pyrrolringer,
jernatomet fraktes til ferritinproteiner som lagrer jern, mens det spaltede
hemet omdannes til bilirubin som kan utskilles, fortrinnsvis gjennom gallen. Et
blåmerke etter slag består av blod fra de årene som ble sprengt av slaget.
Neste gang du slår deg kan du studere de gradvise overgangene fra hem via
mellomformen, det grønne biliverdinet, til det rødbrune/gulbrune bilirubinet.
Porfyrinet er et plant molekyl
med mange dobbeltbindinger som har sterk resonansstabilisering, særlig når den
har bundet metall. Når jernet i midten er toverdig kan det også binde et
oksygenmolekyl. Jernet kan også oksyderes til treverdig, men fungerer da ikke
som oksygenbærer. Jernet er kompleksbundet til de 4 nitrogenatomene. I
kompleksforbindelser har jern 6 posisjoner hvor det kan danne bindinger med
andre atomer. Den femte, utenfor porfyrinplanet, opptas av et nitrogenatom på
aminosyren histidin i proteinet. Den sjette, på motsatt side, står fri til det
ene atomet i oksygenmolekylet. Det henger et annet histidin like over denne
plassen, som vanskeliggjør binding av andre molekyler som skader
oksygenopptaket, som karbonmonoksyd, cyanid, karbontetraklorid og DDT, for
eksempel. Dette histidinet bidrar også til å hindre at to hem-grupper kan
møtes, noe som kan føre til at jernatomene oksyderes hvis et av dem har bundet
oksygen. Hemet og andre porfyriner (som klorofyll) lages av aminosyren glycin
og ravsyre, et av mellomproduktene i sukkermetabolismen. Når et rødt blodlegeme
dør blir hemet i hemoglobin spaltet og rullet opp til en kjede av pyrrolringer,
jernatomet fraktes til ferritinproteiner som lagrer jern, mens det spaltede
hemet omdannes til bilirubin som kan utskilles, fortrinnsvis gjennom gallen. Et
blåmerke etter slag består av blod fra de årene som ble sprengt av slaget.
Neste gang du slår deg kan du studere de gradvise overgangene fra hem via
mellomformen, det grønne biliverdinet, til det rødbrune/gulbrune bilirubinet.
Myoglobinet består av et
molekyl hem og et proteinmolekyl. Hemoglobinet består av fire hem og fire
proteinkjeder som er parvis identiske (to a- og to b-enheter). Begge likner myoglobinproteinet ganske mye, men ingen
er helt identiske med det. Hemoglobinet er kanskje utviklet fra myoglobin av
dyr som frakter oksygen i blodet.
I tillegg til oksygen
frakter hemoglobin også karbondioksyd og hydronium(H3O+)-ioner.
Karbondioksydet fraktes tilbake til lungene igjen etter forbrenningsprosessene
bundet til visse aminosyrer på hemoglobinet uten at hemgruppene er direkte
innblandet. I motsetning til myoglobinet kan hemoglobinet regulere
oksygenbindingsevnen når det får kontakt med visse molekyler i omgivelsene,
hydroniumioner, karbondioksyd og organiske fosfater - gjennom såkalte
allosteriske interaksjoner, d.v.s. at noe som skjer et sted på molekylet
påvirker noe som skjer et helt annet sted. Dette er en evne som mange proteiner
har og som er av stor betydning for mange livsprosesser. I arbeidende muskler
produseres det mye karbondioksyd og syre, og disse stoffene senker pH og
reduserer oksygenbindingen til hemoglobin, slik at det gir fra seg mer oksygen.
Myoglobin binder mye oksygen ved et oksygentrykk fra ca. 1/1000 atmosfære og
oppover. Det samme er tilfelle med hemoglobin utenfor de røde blodlegemene. I
lungene er oksygentrykket ca. 0,13 atmosfærer, mens det ute i kapillærårene er
under 0,03. Derfor inneholder de røde blodlegemene i tillegg til hemoglobin
like mange molekyler 2,3-difosfoglysersyre, (DPG), som reduserer hemoglobinets
oksygenbindingsevne slik at det ikke binder mye oksygen før oksygenets
partialtrykk kommer opp i over 0,03 atmosfærer, ellers ville det ikke kunnet gi
fra seg noe av det i kapillærene. DPG spiller en viss rolle ved
høydeakklimatisering, f.eks. øker DPG-innhholdet i blodlegemene fra 4,5 til 7
millimol på 2 dager hvis en person flytter seg fra havnivå til 4500 m. Fostre
har en annen type hemoglobin enn fødte mennesker. Den binder DPG svakere og
derfor oksygen sterkere, slik at oksygenet lettere overføres fra morens blod i
morkaken.
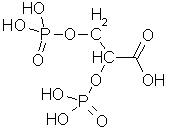 Enzymer er spesielle proteiner
som er spesialbygd til å utføre eller katalysere bestemte kjemiske reaksjoner
som er nødvendig for de levende organismene. Få kjemiske reaksjoner i
biologiske systemer går uten enzymenes katalytiske hjelp, de har enorme
katalytiske evner og kan akselerere en reaksjon med en faktor på flere
millioner. Enzymene virker ved at de binder et eksemplar av det molekylet de
skal virke på (substratet) i en posisjon på enzymmolekylet som er bygd spesielt
for å gi plass til akkurat et slikt substratmolekyl og binde det med
forholdsvis svake krefter, som hydrogenbindinger og elektrostatisk tiltrekning til
reaksjonen er over. Ofte er ikke de vanlige funksjonelle gruppene til
aminosyrene som enzymproteinet er bygd av nok til å få istand den nødvendige
reaksjonen, og mange enzymer er derfor modifisert med en såkalt prostetisk
gruppe eller er avhengig av et lite molekyl, et såkalt koenzym, som det virker
sammen med under reaksjonen. Koenzymet blir gjerne forandret under reaksjonens
løp, ofte oksydert eller redusert, og blir siden reparert et annet sted i
cellen for å komme tilbake til den virksomme formen igjen. Enzymnavn slutter
vanligvis på -ase. Resten av navnet tas gjerne fra substratmolekylet, f.eks. er
ATPase et enzym som gjør noe med ATP, og ofte tas det også med noe om hva
enzymet gjør, f.eks. er mutaser enzymer som flytter en atomgruppe på et molekyl
og kinaser er enzymer som flytter en fosfatgruppe fra et molekyl til et annet.
Hypoxantinguaninfosforibosyltransferase er som navnet enkelt sier et enzym som
overfører en fosforibosylgruppe til hypoxantin eller guanin (for å danne
nukleotidene inosinfosfat og guanosinfosfat).
Enzymer er spesielle proteiner
som er spesialbygd til å utføre eller katalysere bestemte kjemiske reaksjoner
som er nødvendig for de levende organismene. Få kjemiske reaksjoner i
biologiske systemer går uten enzymenes katalytiske hjelp, de har enorme
katalytiske evner og kan akselerere en reaksjon med en faktor på flere
millioner. Enzymene virker ved at de binder et eksemplar av det molekylet de
skal virke på (substratet) i en posisjon på enzymmolekylet som er bygd spesielt
for å gi plass til akkurat et slikt substratmolekyl og binde det med
forholdsvis svake krefter, som hydrogenbindinger og elektrostatisk tiltrekning til
reaksjonen er over. Ofte er ikke de vanlige funksjonelle gruppene til
aminosyrene som enzymproteinet er bygd av nok til å få istand den nødvendige
reaksjonen, og mange enzymer er derfor modifisert med en såkalt prostetisk
gruppe eller er avhengig av et lite molekyl, et såkalt koenzym, som det virker
sammen med under reaksjonen. Koenzymet blir gjerne forandret under reaksjonens
løp, ofte oksydert eller redusert, og blir siden reparert et annet sted i
cellen for å komme tilbake til den virksomme formen igjen. Enzymnavn slutter
vanligvis på -ase. Resten av navnet tas gjerne fra substratmolekylet, f.eks. er
ATPase et enzym som gjør noe med ATP, og ofte tas det også med noe om hva
enzymet gjør, f.eks. er mutaser enzymer som flytter en atomgruppe på et molekyl
og kinaser er enzymer som flytter en fosfatgruppe fra et molekyl til et annet.
Hypoxantinguaninfosforibosyltransferase er som navnet enkelt sier et enzym som
overfører en fosforibosylgruppe til hypoxantin eller guanin (for å danne
nukleotidene inosinfosfat og guanosinfosfat).
Noen enzymer og andre
proteiner lages bare i et inaktivt forstadium og aktiviseres etter behov,
f.eks. ved å splitte peptidkjeden på et bestemt punkt eller andre
modifikasjoner. Eksempler er bukspyttkjertelens og magesekkens enzymer som
hydrolyserer protein i fordøyelsen og bare er aktive når det er mat til stede,
de som får blod til å levre seg ved kontakt med luft, de hormonene som er bygd
opp av peptider og bare brukes til spesielle formål, samt strukturbyggende
proteiner som transporteres til "byggeplassen" i en uvirksom, men
vannløselig form. Mange enzymer reguleres f.eks. ved at sluttproduktet i en
syntese inaktiverer det enzymet som katalyserer et av de tidligere
syntesetrinnene eller ved at det lages visse molekyler som inaktiverer dem,
enten ved å konkurrere ut substratet eller ved å binde seg til et spesielt
inhibisjonssted på molekylet. Enzymer opptrer også som kroppens banksystem, ved
at de konverterer forskjellige typer energi til kroppens energivaluta, ATP, med
en høy grad av effektivitet.
Koenzym A brukes av
flere enzymer til å overføre acetylgrupper eller andre beslektede grupper ved
mange reaksjoner i biologisk syntese og spiller en særlig viktig rolle i
forbrenningen. Det likner ATP til et visst punkt:
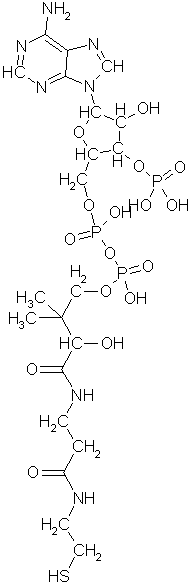 Tiolgruppen nederst på molekylet
er stedet hvor acetyl- og de andre gruppene bindes for senere overføring.
Molekylet er satt sammen av tre deler, den øverst på figuren stammer fra ATP,
den nederste fra 2-aminoetantiol, mens den i midten stammer fra pantotensyre,
CH2OHC(CH3)2CHOHCONHCH2CH2COOH
(eller N-(2-karboksyetyl)-2,4-dihydroksy-3,3-dimetylsmørsyreamid om du
foretrekker det). Pantotensyre hører til en gruppe forbindelser som dyrekropper
ikke er noe spesielt flinke til å lage selv og derfor må tilføres utenfra.
Nesten alle er vesentlige råstoffer for koenzymer til viktige enzymer. Med et
fellesnavn kalles de vitaminer, fordi man opprinnelig trodde at alle inneholdt
nitrogen, og fikk tidlig bokstavbetegnelser. De deles gjerne inn i de
fettløselige A, D, E, F, K, og vannløselige B, C, H, P, PP, T. B er siden skilt
ut i en rekke vidt forskjellige stoffer, som ikke fikk sine egne bokstaver, men
bare nummersubskripter på B'en. Pantotensyre regnes gjerne for å høre til dette
B-komplekset. Som vitaminer regnes alle livsnødvendige stoffer som ikke primært
brukes som energikilde og som er essensiell for organismen, d.v.s. at den ikke
kan danne det selv eller ikke kan danne det i tilstrekkelige mengder. Det som
er vitamin for en organisme kan ofte være likegyldig for en annen. F.eks. er
paraaminobenzosyre vitamin for en del bakterier, som kan bygge vårt vitamin
folsyre ut fra den, derfor har sulfanilamid eller paraaminobenzosulfonsyre vært
brukt mot bakterieinfeksjoner.
Tiolgruppen nederst på molekylet
er stedet hvor acetyl- og de andre gruppene bindes for senere overføring.
Molekylet er satt sammen av tre deler, den øverst på figuren stammer fra ATP,
den nederste fra 2-aminoetantiol, mens den i midten stammer fra pantotensyre,
CH2OHC(CH3)2CHOHCONHCH2CH2COOH
(eller N-(2-karboksyetyl)-2,4-dihydroksy-3,3-dimetylsmørsyreamid om du
foretrekker det). Pantotensyre hører til en gruppe forbindelser som dyrekropper
ikke er noe spesielt flinke til å lage selv og derfor må tilføres utenfra.
Nesten alle er vesentlige råstoffer for koenzymer til viktige enzymer. Med et
fellesnavn kalles de vitaminer, fordi man opprinnelig trodde at alle inneholdt
nitrogen, og fikk tidlig bokstavbetegnelser. De deles gjerne inn i de
fettløselige A, D, E, F, K, og vannløselige B, C, H, P, PP, T. B er siden skilt
ut i en rekke vidt forskjellige stoffer, som ikke fikk sine egne bokstaver, men
bare nummersubskripter på B'en. Pantotensyre regnes gjerne for å høre til dette
B-komplekset. Som vitaminer regnes alle livsnødvendige stoffer som ikke primært
brukes som energikilde og som er essensiell for organismen, d.v.s. at den ikke
kan danne det selv eller ikke kan danne det i tilstrekkelige mengder. Det som
er vitamin for en organisme kan ofte være likegyldig for en annen. F.eks. er
paraaminobenzosyre vitamin for en del bakterier, som kan bygge vårt vitamin
folsyre ut fra den, derfor har sulfanilamid eller paraaminobenzosulfonsyre vært
brukt mot bakterieinfeksjoner.
 Vitamin A eller retinol, som i
kroppen oksyderes til retinal (CH2OH blir til CHO) og brukes i
synsprosessene og er nødvendig for veksten hos unge dyr. Også retinalet selv og
dehydroretinol (vitamin A2), hvor det er en eller to ekstra
dobbeltbindinger i ringen, regnes som vitaminer. Også b-karoten, som består av to molekyler retinol koblet sammen i
OH-endene med OH-gruppene fjernet, kan omdannes til retinal i kroppen.
Vitamin A eller retinol, som i
kroppen oksyderes til retinal (CH2OH blir til CHO) og brukes i
synsprosessene og er nødvendig for veksten hos unge dyr. Også retinalet selv og
dehydroretinol (vitamin A2), hvor det er en eller to ekstra
dobbeltbindinger i ringen, regnes som vitaminer. Også b-karoten, som består av to molekyler retinol koblet sammen i
OH-endene med OH-gruppene fjernet, kan omdannes til retinal i kroppen.
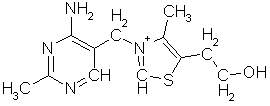 Vitamin B1 eller
tiamin fosforyleres i kroppen (i OH-gruppen) til tiaminpyrofosfat, hjelper
enzymene pyruvatdehydrogease til å bidra til produksjonen av koenzym A, a -ketoglutaratdehydrogenase til å bidra i sukkerforbrenningen og
transketolase til å omdanne sukkermolekyler som brukes til forbrenning eller
nukleotidbygging eller liknende. Mangel fører til beri-beri, som karakteriseres
ved smerter i bein og armer, muskelsvakhet og uregelmessigheter i følsomheten i
huden. Hjertet kan være forstørret og ha svekket pumpefunksjon. Beri-beri har
vært et stort problem i Asia fordi ris er en dårlig tiaminkilde, spesielt ved
bruk av polert ris, siden det meste av det tiaminet som finnes i risen sitter i
skallet.
Vitamin B1 eller
tiamin fosforyleres i kroppen (i OH-gruppen) til tiaminpyrofosfat, hjelper
enzymene pyruvatdehydrogease til å bidra til produksjonen av koenzym A, a -ketoglutaratdehydrogenase til å bidra i sukkerforbrenningen og
transketolase til å omdanne sukkermolekyler som brukes til forbrenning eller
nukleotidbygging eller liknende. Mangel fører til beri-beri, som karakteriseres
ved smerter i bein og armer, muskelsvakhet og uregelmessigheter i følsomheten i
huden. Hjertet kan være forstørret og ha svekket pumpefunksjon. Beri-beri har
vært et stort problem i Asia fordi ris er en dårlig tiaminkilde, spesielt ved
bruk av polert ris, siden det meste av det tiaminet som finnes i risen sitter i
skallet.
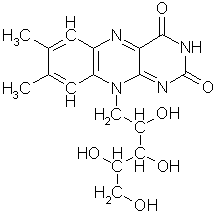 Vitamin B2 eller riboflavin
består av en flavin-trippelring + en utrullet riboseenhet. I kroppen omdannes
det til flavin-adenin-dinukleotid (FAD) ved at et molekyl adenosindifosfat
fosforyleres inn på OH-gruppen nederst på tegningen. FAD brukes av en rekke
enzymer til redoksreaksjoner i forbrenningsprosessene, og kan også være
innblandet i syntese av umettede fettsyrer i noen organismer. Oksydasjon skjer
ved at nitrogenet øverst på midtringen og nederst på uracilringen til høyre
begge tar opp et hydrogenatom mens dobbeltbindingene til nabokarbonene blir
enkle. Dermed dannes FADH2, som kan utføre en reduksjon ved å avgi
hydrogenene igjen. Kroppen bruker også riboflavin til å lage
flavin-mononukleotid (FMN), ved å koble en enkel fosfatgruppe på den nederste
OH-gruppen. FMN virker på samme måte som FAD, og brukes av et enzym i
respirasjonsprosessen.
Vitamin B2 eller riboflavin
består av en flavin-trippelring + en utrullet riboseenhet. I kroppen omdannes
det til flavin-adenin-dinukleotid (FAD) ved at et molekyl adenosindifosfat
fosforyleres inn på OH-gruppen nederst på tegningen. FAD brukes av en rekke
enzymer til redoksreaksjoner i forbrenningsprosessene, og kan også være
innblandet i syntese av umettede fettsyrer i noen organismer. Oksydasjon skjer
ved at nitrogenet øverst på midtringen og nederst på uracilringen til høyre
begge tar opp et hydrogenatom mens dobbeltbindingene til nabokarbonene blir
enkle. Dermed dannes FADH2, som kan utføre en reduksjon ved å avgi
hydrogenene igjen. Kroppen bruker også riboflavin til å lage
flavin-mononukleotid (FMN), ved å koble en enkel fosfatgruppe på den nederste
OH-gruppen. FMN virker på samme måte som FAD, og brukes av et enzym i
respirasjonsprosessen.
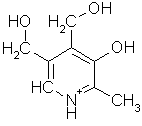 Vitamin B6 er pyridoksin eller
pyridoksol. Som vitamin B6 regnes også pyridoksal, med en aldehydgruppe i stedet
for hydroksymetylgruppe i 4-posisjonen øverst på tegningen, og pyridoksamin,
som i stedet har en metylaminogruppe i den samme posisjonen. Pyridoksin er den
prostetiske gruppen til alle 2 transaminasene, enzymer som gjør det mulig å
forbrenne aminosyrer ved å fjerne aminogruppen. I kroppen foreligger gruppen
som pyridoksalfosfat, med en fosfatgruppe forestret til alkoholgruppen til
venstre. Aldehydgruppen opptar aminogruppen og pyridoksalfosfatet blir til
pyridoksaminfosfat. Deretter leveres aminogruppen videre igjen til
alfa-ketoglutarat, som derved blir til glutamat, som også er en av aminosyrene.
Enzymet glutamatdehydrogenase deaminerer så glutamatet med NAD+ slik at
alfa-ketoglutaratet gjendannes og aminogruppen frigjøres som et ammoniumion.
Glutamattransaminasen er den vanligste, men hos pattedyr er det også mye
alanintransaminase, som overfører aminogruppen til pyruvat slik at det dannes
alanin. Aminogruppen i alaninet må deretter overføres til glutamat av den
dertil egnede transaminasen før den kan frigjøres. Kan også dekarboksylere,
direkte deaminere, racemisere og aldolkløve aminosyrer.
Vitamin B6 er pyridoksin eller
pyridoksol. Som vitamin B6 regnes også pyridoksal, med en aldehydgruppe i stedet
for hydroksymetylgruppe i 4-posisjonen øverst på tegningen, og pyridoksamin,
som i stedet har en metylaminogruppe i den samme posisjonen. Pyridoksin er den
prostetiske gruppen til alle 2 transaminasene, enzymer som gjør det mulig å
forbrenne aminosyrer ved å fjerne aminogruppen. I kroppen foreligger gruppen
som pyridoksalfosfat, med en fosfatgruppe forestret til alkoholgruppen til
venstre. Aldehydgruppen opptar aminogruppen og pyridoksalfosfatet blir til
pyridoksaminfosfat. Deretter leveres aminogruppen videre igjen til
alfa-ketoglutarat, som derved blir til glutamat, som også er en av aminosyrene.
Enzymet glutamatdehydrogenase deaminerer så glutamatet med NAD+ slik at
alfa-ketoglutaratet gjendannes og aminogruppen frigjøres som et ammoniumion.
Glutamattransaminasen er den vanligste, men hos pattedyr er det også mye
alanintransaminase, som overfører aminogruppen til pyruvat slik at det dannes
alanin. Aminogruppen i alaninet må deretter overføres til glutamat av den
dertil egnede transaminasen før den kan frigjøres. Kan også dekarboksylere,
direkte deaminere, racemisere og aldolkløve aminosyrer.
Vitamin B12 eller
kobalamin har den samme plane, pyrrolbaserte grunnstrukturen som hemet i
hemoglobin, men er en smule mer komplisert:

Den plane
porfyrinliknende strukturen i midten kalles corrin og binder et koboltatom der
hemet har et atom jern. På den ene siden av ringplanet er koboltatomet
koordinert til et karbon i sukkerdelen av et nukleosid, adenosin (den eneste
metall-karbonbindingen som er kjent i et biologisk molekyl). På den andre siden
koordineres det til et nitrogen i nukleotidet dimetylbenzimidazidolfosfat som
er bundet til ringen med en amidbinding. Det er også mange andre amidgrupper på
ringen. Den aktive formen som er vist her har kobolt i oksydasjonstrinn +1.
Koboltatomet kan også ha trinnene +2 og +3. I den sistnevnte, som er den
vanlige inaktive formen er et hydroksylion koordinert til koboltatomet i stedet
for den frie adenosingruppen. Forskjellige flavoproteiner katalyserer
overgangen mellom de forskjellige trinnene. Kobalamin brukes av forskjellige
enzymer som omarrangerer karbonskjelettet i forskjellige molekyler og dessuten
de som binder metylgrupper til substratet. Når de er i aktivitet brytes
Co-C-bindingen i kobalaminet og en metylgruppe eller et karbonatom på
substratet bindes der i stedet. Ved omarrangeringer spaltes gjerne
substratmolekylet slik at den delen som er bundet til koboltatomet kan flyttes
til et annet sted på molekylet. Mange enzymer som katalyserer syntese og
nedbrytning av aminosyrer har kobalamin som prostetisk gruppe.
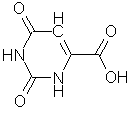 Som vitamin B13 regnes gjerne
orotinsyre:
Som vitamin B13 regnes gjerne
orotinsyre:
Denne brukes i kroppen til å lage uracil-nukleotider. Den lages også av
asparaginsyre, og kan vanskelig regnes for essensiell, som de regulære
vitaminene.
Vitamin B14 eller
xantopterin kan i kroppen omdannes til folsyre, se nedenfor. Xantopterinet er
dobbeltringen til venstre på illustrasjonen.
Et antatt vitamin er
pangaminsyre eller N,N-dimetylglycin, (CH3)2NCH2COOH,
som betegnes vitamin B15 og har vært antatt å spille en rolle ved produksjon av
aminosyrer og i glukoseforbrenningen og muligens kan fungere som antioksydant,
kan senke blodkolesterolet og forbedre blodsirkulasjonen, men ingen slik
virkning er fastslått.
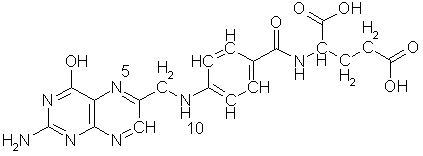 Folsyre eller
pteroylmonoglutaminsyre eller vitamin Bc omdannes i kroppen til
tetrahydrofolsyre eller folinsyre ved at de fire atomene lengst til høyre i den
midterste av de tre ringene på tegningen tilføres hydrogen mens
dobbeltbindingene reduseres til enkle. Dette koenzymet brukes av mange enzymer
til å overføre grupper med ett karbonatom på nitrogenet i posisjon 5 og/eller
10 som er markert på tegningen. Gruppene som kan fraktes er metyl, -CH3,
metylen, -CH2-, formyl, -CHO, formimin, -CH:NH eller metenyl -CH=.
Blant produktene er aminosyrene metionin og glycin, purinbaser og thymin, og
koenzymet brukes også til å frakte vekk slike smågrupper ved nedbrytning av
forskjellige stoffer.
Folsyre eller
pteroylmonoglutaminsyre eller vitamin Bc omdannes i kroppen til
tetrahydrofolsyre eller folinsyre ved at de fire atomene lengst til høyre i den
midterste av de tre ringene på tegningen tilføres hydrogen mens
dobbeltbindingene reduseres til enkle. Dette koenzymet brukes av mange enzymer
til å overføre grupper med ett karbonatom på nitrogenet i posisjon 5 og/eller
10 som er markert på tegningen. Gruppene som kan fraktes er metyl, -CH3,
metylen, -CH2-, formyl, -CHO, formimin, -CH:NH eller metenyl -CH=.
Blant produktene er aminosyrene metionin og glycin, purinbaser og thymin, og
koenzymet brukes også til å frakte vekk slike smågrupper ved nedbrytning av
forskjellige stoffer.
Til B-komplekset regnes
også gjerne cholin, (CH3)3N+CH2CH2OH,
som inngår i membrandannende fosfoglyserider (se under lipidkapitlet) og i den
universale nevrotransmitteren acetylcholin. Men cholin kan også dannes i
kroppen av aminosyren serin, iallfall for fosfoglyserider, ved dekarboksylering
og metylering. Forbruket som nevrotransmitter er heller ikke stort, siden
molekylet ustanselig resirkuleres i synapsene.
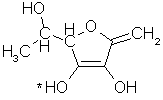 Vitamin C eller askorbinsyre har
sammensetningen:
Vitamin C eller askorbinsyre har
sammensetningen:
(* markerer det sure hydrogenet). Det er et effektivt reduksjonsmiddel som hjelper
enzymet prolylhydroksylase med å holde et bundet jernatom nede i det laveste
oksydasjonstrinnet. Dette enzymet fyller en livsviktig oppgave for alle
organismer som inneholder bindevevsproteinet kollagen, siden det hydroksylerer
aminosyren prolin til hydroksyprolin, en viktig bestanddel av kollagenet, det
hever smeltepunktet slik at det kan danne fibre ved normal kroppstemperatur. De
fleste organismer lager nok C-vitamin selv av glukose eller galaktose, men
bl.a. primater og marsvin, som normalt har rikelig med frukt og andre gode
C-vitaminkilder i kosten, har mistet denne evnen, slik at de må tilføres
askorbinsyre daglig. Mangel fører til skjørbuk (latin scorbutus, derav navnet
askorbinsyre), en ganske dramatisk sykdom som virker ødeleggende på alt nydannet
kollagen i kroppen og fører til svekkelse, indre blødninger, hudskader,
oppløsning av tannkjøttet, tannfelling og håravfall, noe som også er en ganske
god illustrasjon på hvor raskt vevet fornyes i en kropp. Som reduksjonsmiddel
(antioksydant) har askorbinsyre en god effekt mot mange giftstoffer, ikke minst
slike som fremkaller kreft, og store doser regnes for å være forebyggende mot
både kreft og andre sykdommer.
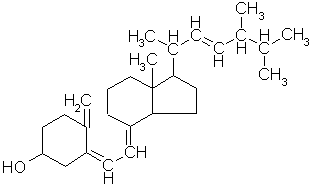 Vitamin D eller kalsiferol. På
figuren er ringatomene ikke tegnet inn for tydelighetens skyld. Dette er en
steroidliknende forbindelse som får hormonfunksjon når den hydroksyleres i
begge endene, regulerer kalsium- og fosfatopptaket fra tarmen og er uunnværlig
for krystallisering av kalsiumfosfat i beinbygningen. Den er altså ikke et koenzym
som de fleste andre vitaminene. Dannes i kroppen av 7-dehydrokolesterol (et
vanlig forekommende omdannelsesprodukt av kolesterol) når en ultrafiolett
lyskvant åpner B-ringen i kolesterolet. En rimelig soleksponering kan fylle
dagsbehovet for vitamin D. Mangel fører til engelsk syke (rakitt), avkalking av
knoklene, som gjør dem bløte hos barn og skjøre hos voksne.
Vitamin D eller kalsiferol. På
figuren er ringatomene ikke tegnet inn for tydelighetens skyld. Dette er en
steroidliknende forbindelse som får hormonfunksjon når den hydroksyleres i
begge endene, regulerer kalsium- og fosfatopptaket fra tarmen og er uunnværlig
for krystallisering av kalsiumfosfat i beinbygningen. Den er altså ikke et koenzym
som de fleste andre vitaminene. Dannes i kroppen av 7-dehydrokolesterol (et
vanlig forekommende omdannelsesprodukt av kolesterol) når en ultrafiolett
lyskvant åpner B-ringen i kolesterolet. En rimelig soleksponering kan fylle
dagsbehovet for vitamin D. Mangel fører til engelsk syke (rakitt), avkalking av
knoklene, som gjør dem bløte hos barn og skjøre hos voksne.
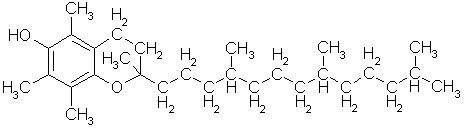 Vitamin E eller a -tokoferol er også en antioksydant som askorbinsyre, har
betydning for fruktbarheten og beskytter umettede fettsyrer mot oksydasjon.
Virker beskyttende på membraner som inneholder mange slike fettsyrer og er
nødvendig når man opptar større mengder flerumettede fettsyrer. Den lange
upolare kjeden til høyre på tegningen består av tre isoprenkjeder, en mye brukt
byggestein i mange biokjemisk viktige molekyler.
Vitamin E eller a -tokoferol er også en antioksydant som askorbinsyre, har
betydning for fruktbarheten og beskytter umettede fettsyrer mot oksydasjon.
Virker beskyttende på membraner som inneholder mange slike fettsyrer og er
nødvendig når man opptar større mengder flerumettede fettsyrer. Den lange
upolare kjeden til høyre på tegningen består av tre isoprenkjeder, en mye brukt
byggestein i mange biokjemisk viktige molekyler.
Det er ikke uvanlig å
regne de essensielle flerumettede fettsyrene linolsyre, CH3CH2CH2CH2CH2CH=CHCH2CH=CHCH2CH2CH2CH2CH2CH2CH2COOH
og linolensyre, CH3CH2CH=CHCH2CH=CHCH2CH=CHCH2CH2CH2CH2CH2CH2CH2COOH
som vitamin F. Disse kan ikke dannes i kroppen og har stor betydning for
membranfysiologien og for en sunn funksjon av lipoproteinene i blodet.
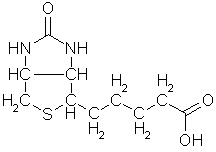 Biotin eller vitamin H regnes
også til B-komplekset. Det brukes som prostetisk gruppe av mange aminosyrer til
å frakte aktivert karbondioksyd som er fjernet fra dekarboksylerte molekyler
og/eller skal brukes til karboksylering av andre molekyler. Karboksylgruppen i
biotinet bindes med en amidbinding til aminosyren lysin i enzymet og binder
karbondioksydet som en karboksylgruppe på nitrogenet øverst til venstre på
tegningen. Slik karboksylering/dekarboksylering er bl.a. viktig i
sukkerforbrenningen, fotosyntesen, fettsyresyntesen, produksjon av ribose utfra
heksoser og mange andre livsviktige funksjoner.
Biotin eller vitamin H regnes
også til B-komplekset. Det brukes som prostetisk gruppe av mange aminosyrer til
å frakte aktivert karbondioksyd som er fjernet fra dekarboksylerte molekyler
og/eller skal brukes til karboksylering av andre molekyler. Karboksylgruppen i
biotinet bindes med en amidbinding til aminosyren lysin i enzymet og binder
karbondioksydet som en karboksylgruppe på nitrogenet øverst til venstre på
tegningen. Slik karboksylering/dekarboksylering er bl.a. viktig i
sukkerforbrenningen, fotosyntesen, fettsyresyntesen, produksjon av ribose utfra
heksoser og mange andre livsviktige funksjoner.
 Vitamin K eller fyllokinon er
nødvendig for syntesen av protrombin som får blodet til å levre seg. Visse
substanser som likner vitaminet konkurrerer med det under protrombinsyntesen og
fører til at det dannes ubrukelige varianter. Dikumarol er et slikt stoff som finnes
i skjemt kløver og kan føre til dødelig sykdom hos kveg som fores med det.
Stoffet brukes også som antikoagulerende middel i medisinen. Warfarin er et
annet liknende stoff som brukes til rottegift. Varianten på bildet er den
naturlig forekommende som også kalles vitamin K1. I kroppen omdannes vitamin K1
til vitamin K2, hvor isoprenkjeden er dobbelt så lang og dobbeltbindingen i
kjeden til K1 går igjen for hvert 4. karbon. Som kostholdstilskudd brukes
gjerne syntetisk vitamin K3 eller menadion, som mangler isoprenkjeden, men kan
få den påsatt i kroppen. Også den liknende forbindelsen
1,4-diamino-2-metylnaftalen, som bare skiller seg fra menadion ved at begge
ringene har benzenstruktur og at ketogruppene er erstattet med aminogrupper,
kan omdannes til vitamin K2 i kroppen og betegnes gjerne vitamin K6.
Vitamin K eller fyllokinon er
nødvendig for syntesen av protrombin som får blodet til å levre seg. Visse
substanser som likner vitaminet konkurrerer med det under protrombinsyntesen og
fører til at det dannes ubrukelige varianter. Dikumarol er et slikt stoff som finnes
i skjemt kløver og kan føre til dødelig sykdom hos kveg som fores med det.
Stoffet brukes også som antikoagulerende middel i medisinen. Warfarin er et
annet liknende stoff som brukes til rottegift. Varianten på bildet er den
naturlig forekommende som også kalles vitamin K1. I kroppen omdannes vitamin K1
til vitamin K2, hvor isoprenkjeden er dobbelt så lang og dobbeltbindingen i
kjeden til K1 går igjen for hvert 4. karbon. Som kostholdstilskudd brukes
gjerne syntetisk vitamin K3 eller menadion, som mangler isoprenkjeden, men kan
få den påsatt i kroppen. Også den liknende forbindelsen
1,4-diamino-2-metylnaftalen, som bare skiller seg fra menadion ved at begge
ringene har benzenstruktur og at ketogruppene er erstattet med aminogrupper,
kan omdannes til vitamin K2 i kroppen og betegnes gjerne vitamin K6.
 Vitamin P har vært brukt som
betegnelse på bioflavonoider, d.v.s. forbindelser av biologisk opphav som
inneholder gruppen på tegningen til høyre. Rutin og hesperidin er to eksempler
som hjelper mot skjørbuk og derfor tilsynelatende spiller en rolle i
kollagenproduksjonen.
Vitamin P har vært brukt som
betegnelse på bioflavonoider, d.v.s. forbindelser av biologisk opphav som
inneholder gruppen på tegningen til høyre. Rutin og hesperidin er to eksempler
som hjelper mot skjørbuk og derfor tilsynelatende spiller en rolle i
kollagenproduksjonen.
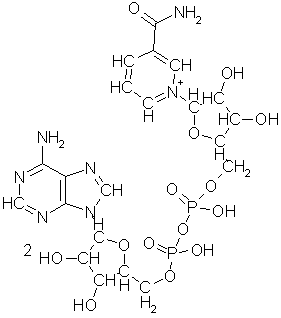 Nikotinsyre eller niacin kalles
også vitamin PP og regnes for å høre til B-komplekset. Det omdannes i kroppen
til nikotinamid (eller nikotinsyreamid) og hektes på en ribosefosfatenhet i
ringnitrogenet og denne bindes til et adenosinmonofosfat gjennom fosfatgruppene
slik at resultatet er nikotinamid-dinukleotid, som vist til høyre, blant venner
kjent som NAD. Sammen med varianten nikotinamid-dinukleotidfosfat eller NADP, som
har en ekstra fosfatgruppe bundet til adeninribosen i posisjon 2 (markert på
figuren), er NAD universal-redoksreagensen i livsprosessene. I formen på
tegningen er ringnitrogenet i nikotinamidet positivt ladet og kan derfor opptre
som fireverdig. Denne formen betegnes NAD+. Ladningen destabiliserer
molekylet, selv om det er ganske stabilt på grunn av benzenringresonansen.
Derfor kan det lett oppta et ekstra hydrogen i den motsatte posisjonen av
ringen selv det fører til at den mister resonansstabiliseringen og bare har en
dobbeltbinding på hver side som vist på tegningen til venstre her. Denne
reduserte formen betegnes NADH. Tilsvarende NADP+ og NADPH for den
ekstra fosforylerte formen. De brukes i en rekke reaksjoner under
sukkerforbrenningen og en mengde andre reaksjoner som er for tallrike til å
oppregnes her. Som de andre redoksmidlene eller antioksydantene i kroppen er de
viktige for å nøytralisere giftige eller kreftfremkallende stoffer vi får i oss
i vår forurensede hverdag.
Nikotinsyre eller niacin kalles
også vitamin PP og regnes for å høre til B-komplekset. Det omdannes i kroppen
til nikotinamid (eller nikotinsyreamid) og hektes på en ribosefosfatenhet i
ringnitrogenet og denne bindes til et adenosinmonofosfat gjennom fosfatgruppene
slik at resultatet er nikotinamid-dinukleotid, som vist til høyre, blant venner
kjent som NAD. Sammen med varianten nikotinamid-dinukleotidfosfat eller NADP, som
har en ekstra fosfatgruppe bundet til adeninribosen i posisjon 2 (markert på
figuren), er NAD universal-redoksreagensen i livsprosessene. I formen på
tegningen er ringnitrogenet i nikotinamidet positivt ladet og kan derfor opptre
som fireverdig. Denne formen betegnes NAD+. Ladningen destabiliserer
molekylet, selv om det er ganske stabilt på grunn av benzenringresonansen.
Derfor kan det lett oppta et ekstra hydrogen i den motsatte posisjonen av
ringen selv det fører til at den mister resonansstabiliseringen og bare har en
dobbeltbinding på hver side som vist på tegningen til venstre her. Denne
reduserte formen betegnes NADH. Tilsvarende NADP+ og NADPH for den
ekstra fosforylerte formen. De brukes i en rekke reaksjoner under
sukkerforbrenningen og en mengde andre reaksjoner som er for tallrike til å
oppregnes her. Som de andre redoksmidlene eller antioksydantene i kroppen er de
viktige for å nøytralisere giftige eller kreftfremkallende stoffer vi får i oss
i vår forurensede hverdag.
 Koenzym Q10, også kalt vitamin Q
eller ubikinon består av ringgruppen til venstre pluss en isoprenkjede på 10
femkarboners enheter (derfor Q10) hektet på den løse enden på figuren. Det
brukes av enzymet NADH-Q-reduktase i oksygenopptaksreaksjonene under
forbrenningen. Det fungerer også som en redoksreagens og tar opp to hydrogen på
oksygenatomene i karbonylgruppene slik at ringen blir til en benzenring.
Lengden av isoprenkjeden kan variere, spesielt fra art til art, 10 er mest
vanlig hos pattedyr. Koenzym Q10 er sannsynligvis ikke essensielt, men
redoksfunksjonene har gjort det populært som antioksydanttilskudd.
Koenzym Q10, også kalt vitamin Q
eller ubikinon består av ringgruppen til venstre pluss en isoprenkjede på 10
femkarboners enheter (derfor Q10) hektet på den løse enden på figuren. Det
brukes av enzymet NADH-Q-reduktase i oksygenopptaksreaksjonene under
forbrenningen. Det fungerer også som en redoksreagens og tar opp to hydrogen på
oksygenatomene i karbonylgruppene slik at ringen blir til en benzenring.
Lengden av isoprenkjeden kan variere, spesielt fra art til art, 10 er mest
vanlig hos pattedyr. Koenzym Q10 er sannsynligvis ikke essensielt, men
redoksfunksjonene har gjort det populært som antioksydanttilskudd.
Karnitin, (CH3)3N+CH2CHOHCH2COOH,
eller vitamin T, brukes til å frakte fettsyrer til oksydasjon i mitokondriene
og sannsynligvis til å frakte acetyl-koenzym A ut fra mitokondriene til
fettsyresyntese ved å binde dem til OH-gruppen.
 Lipoinsyre er et viktig koenzym
som ikke regnes som vitamin. Det er bundet som prostetisk gruppe med en
amidbinding til aminosyren lysin i enzymet dihydrolipoyltransferase og omdanner
hydroksyetylgruppen som er igjen etter dekarboksylering av pyruvat under
sukkerforbrenningen (se under tiamin) til en acetylgruppe ved at hydrogenet til
hydroksylgruppen bindes til det ene svovelatomet og karbonylkarbonet i
acetylgruppen bindet til det andre. Samme enzym overfører acetylgruppen videre
til koenzym A, og de to SH-gruppene som er igjen på lipoamidet oksyderes til
disulfid igjen av enzymet dihydrolipoyldehydrogenase ved hjelp av NAD+.
Lipoinsyre er et viktig koenzym
som ikke regnes som vitamin. Det er bundet som prostetisk gruppe med en
amidbinding til aminosyren lysin i enzymet dihydrolipoyltransferase og omdanner
hydroksyetylgruppen som er igjen etter dekarboksylering av pyruvat under
sukkerforbrenningen (se under tiamin) til en acetylgruppe ved at hydrogenet til
hydroksylgruppen bindes til det ene svovelatomet og karbonylkarbonet i
acetylgruppen bindet til det andre. Samme enzym overfører acetylgruppen videre
til koenzym A, og de to SH-gruppene som er igjen på lipoamidet oksyderes til
disulfid igjen av enzymet dihydrolipoyldehydrogenase ved hjelp av NAD+.
Men lille Emil er også
en søt liten gutt. Selv om karbohydratene eller sakkaridene ikke utgjør så mye
vektmessig av ham som lipidene, spiller de en enorm rolle. Og av azaleaen som
han står og stirrer ut gjennom vinduet over, samt av alle andre høyere planter,
utgjør karbohydrater hoveddelen og er det klart viktigste strukturdannende
elementet.
Som nevnt er det
pentoser og heksoser som er de naturlige sakkaridene. Av pentosene er
arabinose, ribose og xylose vanligst, mens det er glukose, galaktose, mannose
og fruktose som er de vanligste av heksosene. Vanlige oligosakkarider er
sakkarose (1 glukose og 1 fruktose), laktose (1 glukose og 1 galaktose) og
trehalose og maltose (2 glukose). Det er diverse polysakkarider.
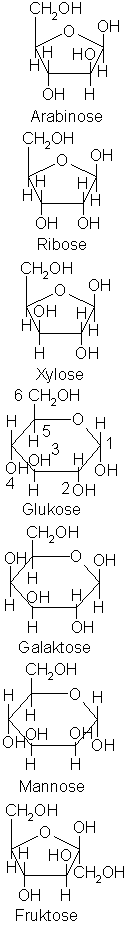 Arabinose forekommer i visse
planteutsondringer, bl.a. gummi arabicum og inngår i pektin, en strukturdannende
kittesubstans i planter. Ribose eller deoksyribose, C5H10O4,
finnes i alle celler, sammen med fosforsyre danner de ryggraden av alt RNA og
DNA, nukleinsyrene som formidler all biologisk arv. Ribose inngår også i en del
andre viktige nukleotider og nukleosider som ATP, NAD og FAD. Xylose danner et
polysakkarid xylan, som finnes i store mengder i ved, særlig løvtreved, samt i
gresstrå, frøskall og andre harde plantedeler. Glukose finnes i frukt, honning,
blod og ved sukkersyke i urinen. Den er bestanddel av flere oligosakkarider og
eneste bestanddel av slike uhyre viktige polysakkarider som cellulose, stivelse
og glykogen. Galaktose finnes i disakkaridet laktose og polysakkarider som agar
(gelose) og karrageenan, polysakkarider som brukes til opplagsnæring av
rødalger og består av mer eller mindre modifiserte galaktoseenheter. Mannose er
vidt utbredt i planter i form av en gruppe polysakkarider som kalles mannaner.
De er nært beslektet med cellulose og finnes i særlig store mengder i
elfenbennøtter, johannesbrød og tang. Mannosen er også en bestanddel av en del
forbindelser, mannosider, som har stor utbredelse i plantelivet. Fruktosen
(også kalt fruktsukker eller levulose) inngår i disakkaridet sukrose, det
vanlige husholdningssukkeret, og finnes også alene i honning, epler, tomater og
mange andre søte frukter. Polysakkaridet av fruktose er inulin, som brukes til
opplagsnæring i stedet for stivelse av alle planter i kurvblomstfamilien.
Fruktosen er den klart søteste av de vanlige sakkaridene, og det er også fruktosen
som gjør sukrosen så søt som den er.
Arabinose forekommer i visse
planteutsondringer, bl.a. gummi arabicum og inngår i pektin, en strukturdannende
kittesubstans i planter. Ribose eller deoksyribose, C5H10O4,
finnes i alle celler, sammen med fosforsyre danner de ryggraden av alt RNA og
DNA, nukleinsyrene som formidler all biologisk arv. Ribose inngår også i en del
andre viktige nukleotider og nukleosider som ATP, NAD og FAD. Xylose danner et
polysakkarid xylan, som finnes i store mengder i ved, særlig løvtreved, samt i
gresstrå, frøskall og andre harde plantedeler. Glukose finnes i frukt, honning,
blod og ved sukkersyke i urinen. Den er bestanddel av flere oligosakkarider og
eneste bestanddel av slike uhyre viktige polysakkarider som cellulose, stivelse
og glykogen. Galaktose finnes i disakkaridet laktose og polysakkarider som agar
(gelose) og karrageenan, polysakkarider som brukes til opplagsnæring av
rødalger og består av mer eller mindre modifiserte galaktoseenheter. Mannose er
vidt utbredt i planter i form av en gruppe polysakkarider som kalles mannaner.
De er nært beslektet med cellulose og finnes i særlig store mengder i
elfenbennøtter, johannesbrød og tang. Mannosen er også en bestanddel av en del
forbindelser, mannosider, som har stor utbredelse i plantelivet. Fruktosen
(også kalt fruktsukker eller levulose) inngår i disakkaridet sukrose, det
vanlige husholdningssukkeret, og finnes også alene i honning, epler, tomater og
mange andre søte frukter. Polysakkaridet av fruktose er inulin, som brukes til
opplagsnæring i stedet for stivelse av alle planter i kurvblomstfamilien.
Fruktosen er den klart søteste av de vanlige sakkaridene, og det er også fruktosen
som gjør sukrosen så søt som den er.
Sukrose eller sakkarose,
detvanlige bordsukkeret, er sjeldnere i naturen enn glukose og fruktose f.eks.,
men de plantene som inneholder noen mengder av det blir utsatt for steinhard
kommersiell utnyttelse, og har navn etter sukkerinnholdet, sukkerroer,
sukkerrør, sukkerlønn, sukkerpalmer. Laktose utgjør ca. 5 % av alle pattedyrs
melk. Trehalose finnes i unge sopp og i pasjonsplanten samt i insektblod.
Maltose opptrer i naturen bare som nedbrytningsprodukt av stivelse og
cellulose, bl.a. under fordøyelsen. Di- og polysakkaridene lages i organismene
med utgangspunkt i nukleosid-aktiverte monosakkarider (se under glykogen).
F.eks. produseres sukrose av uridindifosfat-glukose (UDP-glukose) og
fruktose-6-fosfat. Resultatet er sukrose-6-fosfat, som så hydrolyseres til
sukrose og fosfat. Laktose produseres i melkekjertlene av enzymet
laktose-syntetase, som bastår av en katalyttisk enhet, galaktose-transferase og
et protein som fungerer som en kontrollenhet, alfa-laktalbumin. Uten
kontrollenheten produseres N-acetyllaktosamin i stedet for laktosen.
Galaktosyl-transferasen finnes i de fleste vevstyper og produktene inngår i
syntesen av glykoproteiner. Den kombinerte formen finnes bare i melkekjertlene.
Mye galaktosyl-transferase produseres og lagres der under graviditeten.
Hormonforandringene ved fødselen fører til alfa-laktalbuminproduksjon, og store
mengder laktose til morsmelken er resultatet.
For å kunne fordøyes må
di- og de andre oligosakkaridene spaltes til monosakkarider. Dette gjøres i
pattedyr av enzymer i spyttet og tynntarmen. Hvert disakkarid har sitt eget
enzym: laktase, sukrase og maltase spalter hvert sitt. Laktase finnes bare hos
pattedyr og produseres vanligvis ikke når dyret har nådd en viss alder, men hos
mennesker har voksne individer i noen populasjoner utviklet evnen til å
produsere laktase. Dette er åpenbart en genetisk tilpasning til kvegholdet, som
de fleste steder startet for bare noen få tusen år siden. Dersom noen drikker
uten å ha laktase vil laktosen samle seg i tynntarmen fordi det ikke finnes
noen midler til å ta den opp med. Dette fører til en kraftig osmotisk effekt og
dermed et sig av væske inn i tynntarmen, som gir oppsvulming, kvalme, kramper,
smerter og en vassen diaré.
For å kunne utføre
arbeid i mer enn noen sekunder lagrer dyrene glykogen, et polysakkarid som
består av glukoseenheter i kjeder som i for det meste er koblet sammen i 1- og
4-posisjonene, men noen steder forgrener seg ved hjelp av hydroksymetylgruppen
utenfor ringen, med 6-karbonet, som kobles til et 1-karbon i den andre kjeden.
Kjeden forgrener seg for ga. hver tiende glukoseenhet. Mesteparten av glykogen
er lagret i musklene, med et reservelager i leveren. En gjennomsnittsperson på
70 kg har et energilager på ca. 600 kcal når vedkommende står opp om morgenen.
Til sammenlikning sirkulerer det bare glukose for ca. 40 kcal fritt rundt i
kroppen til enhver tid. Glykogenet lagres som korn i celleprotoplasmaet med
diameter på 100-400 Å. Kornene inneholder også alle enzymene som skal til for
utnyttelsen og en del av regulatorenzymene. Når kroppen trenger glukose trer
enzymet glykogenfosforylase i virksomhet. Det spalter eterbindingene i
glykogenet, ikke ved hydrolyse, men ved fosforolyse, d.v.s. at et fosfatmolekyl
angriper bindingen og skiller det ytterste leddet i en glykogenkjede fra de
andre. Det fraskilte leddet foreligger som glukose-1-fosfat. Reaksjonen er
reversibel og går i retning av avspalting hvis det er mer enn 3,6 ganger så
mange mol fosfat i omgivelsene som det er glukose-1-fosfat. Til vanlig er dette
forholdet over 100. Enzymet trenger assistanse av to andre enzymer for å
håndtere forgreningene i glykogenet. Hver av forgreningene koster et ATP, men
det er verdt det p.g.a. den raskere utvinningstakten som alle grenene medfører,
fordi glykogenet kan nedbrytes fra alle endepunktene. Til slutt muteres
glukose-1-fosfat av fosfoglukomutase til glukose-6-fosfat som kan forbrennes
direkte. Leveren inneholder også enzymet glukose-6-fosfatase, som fjerner
fosfatet fra glukosen slik at den kan fraktes uten fosfatet gjennom
blodstrømmen.
Selv om
glykogen-fosforylasereaksjonen er reversibel er det for mye fosfat i
kroppsvæskene til at enzymet kan brukes til glykogensyntese. Dette skjer ved at
glukose-1-fosfat først kombineres med uridintrifosfat (UTP) av enzymet
UDP-glukose-pyrofosforylase. Produktene er uridindifosfat-glukose eller
UDP-glukose, og pyrofosfat, P2O74-, de to
ytterste fosfatleddene av UTP'et. Denne reaksjonen er også reversibel, men
drives klart til produktsiden fordi pyrofosfatet straks hydrolyseres til fosfat
(ortofosfat) av en uorganisk pyrofosfatase. En slik hydrolyse av pyrofosfat
bestemmer retningen også for en mengde andre biokjemiske likevektsreaksjoner.
Enzymet glykogensyntetase kobler så UDP-glukosen til en voksende glykogenkjede
mens UDP spaltes av. Oppstart av syntesen samt forgrening og nydannelse av UTP
fra UDP (ved hjelp av ATP) besørges av en flokk andre enzymer.
Både syntesen og
oppspaltingen av glykogen kontrolleres rigorøst slik at den ene prosessen er
nesten inaktiv når den andre er i drift. Insulin er et hormon som syntetiseres
i bukspyttkjertelen og kontrollerer glykogenoppspaltingen i leveren. Når
organismen er nyforet og mett er insulininnholdet i blodet høyt, men det synker
når organismen trenger mer blodsukker og fosforylasen i leveren må tre i
aktivitet. Insulinet stimulerer oppbygningen av glykogen, fettlagre og protein,
det gjør at glukose, noen andre sukkermolekyler og aminosyrer lettere slipper
inn i muskel- og fettcellene, slik at bl.a. blodsukkernivået synker. Noen av
insulineffektene er veldig raske og går uavhengig av den vanlige hormonale
cAMP-mekanismen. Stort sett er det lite kjent hvordan de virker, men det er
observert at et av membranproteinene fosforyleres når insulinet bindes til
reseptorproteinet. Adrenalin, et annet hormon som lages i binyrene, speeder opp
glykogenoppspaltingen i musklene, og i mindre grad i leveren. Glukagon, et
annet bukspyttkjertelhormon som i likhet med insulin består av en peptidkjede
(på bare 29 aminosyrer), stimulerer oppspaltingen i leveren når blodsukkeret er
lavt. Hormonene går ikke inn i cellene og virker der, men fester seg til et
membranprotein og stimulerer enzymet adenylatsyklase, som omdanner et molekyl
ATP til cAMP, som setter i gang en rekke reaksjoner som aktiviserer
fosfosylasen som spalter glykogen, mens den glykogensyntetiserende
glykogen-syntetase hemmes. Reaksjonskaskaden virker forsterkende, mer enn 100
ganger så mye adrenalin ville vært nødvendig hvis det ikke hadde vært for den.
Fosforylasen aktiveres ved at en bestemt serin i aminosyresekvensen blir
fosforylert. Samme metode fører til motsatt reaksjon fra glykogensyntetasen. De
fosforylerte serinene kan defosforyleres av noen enzymer som kalles fosfataser
og er spesifikke for de forskjellige enzymene de defosforylerer. Et av dem
hemmes når det er mye glykogen tilstede, slik at glykogenopplagringen bremses.
Andre hemmes av kalsium- og magnesiumioner, som frigjøres når musklene
arbeider.
I dyreriket tjener
glykogen til korttidslagring av energi. Til langtidslagring har vi fett. Men
hos plantene fyller stivelse begge formålene. Stivelsen er en blanding av
amylose og amylopektin, som begge er lange kjeder av glukoseringer med
1,4-eterbindinger. Amylopektinet er forgrenet slik som glykogenet, men med en
1,6-forgrening bare for hvert 30. ledd i kjeden. Amylosen er ikke forgrenet.
Begge bestanddelene hydrolyseres raskt til glukose av amylose, som finnes i
spyttet hos planteetere, bl.a. mennesker. Dyre-amylosen eller alfa-amylose
deler stivelsen opp i stykker på 2 (disakkaridet maltose), 3 (trisakkaridet
maltotriose) eller litt flere (alfa-dekstrin med et fellesnavn) glukoseenheter.
De to første hydrolyseres videre av maltase, mens alfa-dekstrinase tar seg av
dekstrinet. Amylasen i malt (spiret korn) er forskjellig fra dyreamylasen og
kalles beta-amylase. Den hydrolyserer stivelse til maltose.
På grunn av fotosyntesen
har planter så stor sukkerproduksjon at de kan bruke sukkeret ikke bare til
energiformål, men også som sitt viktigste byggemateriale, cellulosen. Faktisk
er cellulose det mest utbredte kjemiske stoff i livets sfære og opptar mer enn
halvparten av alt karbonet som brukes av de levende organismene. Cellulosen
består av bunter av uforgrenede kjeder av glukoseringer med 1,4-eterbindinger
som i amylosen, men lengre. Den er et sterkt, mekanisk og kjemisk
motstandsdyktig stoff og bare noen få mikroorganismer har utviklet enzymer,
cellulaser, som kan spalte den og få energi ut av sukkeret. Noen av disse
organismene utnyttes av drøvtyggere og sannsynligvis også av noen av fortidens
dinosaurer for å fordøye plantemateriale i et symbiotisk samspill.
Cellulosesyntesen i plantene foregår med forskjellige nukleosid-glukoser som
utgangspunkt, enten adenosinbasert (ADP-glukose), cytidinbasert (CDP-glukose)
eller guanosinbasert (GDP-glukose).
Dekstran er et
polysakkarid som brukes til energilagring av gjærceller og bakterier. I
motsetning til de ovennevnte er eterbindingene mellom glukoseringene her satt
sammen i 1,6-posisjon. Det er noen forgreninger i 1,2-, 1,3- og 1,4-posisjoner,
avhengig av hvilken art det dreier seg om.
Også dyr bruker
sakkarider til strukturformål. Bindevevet er rikt på proteoglykaner, som består
av ca. 5 % protein og resten modifiserte polysakkarider, som inneholder anioner
som binder vann og kationer. Proteoglykanene utgjør grunnsubstansen av
bindevevet. De bestemmer hvor seige og elastiske senene er i ledd og andre
strukturer som er utsatt for mekanisk deformering. Polysakkaridkjedene i
proteoglykanene kalles glykosaminoglykaner og består av gjentatte
disakkaridenheter som er bygd opp av vanlige heksoser eller derivater av et
aminosakkarid, enten glukosamin eller galaktosamin, hvor OH-gruppen til
2-karbonet er erstattet med amin og bundet til en acetylgruppe med amidbinding.
Minst en av dem er modifisert med en eller to negativt ladde karboksylat- eller
sulfatgrupper. I hyaluronsyre er disakkaridet 1,3-bundet glukose og glukosamin
med 6-karbonet oksydert til karboksyl i glukosen. I keratansulfat er galaktose
og glukosamin 1,4-bundet med en sulfonatgruppe forestret i 6-posisjonen på
glukosaminet. I chondroitinsultat er en glukose og en galaktosamin 1,3-bundet
med en 6-karboksyl på den første og en 6-sulfon på den andre. I dermatansulfat
er en glukose og en galaktosamin 1,3-bundet med en 6-karboksyl på den ene og en
4-sulfon på den andre. I heparin er en glukose og en glukosamin 1,4-bundet med
en 6-karboksyl og en 2-sulfon på den ene og en 6-sulfon og acetylgruppen i 2
erstattet med sulfon på den andre. De forskjellige typene kombineres gjerne i
forskjellige strukturer. F.eks. i brusk er kjeder av keratansulfat og
chondroitinsulfat kovalent bundet til en ryggrad av såkalt kjerneprotein, og
omtrent 140 slike kjerneproteiner er ikkekovalent bundet med mellomrom på ca.
300 Å til en lang tråd av hyaluronsyre ved hjelp av et bindingsprotein.
 Det er Sola som gjennom plantenes
fotosyntese gir opphav til praktisk talt all tilgjengelig biologisk energi på
denne planeten. I grønne planter foregår fotosyntesen i kloroplaster, rundt 5
mikrometer store spesialiserte celledeler som i likhet med mitokondriene har
eget DNA og antakelig stammer fra encellede organismer som er blitt inkorporert
av plantene en gang i løpet av evolusjonshistorien. Som mitokondriene har de
også to omsluttende membraner, en ytre og en indre og et mellomrom mellom dem.
I det indre ligger det thylakoide membransystemet, masser av små flattrykte
sekker som er stablet oppå hverandre omtrent som i tappene i øyet. Noen steder
er det tverrforbindelser mellom to av stablene. Thylakoidene består av omtrent
like mye protein som lipid. Nesten halvparten av lipidet er galaktolipid, hvor
den vannkjære delen er sukkerarten galaktose. Et kvant lys skinner inn på
kloroplasten og treffer en thylakoidsekk hvor den absorberes av et molekyl
klorofyll, en porfyrinforbindelse som har stor likhet med hemet i hemoglobin,
men metallatomet som holdes fanget i midten er ikke jern, det er magnesium.
Klorofyllet som er avbildet her kalles klorofyll a. Det finnes også en type b
som bare avviker fra a ved at metylgruppen øverst til høyre på figuren er
byttet ut med aldehyd. Forøvrig er det mest upolare grupper som ikke liker seg
sammen med vann. Det er to estergrupper, en metylester og en ester av en lang
isoprenkjede som gjør molekylet ekstra vannavstøtende. Klorofyllmolekylet har
som mange andre molekyler med alternerende dobbelt- og enkeltbindinger sterke
absorpsjonsbånd i den synlige delen av lysspekteret, som
"tilfeldigvis" også er den delen av sollyset som best trenger gjennom
atmosfæredypet. Klorofyll a og b absorberer i hvert sitt område av spekteret, a
for en stor del i det røde og b i det blå, mens det grønne for en stor del er
udekket. Derfor ser ting som inneholder klorofyll, som løv, barnåler,
kaktusskinn og alger grønne ut hvis de ikke også inneholder andre sterke
pigmenter, og klorofyllet har også på norsk vært kalt bladgrønt, en direkte
oversettelse av det greske klorofyll. Ekstinksjonskoeffisienten for
klorofyllene, et mål for absorpsjonsevnen, er på det maksimale 100000 pr. cm og
mol, noe av det høyeste som er målt for en organisk forbindelse.
Det er Sola som gjennom plantenes
fotosyntese gir opphav til praktisk talt all tilgjengelig biologisk energi på
denne planeten. I grønne planter foregår fotosyntesen i kloroplaster, rundt 5
mikrometer store spesialiserte celledeler som i likhet med mitokondriene har
eget DNA og antakelig stammer fra encellede organismer som er blitt inkorporert
av plantene en gang i løpet av evolusjonshistorien. Som mitokondriene har de
også to omsluttende membraner, en ytre og en indre og et mellomrom mellom dem.
I det indre ligger det thylakoide membransystemet, masser av små flattrykte
sekker som er stablet oppå hverandre omtrent som i tappene i øyet. Noen steder
er det tverrforbindelser mellom to av stablene. Thylakoidene består av omtrent
like mye protein som lipid. Nesten halvparten av lipidet er galaktolipid, hvor
den vannkjære delen er sukkerarten galaktose. Et kvant lys skinner inn på
kloroplasten og treffer en thylakoidsekk hvor den absorberes av et molekyl
klorofyll, en porfyrinforbindelse som har stor likhet med hemet i hemoglobin,
men metallatomet som holdes fanget i midten er ikke jern, det er magnesium.
Klorofyllet som er avbildet her kalles klorofyll a. Det finnes også en type b
som bare avviker fra a ved at metylgruppen øverst til høyre på figuren er
byttet ut med aldehyd. Forøvrig er det mest upolare grupper som ikke liker seg
sammen med vann. Det er to estergrupper, en metylester og en ester av en lang
isoprenkjede som gjør molekylet ekstra vannavstøtende. Klorofyllmolekylet har
som mange andre molekyler med alternerende dobbelt- og enkeltbindinger sterke
absorpsjonsbånd i den synlige delen av lysspekteret, som
"tilfeldigvis" også er den delen av sollyset som best trenger gjennom
atmosfæredypet. Klorofyll a og b absorberer i hvert sitt område av spekteret, a
for en stor del i det røde og b i det blå, mens det grønne for en stor del er
udekket. Derfor ser ting som inneholder klorofyll, som løv, barnåler,
kaktusskinn og alger grønne ut hvis de ikke også inneholder andre sterke
pigmenter, og klorofyllet har også på norsk vært kalt bladgrønt, en direkte
oversettelse av det greske klorofyll. Ekstinksjonskoeffisienten for
klorofyllene, et mål for absorpsjonsevnen, er på det maksimale 100000 pr. cm og
mol, noe av det høyeste som er målt for en organisk forbindelse.
Thylakoidene inneholder
masser av klorofyllmolekyler for at absorpsjonen skal bli best mulig, men bare
noen få av dem ligger i nærheten av enzymer som kan bruke den innfangne
energien til å starte sukkerproduksjonen. I løpet av brøkdeler av et nanosekund
hopper energien fra det ene klorofyllmolekylet til det andre til det når et
slikt reaksjonssenter. Det er to typer slike reaksjonssentre. Begge består av
store proteiner som er forbundet med flere molekyler klorofyll. De kalles
fotosystem I og II og har forskjellige oppgaver i fotosyntesen. Klorofyllet i
reaksjonssenteret i system II har et redokspotensial på +0,8 V, og når det
opptar et elektron produserer det et meget sterkt oksydasjonsmiddel som kan
oksydere vann til oksygen. Noen manganatomer i reaksjonssenteret ser ut til å
spille en rolle her. Et molekyl klorofyll a i reaksjonssenteret til system I
endrer redokspotensial fra +0,4 til -0,6 V når det absorberer en lyskvant med
energi på 1,8 eV (dyprødt) eller mer, p.g.a. endringer i elektronstrukturen.
Dette gjør det i stand til å overføre et elektron til et molekyl av
jernsulfidproteinet ferredoksin som er bundet til fotosystemproteinet.
Elektronet går derfra videre til ferredoksinmolekyler som er løst i plasmaet og
reduserer der NADP+ til NADPH som deretter reduserer karbondioksyd til glukose
gjennom en komplisert, trinnvis prosess som krever flere ATP og NADPH og
innebærer at en pentose spaltes ved opptak av karbondioksyd (i den såkalte Calvin-syklusen
av reaksjoner) til to trioser som så sluttes sammen til glukose i en
flertrinns, enzymkatalysert reaksjonskjede.
Tropiske planter, som
f.eks. sukkerrør, har bedre lystilgang enn andre, og utnytter dette med en
såkalt C4-syklus i spesielle mesofyll-celler som akselererer fotosyntesen ved å
transportere karbondioksyd via karboksylerte mellomledd til Calvin-syklusen i
kloroplastene. Denne karbondioksydkonsenteringen hemmer også fotorespirasjonen,
en prosess som omdanner 25 - 50 % av det karbonet som fikseres av planter i
tempererte og arktiske strøk tilbake til karbondioksyd i nærvær av lys, uten at
de synes å vinne noe på det (i motsetning til den vanlige respirasjonen som er
uavhengig av lyset og produserer ATP og NADH m.m.). Men C4-syklusen er
energikrevende, tropiske C4-planter bruker 30 ATP for å danne et molekyl
glukose mens de andre (C3-plantene) bruker 18, og har derfor en fordel der det
ikke er så mye lys.
Samtidig avgir system II
det opptatte elektronet og produserer et svakt reduksjonsmiddel og system I får
erstattet det tapte elektronet sitt når det produserer et svakt
oksydasjonsmiddel, og disse to produktene går sammen om å produsere ATP til
plantens øyeblikkelige energibehov. Drivkraften for denne ATP-produksjonen er
pH-senkningen som oppstår inne i thylakoidsekkene av de H+-ionene som frigjøres
under oksydasjonen av vann. Elektroner går fra system II til system I til et
bundet molekyl plastokinon, som fungerer på samme måte som koenzym Q10. Derfra
går de ut i en kjede av løste plastokinonmolekyler i plasmaet og overføres til
cytokrom b559 på system I, som gir det videre til cytokrom c552. Dette er
proteiner som inneholder jern og tar opp elektroner på jernatomet. Derfra går
elektronet videre til plastocyanin, et protein som har koordinert et kobberatom
og kan befordre et elektron ved å redusere kobberet fra to- til enverdig.
Plastocyaninet overfører så elektronet til klorofyll.
Når det er liten tilgang
til karbondioksyd opererer fotosystem I alene og overfører elektronet fra det bundne
ferredoksinet til nok et cytokrom, b563, hvorfra det går videre til cytokrom
552 og gjennom den samme kjeden til klorofyll. Her produseres det ikke noe
oksygen og sukker, men det dannes ATP når elektroner passerer gjennom kjeden.
Gjennom den såkalte
glykolysen omdannes glukose til pyruvat som deretter i luftåndende organismer
oksyderes videre til karbondioksyd og vann i sitronsyresyklusen, eller når
oksygentilførselen ikke er tilstrekkelig til laktat (melkesyre). Noen såkalte
anaerobe organismer som ikke puster i luft omdanner pyruvatet til etanol. Slike
sukkernedbrytende prosesser som ikke krever oksygen kalles gjæring.
For å omdanne glukosen
med 6 karboner til pyruvat (CH3COCOO-) med 3, må den
deles i to. Første stadium i glykolysen forbereder denne splittelsen i en
tretrinnsprosess som katalyseres av tre forskjellige enzymer. Glukose
fosforyleres til glukose-6-fosfat av heksokinase i et trinn som krever ett ATP.
Deretter omdannes glukose-6-fosfat til fruktose-6-fosfat av
fosfoglukose-isomerase. Til slutt fosforyleres fruktose-6-fosfat av enzymet
fosfofruktokinase videre til fruktose-1,6-difosfat med en omkostning av nok at
ATP.
Neste stadium i
glykolysen begynner med at fruktose-1,6-difosfatet, som kan skrives CH2(OPO32-)COCHOHCHOHCHOHCH2OPO32-
i utrullet form, opp i dihydroksyacetonfosfat, CH2(OPO32-)COCH2OH,
og glyseraldehyd-3-fosfat, CHOCHOHCH2OPO32-,
av enzymet aldolase. Reaksjonen er det omvendte av en aldolkondensasjon, og
enzymet kan katalysere reaksjonen begge veier. Glyseraldehyd-3-fosfat går
videre i reaksjonskjeden, mens dihydroksyacetonfosfatet omdannes til
glyseraldehyd-3-fosfat av enzymet triosefosfatisomerase. Denne reaksjonen er
også reversibel, men går denne veien effektivt siden produktet raskt brukes opp.
I tredje stadium utvinnes
endelig litt av energien i sukkeret. Først oksyderes og fosforyleres
glyseraldehyd-3-fosfatet til 1,3-difosfoglyserat (eller 1,3-DPG), CH2(OPO32-)CHOHCOOPO32-,
av enzymet glyseraldehyd-3-fosfatdehydrogenase ved hjelp av NAD+ og
et fritt fosfatmolekyl. Deretter overfører fosfoglyseratkinase fosfatgruppen
fra karboksylgruppen til et ADP, slik at det første ATP i prosessen blir
produsert.
Det siste stadiet av
glykolysen omgjør 3-fosfoglyseratet som var produktet i den forrige prosessen
til pyruvat ved at fosfoglyseromutase først flytter fosfatgruppen fra 3- til
2-posisjonen, deretter fjerner enzymet enolase en molekyl vann fra
2-fosfoglyseratet (CH2OHCH(OPO32-)COO-)
slik at det blir til fosfoenolpyruvat (CH2:C(OPO32-)COO-),
og til slutt bruker pyruvatkinase fosfatgruppen til å lage et nytt ATP. Dermed
er energiutbyttet av glykolysen 2 ATP pr. glukose, siden 2 ATP ble brukt under
fosforyleringen og etter at molekylet ble delt, dannes 2 ATP av hver av delene.
Ved siden av at
glykolysen produserer ATP, har den også betydning ved at både sluttproduktet
pyruvat og mange av mellomproduktene brukes som råstoff i organisk syntese.
Derfor er det mange kontrollmekanismer som tar hensyn til de ulike behovene.
Fosfofruktokinase er det viktigste av kontrollelementene. Det hemmes av høye
ATP-konsentrasjoner og stimuleres av lave, slik at det gjøres mer glykolyse når
det er bruk for mye energi enn når det er nok energi tilgjengelig.
Fosfofruktokinasen hemmes også av citrat, et av de tidlige leddene i
sitronsyresyklusen, som er utgangspunkt for mye biologisk syntese, så det blir
glykolysert små mengder glukose når det er lite behov for råmateriale til
syntese og større mengder når behovet er større. Heksokinase hemmes når
fosfofruktokinase er hemmet, men i leveren finnes glukokinase som utfører samme
reaksjon som innledning til dannelse av glykogen, som tilfører lagret energi
til hjernen og musklene. Når det er lite glukose tilgjengelig dominerer derfor
den uhemmede glykogendannelsen over glykolysen.
Et vanlig menneskelig kosthold
inneholder også mye fruktose og galaktose i tillegg til glukose. Fruktose kan
fosforyleres direkte til fruktose-6-fosfat av heksokinase, og dette foregår
også i stor utstrekning i fettvevet. Men mye av fruktoseomsetningen skjer i
leveren, og her er det også svært mye glukose, som seirer over fruktosen i
konkurransen om heksokinasen. Derfor brukes en omvei (fruktose-1-fosfat-kjeden)
hvor sukkeret først fosforyleres til fruktose-1-fosfat av enzymet fruktokinase.
Deretter spaltes det til glyseraldehyd og dihydroksyacetonfosfat ved
aldolspaltning av en fruktose-1-fosfat-aldolase. Den sistnevnte deltar direkte
i glykolysen mens glyseraldehydet fosforyleres til glyseraldehyd-3-fosfat av
triosekinase før det kan delta.
Galaktose fosforyleres
først til galaktose-1-fosfat av galaktokinase. Så aktiviseres den ved at den
bytter inn en uridindifosfat(UDP)-gruppe fra UDP-glukose. Enzymet
galaktose-1-fosfat-uridyl-transferase katalyserer denne reaksjonen. Noen
mangler dette enzymet og utvikler galaktosemi hvis de ammes eller på annen måte
tilføres galaktose. Galaktosemi kan være dødelig eller gi varige skader, også
mentale, hvis ikke pasienten raskt settes på en galaktosefri diett. Det neste
enzymet heter UDP-galaktose-4-epimerase og inneholder en NAD+-gruppe som
flytter den ene hydroksylgruppen i posisjon 4 som skiller galaktosen fra
glukose ved å oksydere den til en ketogruppe og deretter redusere den tilbake
igjen i ønsket stilling. Resultatet er UDP-glukose som igjen bytter gruppe med
et nytt galaktose-1-fosfat. Glukose-1-fosfatet som produseres kan så muteres
til glukose-6-fosfat for å delta i glykolysen.
Glukose kan også
gjendannes av pyruvat, f.eks. hvis kroppen har energioverskudd eller trenger
glukosider til et eller annet formål. Gjendanningsprosessen kalles
glukoneogenese og er naturlig nok energikrevende. Først kobler enzymet
pyruvat-karboksylase til en karboksylgruppe på pyruvatet: CH3COCOO-
+ CO2 = -OOCCH2COCOO-. Dette enzymet
har biotin som prostetisk gruppe og befinner seg i mitokondriene. Produktet,
oksaloacetat, blir så fosforylert til fosfoenolpyruvat igjen av
fosfoenolpyruvat-karboksykinase. Løsrivelsen av karboksylgruppen igjen frigjør
nok energi til at fosforyleringen er mulig. Dette skjer utenfor mitokondriene,
og oksaloacetatet fraktes gjennom mitokondriemembranene i redusert form før det
gjendannes på utsiden. Denne energikrevende prosessen som går i ett den andre
veien blir her delt i to. Dessuten gir oksaloacetatet en mulighet til effektiv
kontroll av både glukoseproduksjonen og forbrenningen. Oksaloacetatet er nemlig
også et ledd i sitronsyresyklusen, hvor pyruvatet fra glykolysen forbrennes
videre og mesteparten av energiproduksjonen foregår. Pyruvat omdannes alltid
til acetyl-koenzym A før det inngår i sitronsyresyklusen, og denne forbindelsen
må også være til stede for at biotingruppen på pyruvat-karboksylase skal kunne
karboksylere pyruvat til oksaloacetat. Hvis det er overskudd av ATP vil
oksaloacetatet bli brukt til å fabrikkere glukose. Hvis det er underskudd vil
oksaloacetatet gå sammen med acetyl-koenzym A i sitronsyresyklusen. Andre
mellomprodukter som adenosinmonofosfat og sitronsyre virker også regulerende på
de enzymene som katalyserer de to prosessene slik at den ene er nokså inaktiv
når den andre er i full gang.
Forøvrig er trinnene de
omvendte av de som inngår i glykolysen, og med de samme enzymene. Reaksjonene
er reversible og går i ønsket retning når det ønskede produktet forbrukes - med
to unntak. Enzymet fruktose-1,6-difosfatase hydrolyserer fruktose-1,6-difosfat
til fruktose-6-fosfat uten å nydanne ATP, det frigjorte fosfatet driver rundt i
plasmaet og kan brukes i senere ATP-nydannelse. Og enzymet glukose-6-fosfatase
hydrolyserer glukose-6-fosfat til glukose som siste trinn i prosessen på samme
måte som det forrige. I glukoneogenesen brukes seks trifosfater (fire ATP og to
GTP, guanidintrifosfat) for å lage et molekyl glukose, mens det er en gevinst
på to ATP ved glykolysen. Det er rett og slett det som er kostnadene ved å
gjøre en energimessig ugunstig reaksjon gjennomførbar. Glykolysen frigjør 84
kJ/mol, og samme energimengde måtte tilføres for å få reaksjonen til å gå den
andre veien. Ved å bruke fire ekstra trifosfater får man dette pluss 37 kJ/mol
ekstra, som speeder opp reaksjonen. Glukose-6-fosfatase er bundet til det
endoplasmiske nettverket i cellene, en struktur som ikke finnes i hjerne- og
muskelceller, og glukose må derfor alltid tilføres disse vevstypene.
Glukose, glukose-6-fosfat,
fruktose-6-fosfat og fruktose-1,6-difosfat er normalt alltid tilstede sammen i
kroppsvæskene. Dette fører til at reaksjonene gjerne går begge veier når den
ene prosessen ikke dominerer over den andre. Glukose kan gjerne fosforyleres og
defosforyleres et par ganger før det går videre i glykolysen. Denne
tilsynelatende unyttige sirklingen er likevel viktig fordi fosfathydrolysen
frigjør varme, som er av stor betydning for kroppsoppvarmingen, både hos varm-
og kaldblodige dyr. Humler har en spesiell fruktose-difosfatase som ikke hemmes
når glukoneogenesen foregår for fullt, og kan derfor fly også på kalde dager i
motsetning til biene. Temperaturen i vingemuskulaturen er målt til 30 °C også
på dager med lufttemperatur under 10 °C.
En sidegrein til
glykolysen er pentosefosfatkjeden hvor alle pentosene som trengs til den
biologiske syntesen blir laget, deriblant den viktige ribosen, og samtidig blir
NADPH, som er et av standard-reduksjonsmidlene i biosyntesen overført fra sin
oksyderende form, NADP+, til den reduserende. Utgangspunktet for
pentosefosfatveien er glukose-6-fosfatet som dannes først i glykolysen, og
produktet er ribose-5-fosfat:
glukose-6-fosfat + 2 NADP+ + H2O = ribose-5-fosfat + 2
NADPH + 2H+ + CO2. Det er fem trinn i prosessen og fire
enzymer involvert. Siden NADPH er vesentlig mer etterspurt enn ribose blir mye
av ribosen ført tilbake til glykolysen av enzymene transketolase og
transaldolase som omdanner tre ribosefosfat til to heksosefosfat og en
glyseraldehyd-3-fosfat som er nevnt over. Blant mellomstadiene her finner vi en
heptose, en tetrose og forskjellige pentoser som kan brukes videre i spesielle
synteser. Heksosene som lages er fruktose og ikke glukose, men de kan gå inn i
glykolysen på samme måte som glukosen. Pentosefosfatkjeden brukes nesten ikke i
muskelvevet, men den har stor trafikk i fettvevet på grunn av behovet for NADPH
til reduktiv syntese av fettsyrer.
Pyruvatet, CH3COCOO-,
konverteres ved gjæring enten til etanol eller laktat (melkesyre).
Alkoholgjæringen er en totrinnsprosess som begynner med at pyruvatet
dekarboksyleres av enzymet pyruvatdekarboksylase som har tiamin-(vitamin
B1)-pyrofosfat som koenzym: CH3COCOO- + H+ =
CH3CHO + CO2. Resultatet er altså acetaldehyd, som
reduseres til etanol med NADH av enzymet alkoholdehydrogenase, som har et
sinkion i den aktive gruppen:
CH3CHO + NADH + H+ = C2H5OH + NAD+.
Noen mikroorganismer
samt alle flercellede organismer hopper over dekarboksyleringen og reduserer
pyruvatet direkte til laktat:
CH3COCOO- + NADH + H+ = CH3CH(OH)COO-
+ NAD+. Enzymet som katalyserer denne reaksjonen heter
laktatdehydrogenase og virker begge veier etter en likevekt som forskyves på
vanlig måte ved overskudd eller kontinuerlig forbruk av et eller flere av
produktene. Hvis laktatet stadig forbrukes går reaksjonen mot høyre. I
oksygenrespirerende organismer foretrekkes videreoksydasjonen av pyruvat i
sitronsyresyklusen i stedet for denne gjæringsprosessen, som ikke produserer
noe mer energi. Men i muskler som arbeider raskt kan det hende at den
mangeleddede kjeden ikke tar unna pyruvatet så fort som det produseres i
glykolysen. Da blir det redusert til laktat for at det NAD+ som
dannes skal kunne virke oksyderende i glykolysen og produsere mer av de få ATP
som er tilgjengelig der. Laktat og pyruvat er mobile molekyler som trenger ut
og inn av membraner og føres av blodstrømmen til leveren, hvor laktatet
oksyderes tilbake til pyruvat og går inn i en glukoneogenesen for å danne
glukose som føres tilbake som brennstoff til musklene.
Alt i alt innebærer
disse gjæringsprosessene ikke noen redoksreaksjon. Den oksydasjonen av
glyceraldehyd-3-fosfat som skjer oppveies når pyruvatet eller acetaldehydet
reduseres i det siste trinnet. Derfor kan gjæringen foregå uten
oksygentilførsel.
I oksyderende miljø
foregår resten av forbrenningsreaksjonene i den såkalte sitronsyresyklusen,
hvor ikke bare glykolyseproduktene, men også produktene etter den innledende
nedbrytningen av aminosyrer og fett forbrennes. I tillegg er flere av leddene i
kjeden utgangsstoffer for syntese av mange biologiske produkter. Først her
flytter forbrenningen inn i mitokondriene, cellenes spesialiserte kjemiske
fabrikkanlegg. De fleste stoffer går inn i kjeden som acetyl-koenzym A, med en
acetylgruppe knyttet til koenzymet. Pyruvat konverteres til acetyl-koenzym A
ved oksydasjon og dekarboksylering i pyruvat-dehydrogenasekomplekset, et helt
maskineri av enzymer i mitokondriene som har NAD+, koenzym A,
tiamin-pyrofosfat, lipoamid og FAD som koenzymer:
CH3COCOO- + (CoA)-SH + NAD+ =
(CoA)-SCOCH3 + CO2 + NADH.
Reaksjonen hemmes hvis
ATP-konsentrasjonen er høy (og energibehovet derfor lite) og også av høy
konsentrasjon av acetyl-CoA og NADH. Nå er 1/3 av karbonatomene i sukkeret
omgjort til karbondioksyd som pustes ut gjennom lungene.
Det neste som skjer er
at acetylgruppen i acetyl-koenzym A kondenseres med et av mellomproduktene i
sitronsyresyklusen, oksaloacetat:
-OOCCOCH3COO-
+ CH3CO-SCoA + H2O = -OOCCH2C(OH)(COO-)CH2COO-
+ HSCoA + H+.
Resultatet er citrat,
ioneformen av sitronsyre, som syklusen har navn etter. Reaksjonen er en
aldolkondensasjon pluss hydrolyse, og enzymet som utfører den heter
citratsyntetase.
Deretter isomeres citrat
til isocitrat, -OOCCHOHCH(COO-)CH2COO-,
av akonitase ved å fjerne H og OH (som til sammen blir vann) fra det 2. og 3.
karbonet i kjeden og sette dem på igjen i omvendt rekkefølge.
Den første oksydasjonen
i syklusen utføres av isocitratdehydrogenase ved hjelp av NAD og gir
oksalosuccinat som er ustabilt og raskt avgir CO2:
-OOCCHOHCH(COO-)CH2COO-
+ NAD+ = -OOCCOCH(COO-)CH2COO-
+
-OOCCOCH(COO-)CH2COO-
+ H+ = -OOCCOCH2CH2COO-
+ CO2.
Det produserte
karbondioksydet føres til lungene og utåndes. Resten, som gjerne kalles a -ketoglutarat oksyderes igjen og dekarboksyleres av a -ketoglutaratdehydrogenase-enzymkomplekset. Dette komplekset
binder produktet til koenzym A og fungerer nokså likt
pyruvatdehydrogenasekomplekset og bruker de samme koenzymene:
-OOCCOCH2CH2COO-
+ NAD+ + CoASH = CoASCOCH2CH2COO- +
CO2 + NADH.
Produktet succinyl-koenzym
A har en energirik tioesterbinding og denne energien høstes inn av
succinyl-CoA-syntetase, som bruker den til å binde en fri fosfatgruppe til
guanosindifosfat:
CoASCOCH2CH2COO- + PO43-
+ GDP = -OOCCH2CH2COO- + GTP +
CoASH.
Nukleosiddifosfokinase
overfører fosfatgruppen fra GTP til ADP, slik at det dannes GDP igjen og ATP.
Dette er den eneste reaksjonen i syklusen som gir ATP direkte. Det meste av
ATPet produseres i respirasjonssystemet ved oksydasjon av NADH og FADH2
med luftoksygen.
Ringen sluttes når
succinatet oksyderes til oksaloacetat i en tretrinnsoperasjon. Først oksyderes
succinat til fumarat, -OOCCH=CHCOO-, av
succinatdehydrogenase ved hjelp av FAD. Deretter hydreres fumaratet til
L-malat, -OOCCHOHCH2COO-, av fumarase. Og til slutt
oksyderes malatet til oksaloacetat av malatdehydrogenase ved hjelp av NAD+.
FAD er bundet kovalent til histidin i succinatdehydrogenasen, som i motsetning
til de andre enzymene i syklusen er bundet til den indre mitokondriemembranen.
Dette enzymet er også direkte koblet til respirasjonskjeden og inneholder
jernsulfid for elektrontransport i likhet med cytokromene der.
For hvert gjennomløp av
sitronsyresyklusen brennes to karbonatomer til karbondioksyd, utbyttet er ett
ATP produsert direkte og ett FAD og tre NAD+ redusert til FADH2
og NADH. For hvert NADH fås 3 molekyler ATP og for hvert FADH2 fås 2
ATP, slik at utbyttet pr. syklus er 12 ATP. Siden hvert glukosemolekyl gir to
acetyl-koenzym A som inngangsbillett til sitronsyresyklusen og det NADH som lages
utenfor mitokondriet i glykolysen bare gir 2 ATP hver når de oksyderes, blir
det totale ATP-utbyttet fra et glukosemolekyl: 2 direkte i glykolysen + 4 fra
NADH i glykolysen + 6 fra NADH ved dekarboksylering av pyruvat + 2 direkte i
sitronayresyklusen + 22 fra NADH og FADH2 i sitronsyresyklusen =
tilsammen 36. Dette er 18 ganger så mye som ATP-produksjonen i
gjæringsprosessene, og forklarer ganske tydelig hvorfor alt plutselig går så
mye tyngre når du har brukt opp den aerobe kapasiteten din. Tilsammen bærer
ATPet med seg 1100 kJ/mol, mens fullstendig forbrenning av glukose gir 2870, en
effektivitet på 38 %. Antall mol karbondioksyd pr. mol oksygen er 1,0 i
karbohydratforbrenningen. For forbrenning av fett og protein er det litt
lavere, henholdsvis 0,71 og 0,80.
NADH fra glykolysen
oksyderes utenfor mitokondriene ved å redusere dihydroksyacetonfosfat til
glyserol-3-fosfat, som diffunderer inn gjennom membranen og reduserer FAD der
inne ved å oksyderes tilbake til dihydroksyacetonfosfat. Dette er en slags
elektronferje, som også bruker denne protongradienten som drivkraft. Reduksjon
av keton til alkohol med NADH krever nemlig også protoner. Det er fordi det er
FADH2 som produseres på innsiden at ATP-utbyttet bare er 2. Men i
hjertet og leveren brukes en annen elektronferje, som baserer seg på å bytte ut
den positivt ladde aminogruppen i aspartat med den nøytrale hydroksylgruppen i
malat, slik at NADH kan oksyderes. Den nøyaktig motsatte reaksjonen ser på
innsiden. Dette er litt mer komplisert og går saktere enn det andre
ferjesystemet, men det gir høyere utbytte, 38 ATP pr. glukose, siden det er NAD+
på innsiden som reduseres og ikke FAD.
Respirasjonsapparatet
inneholder flere elektronbærere som trinnvis frakter elektroner fra NADH og
FADH2 til oksygenet som kommer inn fra atmosfæren. Denne
elektronstrømmen driver også en protonpumpe som frakter H+-ioner ut av det
indre av mitokondriene og setter opp et membranpotensial. ATP genereres når
protonene flyter tilbake gjennom et enzymkompleks.
Mitokondrier er små,
litt langstrakt eggformede organeller inne i de eukaryotiske organismenes
celler. De består av en glatt ytre og en sterkt foldet indre membran med stor
overflate. Den ytre membranen er godt gjennomtrengelig for nesten alle slags
ioner og alle uladde molekyler, mens den indre er nesten ugjennomtrengelig.
Spesialiserte proteiner frakter slike store molekyler som ATP og fettsyrer
gjennom membranen.
Når et molekyl NADH
kommer til mitokondriemembranen og skal levere elektronet sitt treffer det
først på et enzym som heter NADH-Q-reduktase eller NADH-dehydrogenase. Dette
enzymet har flavin-mononukleotid (FMN) som prostetisk gruppe. NADH leverer som
den har for vane et proton og to elektroner, d.v.s. et hydrogenatom og et
ekstra elektron: NADH + H+ + FMN = NAD+ + FMNH2.
NADH-Q-reduktase er et protein som ligger på tvers gjennom innermembranen i
mitokondriet, og samtidig med at denne reaksjonen skjer på innsiden, avspaltes
det et proton (altså et H+ - eller rettere H3O+-ion)
på yttersiden, i rommet mellom den ytre og den indre membranen.
De overleverte
elektronene overføres så fra FMNH2 til en serie jernsulfidkomplekser
som også sitter som prostetiske grupper på NADH-Q-reduktasen. Jernsulfidene er
fordelt i små Fe2S2- og Fe4S4-grupper
som hver er festet til -SH-gruppene i fire cysteinaminosyrer i proteinet.
Jernatomene kan frakte elektroner fordi de veksler mellom +2 og +3 i
oksydasjonstrinn. Til slutt kommer elektronene til et koenzym Q10 på enzymet
som har en kinonring med en ketogruppe i hver ende som kan reduseres til en
resosansstabilisert difenolring. Koenzym Q10 er ikke tett bundet til proteinet
slik som de andre elektronbærerne i åndingskjeden. På grunn av den lange,
upolare isoprenoidkjeden har det tvert imot en høy grad av bevegelighet inne i
lipidlagene i mitokondriemembranene. Koenzym Q10 er derfor av avgjørende
betydning for elektrontransporten mellom flavoproteinene som mottar elektroner
fra brennstoffoksydasjonen og cytokrom-proteinene som overleverer dem til
oksygenet. Koenzym Q10 henter også elektronene fra det ene molekylet FADH2
som produseres i sitronsyresyklusen og leverer elektronene direkte til
jernatomene i succinat-dehydrogenase i stedet for å gå veien om FMNH2.
Cytokrom er proteiner
som transporterer elektroner og inneholder en porfyringruppe hvor jernatomet
kan opptre i de vanlige oksydasjonstrinnene +2 og +3. Hvert av dem kan
transportere ett elektron, og koenzym Q10 leverer derfor fra seg elektronene
sine til to eksemplarer av cytokrom b. Cytokrom b og c1 i tillegg til et
jernsulfidprotein befinner seg i et enzymkompleks som kalles QH2-cytokrom
c-reduktasekomplekset. Et fritt cytokrom c befordrer elektroner derfra til et
annet kompleks, cytokrom c-oksydasekomplekset, som inneholder cytokrom a og a3.
Hvert av disse molekylene har trinnvis høyere redokspotensial. Cytokrom b har
litt høyere enn den reduserte formen av koenzym Q, men litt lavere enn
jern(II)sulfid, som igjen har lavere enn cytokrom c1, c, a og a3. Og cytokrom
a3 ligger bare litt under det frie oksygenet.
Porfyringruppene i
cytokrom b, c1 og c er identisk med hemet i hemoglobin, men i c1 og c er den
kovalent bundet til proteinet med cysteingrupper som er innkondensert til
dobbeltbindingene i vinylgruppene på hemet og danner tioeterbindinger. I cytokrom
a og a3 er porfyrinet modifisert med en isoprenoid-alkohol,
3,7,11-trimetyldodekanol, som er addert inn på en av vinylgruppene slik at det
oppstår en hydroksylgruppe og en lang upolar kjede. Cytokrom a3 inneholder også
kobber, som overfører elektroner ved å veksle mellom oksydasjonstrinnene I og
II. Det frie cytokrom c fungerer som en bevegelig elektronbefordrer mellom de
to andre cytokromkompleksene. Elektronet er delvis delokalisert over hele
porfyringruppen, som har et pi-elektronnettverk akkurat som grafitt og kan
overføres fra et porfyrin til et annet hvis avstanden er mindre enn 8 Å og
planene er omtrent parallelle. Cytokrom c er uhyre motstandsdyktig mot
evolusjon, varianter av proteinet fra virveldyr er til forveksling like
varianter fra bakterier som skilte lag med oss i utviklingen for godt over 1
milliard år siden.
Cytokrom P450 er en
betegnelse på enzymer som inneholder hem og fungerer som oksygenaser, de tar
oksygenatomer fra oksygenmolekyler og fører dem inn i andre molekyler, f.eks.
kan de innføre et oksygenatom i en C-H-enhet slik at det dannes en
alkoholgruppe, C-OH. Også her kan jernet komme opp i oksydasjonstrinn IV eller
kanskje til og med V i prosessen. I tillegg til de 4 nitrogenatomene i
porfyrinet er jernatomet også koordinert til et svovelatom i proteinet, mens
den 6. posisjonen kan være tom eller opptatt av et vannmolekyl når enzymet ikke
er i bruk.
Selve produksjonen av
ATP skjer på utsiden av innermembranen ved hjelp av et stort proteinkompleks
som ligger tvers igjennom membranen. Drivkraften er de H3O+-ionene
som frigjøres av NADH-Q-reduktasen på utsiden av innermembranen når det
transporteres elektroner inn i mitokondriet. Dette setter opp et osmotisk
trykk, og ATP-produksjonskomplekset inneholder en protonkanal som slipper inn
hydroniumionene og bruker den frigjorte energien til å produsere ATP på en måte
som ikke er helt klarlagt.
Et enzym som heter
ATP-ADP-translokase og utgjør så mye som 6 % av alt protein i den indre
membranveggen frakter ADP inn i det indre av mitokondriet og ATP ut igjen. Det
frakter ADP inn bare hvis det finnes ATP på innsiden, og det frakter bare ATP
ut hvis det finnes ADP på utsiden.
Oksydasjonen av NADH og
FADH2 gir store mengder energi, f.eks. gir NADH + 1/2 O2
+ H+ = H2O + NAD+ hele 220,1 kJ/mol, mer enn 7
ganger så mye som skal til for å fosforylere ADP til ATP. Slike store
energimengder er biologiske materialer ikke bygd for, og det er derfor det er
nødvendig med en slik flertrinns elektrontransportlinje med cytokrom- og
jernsulfidproteiner.
Nøkkelen til
opprinnelsen av alt liv er lipider, forholdsvis langstrakte molekyler som er
polare i den ene enden og upolare i den andre, slik at de har en vannløselig og
en vannavstøtende ende. Hvis molekylene hadde vært korte ville de
vannavstøtende endene trukket sammen mens de vannløselige ville vært vendt ut
mot vannmolekylene i en enkel kulefasong, men siden de er lange arrangerer de
seg i dobbeltskikt hvor molekylene ligger parallelt med de vannløselige endene
i overflaten ut mot vannet og de vannavstøtende inn mot de vannavstøtende
endene i det andre skiktet. Hvis et slikt dobbeltskikt har en grense blir jo de
vannavstøtende endene inne i skiktet der utsatt for vannet, og derfor er den
mest stabile konfigurasjonen for et slikt skikt en kule, uten grenseskjæringer
og en passelig stor diameter slik at de vannkjære delene ytterst ikke spriker
for mye og slipper inn vann til de vannavstøtende. Inne i slike kuler har livet
oppstått, og cellene til dagens levende organismer har membraner som for en stor
del består av slike dobbeltskikt av lipider. Slike cellevegger o.a. membraner
er flytende, ikke faste substanser, både lipidmolekylene og andre molekyler,
f.eks. proteiner, som sitter i membranene, kan flyte rundt hverandre, ingen har
veldefinerte posisjoner. Organismer som beveger seg ut av vannet eller av andre
grunner trenger kraftigere grenser mot omverdenen har derfor lagd seg
cellevegger av solidere materialer, f.eks. plantenes cellulose. Lipidvegger er
nesten ugjennomtrengelig for de fleste biologiske molekyler, som aminosyrer,
sukker, proteiner og nukleinsyrer, samt ioner, som alle er lett løselig i vann
og uløselig i hydrokarboner, slik at for dem danner slike dobbeltveggede kuler
en indre og en ytre verden med grenser som det skal spesielle midler til for å
overskride.
Senere ble lipidene også
tatt i bruk som brennstoff og energilager. Enerådende i dette henseende er
triglyserider av fettsyrer. Fettsyrene varierer i lengde og metningsgrad.
Antall karboner kan være fra 12 til 24, odde tall forekommer ikke. 16-18 er det
vanligste. Antall dobbeltbindinger i kjeden kan være fra 0 til 4. Kjedene er
nesten alltid uten forgreninger i dyrefett. Dobbeltbindingene er oftest
cis-konfigurerte, d.v.s. at kjeden fortsetter hver vei fra bindingen på samme
side. Mellom dobbeltbindingene i flerumettede fettsyrer ligger det alltid minst
en -CH2-gruppe. Som nevnt varierer viskositeten og smeltepunktene
til fettsyrene med kjedelengdene og metningsgraden. F.eks. er smeltepunktet til
den mettede palmitinsyre med 16 C 63,2 °C, mens den mettede stearinsyre med 18
C har 69,6 °C. Men oljesyre med 18 C og en dobbeltbinding smelter ved 13,4 °C
og flerumettede syrer enda lavere. Planter og kaldblodige dyr har derfor mer
umettet fett enn varmblodige dyr og kan fungere og være myke og smidige ved
lavere temperatur.
Hvis en dyreorganisme
tar inn betydelig mer energi enn det trenger, lagres det for det meste som
fett. Det meste av fettsyresyntesen foregår i et enzymkompleks som kalles
fettsyresyntetase og befinner seg i celleplasmaet. Det første som skjer er at
acetyl-CoA karboksyleres til malonyl-CoA, -OOCCH2CO-S-CoA,
av enzymet acetyl-CoA-karboksylase, som inneholder en biotingruppe festet til
lysin akkurat som i pyruvatkarboksylase, og forbruker et ATP og et
bikarbonation i reaksjonen. ATP'et brukes til å karboksylere biotinet, en
reaksjon som krever litt energi. Hos eukaryoter (organismer med cellekjerne)
eksisterer acetyl-CoA-karboksylase vanligvis som en inaktiv monomer på 450 kD.
Men når citratnivået i cellevæsken stiger mye som tegn på at det er tatt opp
mye energi, kobles de sammen til lange filamentliknende polymerer som kan sees
i mikroskop og katalyserer denne starten av fettsyresyntesen. Som ventelig kan
være fører et høyt nivå av sluttproduktet, palmitoyl-CoA, til at polymeren
splittes opp igjen til den inaktive formen. Bakterier bruker fettsyrer mest til
syntese av fosfolipider, og de har en mindre acetyl-CoA-karboksylase som ikke
polymeriseres og heller ikke påvirkes av citrat.
Mellomproduktene i
fettsyresyntese er bundet til et bærerprotein (ACP) som inneholder den samme
aktive pantotensyregruppen som koenzym A og fester proto-fettsyrene i en
sulfhydrylgruppe (-SH) på samme måte som det.
Forlengelsesfasen i
fettsyresyntesen foregår i fettsyresyntetasekomplekset, som er en
frittsvømmende sammensetning av flere forskjellige enzym-proteiner med en
diameter på ca. 150 Å. Først overføres acetyl-CoA og malonyl-CoA til ACP. Så
reagerer de med hverandre og vi får acetoacetyl-ACP. Her frigjøres
karbondioksyd, med det samme karbonatomet som stammet fra bikarbonatet. Denne
dekarboksyleringen er energimessig gunstig og driver reaksjonen. Vi ofret jo et
ATP for å muliggjøre den. Nå reduseres ketogruppen i acetoacetylet med NADPH
til en CHOH-gruppe slik at vi får D-3-hydroksybutyryl-ACP. Deretter skjer en
dehydrering over 2- og 3-karbonene slik at det oppstår en dobbeltbinding.
Resultatet er krotonyl-ACP, CH3CH:CHCO-S-ACP. Dobbeltbindingen
reduseres deretter igjen med NADPH. Resultatet nå er butyryl-ACP, altså
fettsyren smørsyre bundet til ACP. Syklusen begynner pånytt igjen når
butyryl-ACP reagerer med malonyl-ACP og kan fortsette helt til det er 16
karboner i kjeden. Komplekset kan ikke kondensere så lange fettsyrer med
malonyl-ACP, og syren, som nå er palmitinsyre, spaltes fra ACP'et slik at dette
kan brukes igjen. Palmitinsyre krever 7 forlengelser av acetyl-ACP, slik at
hvis forlengelsesreaksjonen går så langt har den et energiforbruk på 7 ATP.
Dessuten stammer ikke acetyl-CoA'et direkte fra forbrenningsreaksjonene i
mitokondriene, siden acetyl-CoA ikke trenger gjennom mitokondriemembranene. Det
gjør derimot sitronsyre, som spaltes i oksaloacetat og acetyl som bindes til
koenzym A ved forbruk av et ATP. Til palmitinsyresyntese trengs 8 acetyl-CoA og
det totale energiforbruket ved syntesen er altså 15 ATP. Oksaloacetatet må
tilbake til mitokondriene for å delta i sitronsyresyklusen, og siden heller
ikke dette trenger gjennom membranene omdannes det til pyruvat ved først å
reduseres til malat med NADH og deretter oksyderes med NADP+. Pyruvatet
trenger lett gjennom og det NADPH'et som dannes etter oksydasjonen brukes i
fettsyreforlengelsen. Resten kommer fra pentosefosfatkjeden.
Lengre fettsyrer enn
palmitinsyre kan produseres i kjerneceller i enzymsystemer som er forbundet med
membranene i det endoplasmiske nettverket (mikrosomsystemene). Disse systemene
kan legge til to-karbonenheter både på mettede og umettede fettsyrer, og de kan
legge inn dobbeltbindinger i fettsyrene på bestemte steder med et enzym som
bruker molekylært oksygen. Pattedyr mangler et enzym som kan legge inn
dobbeltbindinger fra posisjon 10 og utover i karbonkjeden. Derfor er linolsyre
med dobbeltbindinger i 9- og 12-posisjonene og linolensyre med dobbeltbindinger
i 9-, 12- og 15-posisjonene essensielle fettsyrer som må tilføres og har vært
regnet til vitaminene (vitamin F).
For å kunne lagres som
fett må fettsyrene forestres til glyserol. Dette skjer med utgangspunkt i
glyserol-3-fosfat, som produseres under glykolysen eller kan dannes ved å
fosforylere glyserol fra tidligere fettnedbrytning. Fettsyrene bindes til
koenzym A, som forestrer dem først til 1-karbonet og deretter til 2-karbonet
slik at det dannes et fosfatidat. Den siste fettsyren forestres inn i et
membranbundet enzymkompleks som kalles triacylglyserolsyntetasekomplekset.
Først hydrolyseres fosfatgruppen av en fosfatase og deretter bindes den tredje
fettsyren av en diglyceridacyltransferase.
Men det er også et stort
behov for lipider til oppbygningen av cellemembraner, og disse utgjøres
hovedsakelig av fosfolipider, som fremstilles på grunnlag av fosfatidatet. Et
fosfatidatmolekyl aktiveres for fosfolipidsyntese ved at det bindes et molekyl
av nukleotidet cytidintrifosfat til fosfatgruppen ved avspalting av en
pyrofosfatgruppe, slik at det blir igjen to fosfatenheter mellom sukkeret i
nukleotidet og glyserolen i fosfatidatet. CTP spiller her samme rolle som UTP i
glykogensyntesen. Deretter reagerer den aktiverte fosfatidylenheten med en
polar alkohol ved at det avspaltes cytidinmonofosfat og alkoholen forestres til
den opprinnelige fosfatgruppen på glyserolen. Hvis den polare alkoholen er
serin, dannes fosfatidylserin, som kan omdannes til fosfatidyletanolamin ved
dekarboksylering og videre til fosfatidylcholin ved metylering. Men
fosfatidyletanolamin og fosfatidylcholin kan også lages direkte med etanolamin
eller cholin som er aktivert med ATP og CTP. Disse fosfolipidene kalles
lecitiner. En annen gruppe fosfolipider som kalles plasmalogener og som skiller
seg fra lecitinene ved at en alkohol med dobbeltbinding i 1,2-posisjonen er
eterbundet til 1-karbonet i glyserolen fremstilles på samme måte.
En tredje type
fosfolipider er sfingolipidene, som i stedet for glyserol bruker sfingosin som
ryggrad. Sfingosinet fremstilles ved at palmitylgruppen i palmitoyl-CoA føret
bindes til karboksyl-posisjonen i serin samtidig som serinet dekarboksyleres.
Den resulterende ketogruppen reduseres deretter med NADPH til en CHOH-gruppe,
og til slutt oksyderes 2,3-bindingen i palmitylgruppen til en dobbeltbinding.
Sfingosinet har strukturen C13H27CH=CHCH(OH)CH(NH2)CH2OH,
med en lang upolar kjede i tillegg til de tre bindingspunktene, hvor det midtre
har en aminogruppe i stedet for alkoholgruppen som glyserolen har. Aminogruppen
vil vanligvis være bundet til en acylgruppe som aktiveres med koenzym A.
Resultatet er ceramid eller N-acylsfingosin. Den ytterste alkoholgruppen
substitueres med forskjellige komponenter for å danne forskjellige typer
sfingolipider. Sfingomyelin forestres med fosforylcholin, i cerebrosidene er
det eterbundet et glukose- eller galaktosemolekyl, mens i gangliosidene er det
bundet en kort, gjerne forgrenet kjede av mer eller mindre modifiserte
sukkermolekyler til glukosen i cerebrosidet, gjerne galaktose, men også
N-acetylgalaktosamin, N-acetylneuraminsyre eller N-glykolylneuraminsyre. Disse
to sure sukkerartene kalles med et fellesnavn sialsyrer. Sfingolipidene er
knyttet til membranene i nervesystemet. Gangliosidene er spesielt vanlige i den
grå hjernemassen, hvor de utgjør 6 % av alle lipider.
Det fjerde membranlipidet
er helt annerledes. Det heter kolesterol og består av 4 konjugerte ringer med
en lang upolar kjede i den ene enden og en polar alkoholgruppe i den andre.
Kolesterol hører til en vidt utbredt og sterkt variert gruppe forbindelser med
mange forskjellige funksjoner som kalles isoprenoider. Grunnenheten er isopren,
CH2=C(CH3)CH=CH2, som bygges opp fra
acetyl-CoA og acetoacetyl-CoA. Det første produktet er
3-hydroksy-3-metylglutaryl-CoA, CoA-S-CO-CH2-C(OH)(CH3)-CH2-COOH.
For kolesterolproduksjon reduseres dette med NADPH av en reduktase i
cytoplasmaet til mevalonsyre, CH2OH-CH2-C(OH)(CH3)-CH2-COOH.
Ved hjelp av 3 enheter ATP forestres to fosfatgrupper til alkoholgruppen på
enden og en til den på midten, og etter den sistnevnte fosforyleringen unnslipper
karboksylgruppen som karbondioksyd sammen med den sist påførte fosfatgruppen,
slik at resultatet er isopentenylpyrofosfat, CH2=C(CH3)-CH2-CH2OP2O63-.
Fra isopentenylpyrofosfat kan isopren fås ved dehydrering, men dette skjer bare
indirekte i den organiske syntesen, hvor isoprenkjeder bygges opp ved
sammensetning av flere enheter isopentenylpyrofosfat.
For produksjon av
kolesterol isomeriseres først isopentenylpyrofosfat til dimetylallylpyrofosfat,
(CH3)2C=CH-CH2-OP2O63-.
Tre slike enheter kombineres så ved avspalting av pyrofosfat til
farnesylpyrofosfat, (CH3)2C=CH-CH2-CH2-C(CH3)=CH-CH2-CH2-C(CH3)=CH-CH2-OP2O63-,
og to farnesylpyrofosfater blir så defosforylert og kombinert ved reduksjon med
NADPH til squalen, (CH3)2C=CH-CH2-CH2-C(CH3)=CH-CH2-CH2-C(CH3)=CH-CH2-CH2-CH=C(CH3)-CH2-CH2-CH=C(CH3)-CH2-CH2-CH=C(CH3)2.
Dette lange hydrokarbonet konverteres til kolesterol ved at det føres inn en
epoksybro over den første dobbeltbindingen i den ene enden ved hjelp av
molekylært oksygen og NADPH, en cyklase lukker ringene slik at det dannes
lanosterol, som konverteres til kolesterol ved at det fjernes tre metylgrupper.
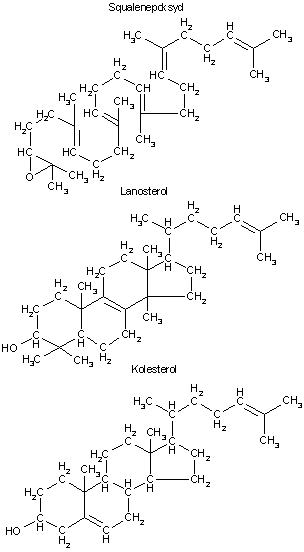 Det er bare eukaryoter,
luftåndende organismer med cellekjerne, som kan produsere kolesterol. I
membranene brukes de til å regulere viskositeten av membranveggen. En passende
tilblanding av kolesterol hindrer at fettsyrene inne i veggen går sammen til
krystaller, og de står også i veien for større bevegelser av fosfolipidene.
Det er bare eukaryoter,
luftåndende organismer med cellekjerne, som kan produsere kolesterol. I
membranene brukes de til å regulere viskositeten av membranveggen. En passende
tilblanding av kolesterol hindrer at fettsyrene inne i veggen går sammen til
krystaller, og de står også i veien for større bevegelser av fosfolipidene.
Den eneste vannkjære
gruppen i kolesterolet er den ene alkoholgruppen, som ikke er så veldig polar.
Derfor kan kolesterolet forholdsvis lett bevege seg inn i den upolare delen av
membranen og komme ut på den andre siden. På grunn av denne frie bevegeligheten
på tvers av membranene danner kolesterolet grunnlag for en rekke hormoner som
går inn gjennom cellemembranene og regulerer aktivitetene i selve cellekjernen.
Disse hormonene kalles steroider. Som DNA er steroidene en slags symbolsk språk
eller kode mellom den hormonproduserende kjertelen og mottakerorganet. Det er
ikke noe direkte sammenheng mellom kjemisk sammenheng og funksjon, og steroider
med små forskjeller i sammensetning kan ha vidt forskjellig funksjon i
organismen, for eksempel:
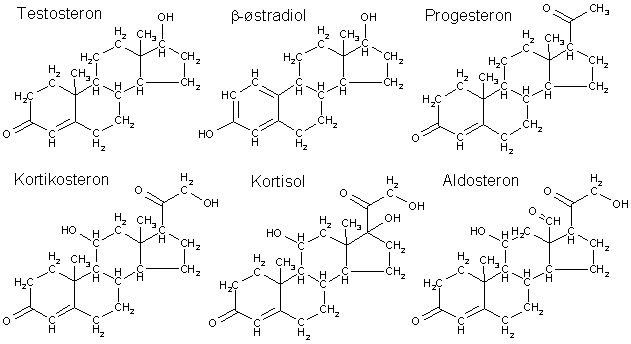
En annen viktig funksjon
for kolesterol er som utgangspunkt for gallesyrene, som hjelper til med
nedbrytningen av lipidene i kosten. Syregruppen er sterkt polar og molekylene
er dermed amfifile og har god vaskeevne for fett. Et aggregat av gallesyrer og
fett er løselig i vann, i motsetning til fettet selv, og dermed kan fettet
transporteres i kroppsvæskene. Den større overflaten av aggregatene fører også
til at fettet lettere kan hydrolyseres av lipaser og gjør også opptaket lettere.
Kolesterol og andre
lipider som er produsert i kroppen eller tatt opp fra maten er altså uløselige
i kroppsvæskene, som er basert på vann, og det er derfor nødvendig med
hjelpemidler for å transportere dem rundt i kroppen. Transportmidlet er såkalte
lipoproteiner, som deles inn i tre klasser etter tettheten, ultralette, lette
og tunge. De engelske betegnelsene er very low density, low density og high
density lipoproteins, og de vanlig brukte forkortelsene er derfor VLDL, LDL og
HDL. I tillegg finnes det en spesielt lett type som kalles chylomikroner. Alle
har som micellene i et vaskemiddel et sterkt hydrofobt indre og et hydrofilt
ytre og virker som dem ved å gjøre fett løselig i vann. I tillegg er de
overtrukket av et såkalt apoprotein. Proteinkomplekset inneholder også signaler
som regulerer inn- og utgangen av bestemte lipider på bestemte steder.
Chylomikronene lages i leveren og tarmen og har til oppgave å transportere
triglyserider, kolesterol og andre lipider fra tarmen til fettvevet og leveren.
De er de største av aggregatene og har også lavest tetthet fordi de inneholder
mye fett. Proteininnholdet er til vanlig mindre enn 2 %. VLDL lages mest i
leveren og transporterer triglyderider som lages i kroppen til fettvevet. Etter
leveransen omdannes lipoproteinet til LDL, som er rik på kolesterolestre, for
det meste estre av kolesterol og linolsyre. LDL brukes til å frakte kolesterol
rundt i vevet der det er behov for det og regulere nydannelsen av kolesterol.
HDL lages i leveren og inneholder mest membranlipider, fosfolipider og
kolesterol. De brukes bl.a. til å transportere kolesterol fra resten av kroppen
til leveren.
Celler som trenger
kolesterol tar det opp fra LDL ved å binde LDL-aggregater til spesielle
reseptorgroper og oppsluke dem, en såkalt endocytose. De innelukkede
LDL-aggregatene fraktes til lysosomer, som inneholder mange nedbrytende
enzymer. Der blir proteindelen oppløst i sine enkelte aminosyrer, kolesterolet
hydrolyseres fra linolsyren og fraktes til celleveggen hvis det er behov for
det eller det lagres som estre av oljesyre eller palmitoljesyre, som er
enumettede fettsyrer i motsetning til den flerumettede linolsyren. Overskudd av
fett i kosten eller underskudd av flerumettede fettsyrer fører til problemer
med LDL-sirkulasjonen. Kolesterolestre kan avsettes på karveggene og føre til
blodpropp, infarkt eller hjerneslag. Mange har også fra naturens side svekket
funksjon av LDL-reseptorene, slik at det lett hoper seg opp LDL i blodet og det
avsettes kolesterolestre. Disse personene må være ekstra forsiktige med fett i
kostholdet.
Kolesterol i kosten
brukes bare som membranlipid eller som råstoff for steroider eller andre
stoffer som lages av kolesterol. Noe av kolesterolet og enkelte
kolesterolderivater kan spaltes i huden av ultrafiolett lys og omdannes til en
form av vitamin D. Overskytende kolesterol kan samles inn av HDL, omdannes til
gallesyrer og skilles ut. Hvis kroppen ikke får tilstrekkelig kolesterol
fremstilles det i leveren. En person som lever på kolesterolfri diett lager ca.
800 mg kolesterol daglig i leveren.
Triglyserider i kosten
blir enten lagret i fettvevet eller brukt i forbrenningen hvis kosten ikke
inneholder nok sukker. Hvis kosten ikke inneholder nok sukker blir også fett
fra fettvevet brent. Ingen dyr kan omdanne fett til sukker, det må forbrennes
slik det er. Først hydrolyseres triglyseridene til fettsyrer og glyserol med
lipaser i fettvevet. Glyserolen fosforyleres av glyserolkinase ved forbruk av
ett ATP til glyserol-3-fosfat, som oksyderes av glyserolfosfatdehydrogenase med
NAD+ til dihydroksyacetonfosfat, som inngår i glykolysen.
Fettsyrene oksyderes i
mitokondriene. Hver fettsyre aktiveres ved å bindes til koenzym A av enzymet
acyl-CoA-syntetase i den ytre mitokondrieveggen. Dette er også en energikrevende
reaksjon, som forbruker ett ATP. Nukleotidet bindes til karboksylgruppen ved at
det spaltes av to fosfatgrupper. Deretter erstatter koenzym A AMP-gruppen.
Begge disse reaksjonene er reversible, men reaksjonen drives riktig vei ved at
en pyrofosfatase spalter den doble fosfatgruppen, en framdriftmekanisme som er
vanlig i biokjemien. For at fettsyrene skal kunne oksyderes må de transporteres
gjennom både ytter- og innermembranene til mitokondriet. Dette gjøres ved at de
bindes til OH-gruppen i det sterkt polare molekylet karnitin, (CH3)3N+-CH2-CH(OH)-CH2-COO-,
mens koenzym A avspaltes.
På innsiden byttes
karnitinet ut med koenzym A igjen. Her oksyderes to og to av fettsyrekarbonene
i en syklus som kalles b -oksydasjonskjeden, fordi
angrepspunktet er 3-karbonet, som i eldre nomenklatur kalles b -karbonet. Først oksyderes bindingen mellom 2- og 3-karbonene til
en trans-dobbeltbinding av en acyl-CoA-dehydrogenase med FAD. Deretter adderes
et molekyl vann over dobbeltbindingen av enoyl-CoA-hydratase slik at det kommer
en OH-gruppe på 3-karbonet og vi får et L-3-hydroksyacyl-CoA. Dette oksyderes
så av L-3-hydroksyacyldehydrogenase med NAD+ slik at CH(OH)-gruppen
omdannes til en ketogruppe. Dermed har vi -CH2-CO-CH2-CO-S-CoA,
og det siste trinnet i syklusen er en tiolyse hvor b -ketotiolase binder et nytt koenzym A til den nye ketogruppen,
mens alt til høyre for den i formelen spaltes av som acetyl-CoA, som kan gå inn
i sitronsyresyklusen. Dermed er fettsyren forkortet med to karboner og syklusen
kan gå nye runder til det bare er to acetyl-CoA igjen.
En fettsyre inneholder
ganske mye energi. Siden hver NADH som nevnt gir tre ATP og hver FADH2
gir to og hver acetyl-CoA gir 12 ATP i sitronsyresyklusen, mens to
fosfatavspaltinger kreves for å aktivere fettsyren, blir resultatet for
palmitinsyre med 16 karboner 7x5 + 8x12 - 2 = 129 ATP. Umettede fettsyrer gir
litt mindre, fordi oksydasjonen med FAD ikke er nødvendig over
dobbeltbindingene. Dessuten krever de spesialbehandling fordi dobbeltbindingene
ofte havner i 3,4-posisjonen i stedet for 2,3-posisjonen og dessuten gjerne er
cis-konfigurerte, mens enzymene i b
-oksydasjonskjeden bare kan bruke trans-fettsyrer. Men dette ordnes greit av en
isomerase som flytter feilplasserte dobbeltbindinger og i tillegg trans-konfigurerer
dem, og av en epimerase som omkonfigurerer riktig plasserte dobbeltbindinger
som er cis-konfigurert. Svært få fettsyrer har et odde antall karboner, men
disse kan også forbrennes fullstendig, selv om det siste trinnet i
oksydasjonskjeden gir en acetyl-CoA og en en propionyl-CoA. Men sistnevnte går
inn i sitronsyresyklusen etter oksydasjon til succinyl-CoA.
Ved faste eller ved
sukkersyke vil forbrenningen av acetyl-CoA fra fett i sitronsyresyklusen kunne
bli ineffektiv fordi oksaloeddiksyre, som er det siste forstadiet til
sitronsyre, brukes til å lage glukose. To acetyl-CoA går sammen til
aceteddiksyre mens to koenzym A frigjøres. Noe av aceteddiksyren vil kunne
reduseres til 3-hydroksysmørsyre i mitokondriene hvis de inneholder mye NADH.
Den blir også spontant dekarboksylert til aceton i en viss grad, og
acetonlukten i ånden er merkbar hos sukkersykepasienter og folk som faster
eller sulter. Men både aceteddiksyre og 3-hydroksysmørsyre kan forbrennes i
sitronsyresyklusen ved at de aktiveres med koenzym A og spaltes til to enheter
acetyl-CoA. Faktisk produserer leveren stadig store mengder aceteddiksyre som
sendes ut i blodbanene og brukes av hjertet og binyrebarken i stedet for
glukose fordi det er raskere å produsere acetyl-CoA av dem enn å gå gjennom
hele glykolyseprosessen. Hjernen bruker vanligvis bare glukose, men ved faste
er den i stand til å gå over til aceteddiksyre, og ved langvarig faste kan
opptil 75 % av hjernens energibehov dekkes av aceteddiksyre.
Isoprenoider med
forskjellig antall isoprenenheter og forskjellig grad av kjemisk modifikasjon
forekommer i en rekke forskjellige naturprodukter. Aromastoffene i mange
planter er flyktige 2- eller 3-doble isoprenoider som kalles terpener, for eksempel
myrcen fra laurbærblader, limonen fra sitroner og zingiberen fra ingefær. Ikke
alle terpener er hydrokarboner, f.eks. er geraniol fra geraniumplanter og
mentol fra peppermynteplanter substituert med alkoholgrupper og citronellal fra
sitronellaplanter er et aldehyd. Naturgummi er en lineær polymer av
isoprenenheter. Mange viktige biologiske molekyler inneholder isoprenkjeder,
f.eks. vitamin K2, koenzym Q10 og klorofyll. Karotenoider, som gir farge til
gulrøtter og tomater, er bygd opp av 8 isoprenenheter. De er viktige for
opptaket av lysenergi i fotosyntesen og brukes av enkelte bakterier som
beskyttelse mot lys. Hos dyr tas de opp og spaltes til retinol, som er
utgangspunkt for den lysfølsomme delen av synsmekanismen.
UTNYTTELSE
Karbon og karbonforbindelser har vært utnyttet av mennesker, av
menneskeliknende vesener og andre vesener så lenge livet har eksistert på
Jorda. Som næring, d.v.s. som energikilde og materialer til å bygge kropper,
reparere skader på seg selv og fortsette eksistensen, har de vært brukt av
alle, enten ved at de har jagd og fanget fremmed levende materie og innlemmet
den i seg selv eller ved at de har søkt, funnet og tatt opp død karbonholdig
materie i omgivelsene, materie som kan stamme fra døde organismer eller ha helt
uorganisk opphav.
Karbonholdig materie kan
også tas i bruk mer indirekte, også til andre formål enn ernæring, som verktøy
til å skaffe seg ernæring eller forøvrig hjelpemidler til å utøve aktiviteter
som direkte eller indirekte fører til at eksistensen fortsetter, enten
individuelt eller kollektivt. Mange skapninger tar i bruk andre levende vesener
til sine formål. I symbiose drar begge partene nytte av samarbeidet, i
kommensalisme er det bare den ene som har fordelene, mens i parasittisme har
den ene fordel mens den andre har ulemper av samværet. f.eks. er menneskene
parasitter på kveg og fjærkre mens vi lever kommensalt med (tja, skal vi se...)
blåbærplantene (hm) og symbiotisk med kattene våre. Men også mange døde
karbonholdige materialer tas i bruk.
Bare plantene idag har
evnen til å lage organiske karbonforbindelser av uorganiske. Noen planter kan
til og med i samarbeid med visse bakterier fiksere uorganisk nitrogen fra
lufta. Alle vi andre må finne og drepe andre organismer eller samle
etterlatenskaper etter dem for å få noe å leve av. De karbonholdige
forbindelsene vi i første rekke er ute etter er proteiner, karbohydrater og
fett. I tillegg kommer en rekke like viktige substanser som vi kaller vitaminer.
I naturen finnes mono-
og disakkarider som glukose og sukrose, det vanlige sukkeret, og polysakkarider
som stivelse og cellulose.
Av sukker kan man lage
karamell ved oppvarming. Vanlig karamell (E150a) brukes som sukkertøy og som
tilsetning til en rekke matvarer som smaksstoff og brunt fargestoff. Sterkere
fargevirkning fås ved tilsetning av ammoniakk eller ammoniumsalter ved
oppvarmingen, og produktet, ammoniert karamell (E150c) er også kjent som
sukkerkulør og har utstrakt bruk, men det er innført en riktignok forholdsvis
liberal grenseverdi på grunn av registrerte celleforandringer og fordi stoffet
motvirker vitamin B6 i kroppen. Det kan også lages ammoniert, sulfittert
karamell (E150d) ved tilsetning av svoveldioksyd eller sulfitt i tillegg til
ammoniakken. Vanlige bruksområder er iskrem, milkshake, desserter, majones,
sauser, hermetisert fisk og skalldyr, fylte kjeks, hermetisk frukt og
grønnsaker, sitrusmarmelade, ketchup og sennep, sukkertøy, saft, brus, vin,
brennevis, kosttilskudd etc.
Stivelse kan spaltes til
maltose av et enzym i spyttet som går under det velvalgte navnet ptyalin. Dette
kjenner du hvis du putter en rå potetskive eller en teskje mel i munnen og lar
dem ligge der litt. Etterhvert smaker det søtt. Også spirende korn inneholder
et stivelsesspaltende enzym som kalles diastase eller amylase. Du kan selv lage
malt ved å la korn spire. Ta en mengde byggkorn og legg den utover i en flat
haug, gjerne på et klede. Sørg for at det holdes fuktig til spirebladene er
like lange som kornet. Da er sukkermengden på det høyeste og kornet, som nå kalles
malt, legges ut til tørk, gjerne ved oppvarming.
Og hvis du har lyst kan
du jo la prosessen gå litt videre også. Lunk litt på et passende volum vann og
hell det over maltet under omrøring. Når du filtrerer bort maltrestene får du
en søt oppløsning som kalles vørter. I slike søte vannoppløsninger ligger
forholdene godt til rette for en årmilliardgammel prosess, den samme prosessen
som antakelig de første mikroorganismene brukte til å omsette sukkeret sitt til
energi, de som levde da atmosfæren var reduserende, før fotosyntesen fylte opp
med oksygen i den. Denne prosessen kan gå fullstendig uten nærvær av oksygen,
og den kalles gjæring.
Gjæringsprosesser har
antakelig vært kjent like lenge som kornet. Frøet av de tidlige kornplantene
kunne naturligvis spises, slik som andre frø. De var ikke særlig gode, men
dugde når man ikke hadde noe annet. Imidlertid oppdaget man snart at det
skjedde noe artig hvis kornet ble lagret fuktig. Folkene som gjorde dette var
naturligvis nomader, og tørr lagring var ikke alltid helt lett å oppnå. Og
denne artige opplevelsen fikk konsekvenser - og som alltid når vi mennesker
gjør spesielt artige oppdagelser, går vi til sterke tiltak for å ta vare på
dem. Så derfor oppga disse en gang så frie nomadene sitt utøylede liv flakkende
over de store vidder, for å bygge hus og passe korn og gjøre hardt arbeid hver
dag, men stundom, stundom slå seg løs og bli lystige.
Dessverre fant man jo
snart ut at det ikke gikk an å være lystig hver dag, for hvem skulle ellers
bygge husene, passe kornet, sørge for å skaffe det daglige brød?
Ja, bokstavelig talt.
Brød er et nyttig biprodukt av alt dette lystighetsmakeriet som man fant seg
anledning til å ta i bruk så snart kornarealene kunne gjøres store nok til at
det ble noe til overs etter all brygginga. Usyret og syret brød. Flatbrød.
Du har lagd malt av
kornet, d.v.s. "maltet" det, og rørt ut maltet i vann for å lage
vørter av det, d.v.s. at du har "mesket" maltet. Nå skal du brygge,
d.v.s. lage øl av vørteren. På det mest primitive plan består dette i å sette
vørteren til gjæring. Naturlige gjærsopper finnes overalt, og i den søte
vørteren starter prosessen raskt. Produktet er øl, selv om du ikke gjør noe
annet med det, det inneholder bra med alkohol og gir rus, men er kanskje ikke
så festlig å drikke som mer velsmakende produkter. Ganske tidlig i
ølproduksjonens historie ble det vanlig å koke vørteren med humle før gjæringen
for å gi ølet en bitter smak. Og de naturlige gjærstammene kan ha vidt
forskjellige egenskaper, så for å sikre best resultat brukes rendyrkede stammer
med de ønskede egenskapene, som selges i form av ølgjær. Til slutt lagres ølet
kjølig og tilkorket for å modnes og mettes med kullsyre.
Siden fant man en rekke
andre ting som kunne gjæres. Er det druesaft som gjæres opp kaller vi produktet
vin. Lette vinsorter har 9-15 % etanol. Hetviner er spritet opp til opptil 23
%. Også saft av andre frukter, eple, rips o.s.v. kan det legges vin av på
tilsvarende måte.
Men når alkoholprosenten
er kommet opp i 16 % blir det for giftig for de små gjærsoppene, de blir syke
eller dør og produksjonen stopper. Skal en oppnå høyere alkoholkonsentrasjon må
man destillere, eller brenne som det også kalles. Etanol koker ved 78,5 C og
kan derfor lett skilles fra vannet. Destillasjonsproduktet, råspriten, kan ved
vanlige tekniske eller hobbymessige (?) metoder komme opp i 95 % alkohol. Det
som blir igjen av satsen kan også komme til nytte. Er det potetsprit som
destilleres kalles det gjenblevne drank, en ganske næringsrik substans som er
mye brukt som dyrefor, mens altså menneskene får den delen som er uten næring.
Råspriten inneholder fuseloljer, som fjernes ved å gi det en ny omgang i
destillasjonsapparatet. Fuseloljene er også gjæringsprodukter og består for en
stor del av tyngre alkoholer enn etanol, propanol, butanol m.m. De virker mer
berusende enn etanolen, men har også andre skadelige og ubehagelige virkninger.
De er vanskelige å fjerne helt, og selv den grundigst redestillerte finspriten
inneholder små mengder fuseloljer.
Etanol er et produkt som
har vidstrakt anvendelse i industrien, særlig som løsnings-, ekstraksjons- og
rengjøringsmiddel. Noe utnyttelse som brennstoff har det også. Mange
forskjellige sukkerholdige råvarer kan brukes til forgjæringen. I land med mye
papirindustri gir sulfittbehandling av tre store mengder av et biprodukt etter
at cellulosen er brukt til papirfremstilling, som består av oppløst lignin,
trestoff + om lag 2 % karbohydrater som ved gjæring gir opphav til såkalt
sulfittsprit. Teknisk sprit tilsettes som regel et stoff som skal gjøre det
udrikkelig. Da kalles den også denaturert sprit. Det kan være pyridin, som er
mye brukt i Norge, røyksyre, benzen, petroleum, terpentin eller kolokvint
(fructus colocynthis).
Men etanol har også
utenomindustriell anvendelse. Etanol som er destillert til konsumpsjonsformål
kalles brennevin. De forskjellige brennevinstypene navngis etter hva som har
vært utgangspunkt for gjæringen. Konjakk og armagnac er druebrennevin. Rom
lages av sukkerrørmelasse. Arak er risbrennevin. Whisky (whiskey hvis den er
irsk) er på basis av korn, oftest rug. Genever og gin er korn- eller
sukkersprit med tilsetning av einerbær. Akevitt er korn- eller potetsprit med
tilsetning av karveolje. Samme type er vodka.
Etanol som inntas av
mennesker forbrennes i leveren, hvor det først oksyderes til acetaldehyd og
deretter videre til acetat. Hydrogenatomene som fjernes fra molekylet går enten
direkte til energiproduksjon eller til å lage fett som lagres til senere bruk.
Noe av det omdanner også pyruvat til laktat, slik at både sukkerforbrenningen
og lagringen av sukker i leveren forstyrres. Stort forbruk av etanol fører til
opphoping av fett i leveren og overbelastning av levercellene slik at det kan
oppså skader. Mer moderat forbruk fører også til endringer i levercellene, som
bl.a. fører til at kapasiteten til å oksydere og nøytralisere en del giftige
eller kreftfremkallende substanser øker. Men enkelte andre substanser blir
farligere ved oksydasjon. Acetatet er et ufarlig biprodukt, men noe av
acetaldehydet slipper også unna den videre oksydasjonen som foregår et annet
sted enn den første, og dette er et reaktivt molekyl som kan skade celler i
leveren og andre steder, og det kan også reagere med visse nevrotransmittere i
hjernen og danne morfinliknende stoffer som starter avhengighetsreaksjoner,
særlig hos personer som har svakheter i acetaldehydmetabolismen.
Når stivelse oppvarmes,
f.eks. ved at man stryker over den med et varmt strykejern, omdannes den til
dekstrin, et gummiaktig stoff som brukes til klebemiddel på etiketter,
frimerker o.l. Legg merke til at det smaker litt søtt når du slikker på
frimerkene.
Cellulose er det ikke
noen kjøttetere som kan fordøye, men den gir tarmen arbeide og avføringen volum
slik at den går mer regelmessig og hindrer at giftige eller kreftfremkallende
stoffer i maten blir liggende på ett sted i tarmen lenge og påvirke den.
Kostholdsmessig utgjør den mesteparten av det som kalles kostfibre i maten.
Ingen mat er totalt fri for giftige eller kreftfremkallende stoffer. Gifter
finnes over alt, i bykjernene og midt ute i skogen. Kroppen har midler til å ta
seg av dem, det som gjelder er bare at det ikke blir for mye av dem for
forsvarsmekanismene våre.
Drøvtyggerne fordøyer
derimot cellulose, og har derved en enorm næringsressurs til rådighet som vi
andre ikke konkurrerer med dem om.
Men også vi bruker
cellulose som tilsetningsstoff i maten, enten i ren, mikrokrystallinsk form
(E460) eller som forskjellige derivater: metylcellulose (E461), etylcellulose
(E462), hydroksypropylmetylcellulose (E464), metyletylcellulose (E465),
natriumkarboksylatmetylcellulose (E466) og etylhydroksyetylcellulose (kode
467). Mikrokrystallinsk cellulose fås av cellulosepulver fra bomull eller
tremasse ved syrebehandling og er utgangspunktet for syntese av de andre
stoffene. De brukes som stabilisatorer og fortykningsmidler, bindemiddel i
tabletter og fyllstoff i fibertilskudd. I sukkertøy brukes de til å forhindre
at sukkeret krystalliserer. I iskrem gir de bedre struktur, hindrer at
krystallene blir for store. I kakeovertrekk med sukker holder de på vannet slik
at de ikke tørker ut. E461 og 464-466 brukes til overflatebehandling av spekede
kjøttprodukter. Finnes i en mengde forskjellige næringsmidler.
Cellulose brukes
forøvrig i store mengder til papirproduksjon. Tørr ved inneholder omtrent 50 %
cellulose, resten, for det meste lignin, hemicellulose, harpiks og voks, kalles
tremasse. Papiret består av cellulose og tremasse, jo mer cellulose det er jo
finere er kvaliteten. Dårlig avispapir kan inneholde 20 %, mens filtrerpapir og
fine papirservietter er ren cellulose. Industrielt brukes for det meste ved til
fremstilling av cellulose, enten det skal brukes som papir eller videreforedles
til andre produkter. To prosesser, sulfitt- og sulfatprosessene, har vært de vanligste
til å fremstille cellulose av ved. Ved sulfittprosessen kokes den oppkuttede
veden med sulfittioner tilsatt i eller en annen form. Sulfittionene danner
vannløselige sulfonsyrer med ligninet og hemicellulosen spaltes av det sure
vannet til glukose som også går i løsning. Kokevæsken tappes av og kan på grunn
av glukoseinnholdet brukes til å lage sulfittsprit, som kan brukes som sådan
eller omdannes videre til andre produkter. Den uløselige cellulosen blir igjen.
For furuved er ikke denne prosessen så praktisk fordi furuharpiksen har en
tendens til å danne uløselige polymerer. Her foretrekkes sulfatprosessen, hvor
den oppflisede veden først kokes med natronlut og natriumsulfid.
Cellulosemassen er her brun, men blekes med klor, hypokloritt eller klordioksyd.
På grunn av faren for osonlaget foretrekkes idag andre blekemetoder.
For å lage papir
tilføres massen ca. 25 ganger sitt volum vann og røres kraftig for å fordele de
uløselige fibrene jevnt. Deretter blir fibrene klemt, knust og oppkuttet i
spesielle maskiner som kalles hollendere, noe som gir sterkere papir. Skal
papiret tåle vann eller blekk tilsettes lim og alun. Farge og fyllstoffer kan
også tilsettes, hvorpå suspensjonen fortynnes ytterligere ca. 8 ganger, siles
og føres ut på papirbanene hvor vannet renner av og et "ark" med ca.
15 % tørrstoffer føres inn i valsene hvor det presses til et tørrstoffinnhold
på 35 % og deretter tørkes i dampoppvarmede sylindre, slik at det bare
inneholder ca. 6 % vann før det rulles opp.
Cellulose kan som
glyserin forestres med salpetersyre til cellulosenitrat eller skytebomull, et
sprengstoff som er for kraftig til å brukes i skytevåpen og meget ømfintlig for
slag og varme, iallfall i tørr tilstand. Men det kan transporteres hvis det
tilsettes 30 % vann. Tørr skytebomull inneholder ideelt 12-14 % nitrogen, men
lavnitrert cellulosenitrat med 10 % N er idag et atskillig viktigere produkt.
Hvis man knar det i sprit og eter og lar væskene fordampe igjen fås et
geléaktig produkt som er lett formbart, men også kan overføres til pulverform,
og i den tilstanden er det hovedbestanddelen av såkalt røyksvakt krutt, som er
svært mye brukt i ammunisjon m.m. Det såkalte Schultz'ke krutt er et gult,
eksplosivt pulver som lages ved nitrering av trestøv eller sagmugg og for en stor
del består av cellulosenitrat.
Cellulosenitrat kan også
gi opphav til kollodium, et stoff som brukes i medisinen, og knadd med kamfer
og alkohol til celluloid, et stoff som først og fremst har vært brukt til
fremvisning av mektig kunst i mørke saler. Dessverre går mange eldre slike
kunstverk tapt fordi celluloiden med tiden delvis får tilbake skytebomullens
egenskaper. Celluloid på nitratbasis ble senere erstattet av celluloseacetat,
forestret med eddiksyre i stedet for salpetersyre. Det er mindre brennbart og
blir heller ikke eksplosjonsfarlig med tiden. Med en viss tilsetning av
propionsyre og smørsyre blir celluloseacetatet mindre vannabsorberende. Med
svovelsyre gir cellulose et geléaktig stoff. Med cellulose i form av limfritt
papir fås ved svovelsyrebehandling et såkalt pergamentpapir som bl.a. brukes
til å gi syltetøykrukker et helt tett overtrekk. Kunstsilke, også kalt rayon
eller cellull, fremstilles av cellulose ved tre forskjellige prosesser, med tre
forskjellige navn på produktet. Viskosesilke er trecellulose behandlet med 18 %
NaOH og karbondisulfid. Når det rødbrune produktet, cellulose-xantogenat,
utsettes for luft blir det seigt og kalles viskose. Det kan trekkes gjennom
dyser til fine tråder. Viskosesilke er mye produsert her i landet. Kobbersilke
og acetatsilke baserer seg på cellulose fra etterlatenskaper etter
bomullsindustrien. Cellulosen behandles enten med et ammoniakat av
kobberhydroksyd, Cu(OH)2.4NH3, eller med
eddiksyreanhydrid, CH3COOCOCH3, til acetatcellulose og
løses i forskjellige midler til en seig væske som kan dras ut til tråder.
Cellulosenitrat og celluloseacetat er estre av cellulose. Men det går også an å
lage etere ved å behandle cellulosen med alkali og deretter et organisk klorid,
f.eks. etylklorid. Slik etylcellulose har mindre vannabsorpsjon enn estrene og
er brukbar til å lage film med. Andre celluloseprodukter er celluloselakk og
cellofan.
Respatex er et
plastlaminat som fremstilles ved varmpressing av papir impregnert med
kunstharpikser, fenolharpiks og melaminharpiks. Platene kan gis en rik
variasjon av teksturer, de tåler varme, slitasje og kjemisk påvirkning godt og
har vært brukt til kledning av kjøkkenbenker, disker, bord, vegger m.m.
Harpiks er et fellesnavn
på forskjellige plantesekreter som er uløselige i vann og løselige i eter
og/eller alkohol. De er gjerne harde og sprø, men blir myke og smelter ved
oppvarming til klebrige væsker som tørker inn til en gjennomsiktig lakk. De
består mest av aromatiske hydrokarboner med noen få oksygenholdige
forbindelser, men ikke noe nitrogen. De brenner med sotende flamme, men motstår
forråtning og angripes lite av kjemikalier. De kan inndeles i esterharpikser,
gummiharpikser og syreharpikser. De to første har vært brukt en del i medisinen
på grunn av innholdet av forskjellige medisinsk aktive terpener, aromatiske
estere, eteriske oljer m.m. Kjente harpiksprodukter eller harpiksholdige
produkter er benzoe, tolubalsam, perubalsam, storaksbalsam og drakeblod
(esterharpikser) og ammoniakkgummi, dyvelsdrek, galbanum, mastiks, myrra og
virak (gummiharpikser). Kolofonium er en harpikssyre som f.eks. kan fremstilles
av furuharpiks ved tørrdestillasjon for å fjerne vann og terpentin. Det består
hovedsakelig av abietinsyre,
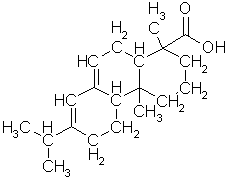
og brukes bl.a. til å smøre hårene til buene av strykeinstrumenter. Ellers
brukes harpiks til mange formål, for det meste til fremstilling av lakk,
ferniss og lim, men syntetiske stoffer, bl.a. kunstharpikser, har overtatt i en
viss grad. Skjellakk produseres av det indiske fikenntreet og noen andre trær
ved stikk av skjoldlus, og har hatt stor anvendelse til lakk, bonevoks og
liknende.
Fra trær kommer også
gummi eller kautsjuk, som i et århundre ga oljen sterk konkurranse om å være
det mest politisk innflytelsesrike råstoffet i verden. Fra melkesaften av
gummitreet, Hevea Brasiliensis kan det tappes ut latex, en grågul, tyntflytende
væske hvor kautsjuken finnes i kolloid suspensjon, som fettdråpene i melk. Som
fettet i melken kan kautsjuken skilles ut ved tilsetning av syre, f.eks.
eddiksyre. Kautsjuken legger seg på toppen og kan skummes av og presses tørr
for saft i valseverk til rågummi.
Gummiproduksjonen
foregår ved at rågummien først mastiseres, d.v.s. myknes ved mekaniske eller
kjemiske metoder for å gjøres bedre bearbeidbar. Så tilsettes den forskjellige
stoffer som sinkoksyd, stearinsyre og organiske akseleratorer for å øke
vulkaniseringshastigheten og bedre de fysikalske egenskapene. Fyllstoffer
tilsettes for å øke hardheten og slitestyrken. Sot er mest effektivt, men
billigere gummityper med lavere kvalitetskrav kan også tilsettes kritt.
Anti-aldringsmidler gir bedre motstandskraft mot varme, lys og luft. Visse
oljer letter den videre behandlingen. Etter tilmiksingen som foregår i
blandemaskiner kommer formeoperasjonene og til slutt vulkaniseringen.
Vulkanisert gummi er
tilsatt svovel for å gjøre den hardere og mer varmebestandig. Metoden ble
uteksperimentert av Charles Goodyear i 1839 og resulterer i at det dannes broer
mellom molekylkjedene i gummien som hindrer bevegeligheten av kjedene i forhold
til hverandre. Goodyears vulkaniserte gummi ble først brukt på vogner, siden på
sykler, men det var bilene som ga Goodyearfamilien virkelig vind i seilene og
pålegg på brødskivene (+litt til). Bilgummi inneholder 1-5 % svovel. Ebonitt er
en helt hard gummi med et svovelinnhold på 40-50 %.
Kautsjuk er et polymert
hydrokarbon, polyisopren (isopren er 2-metyl-1,3-butadien, CH2=C(CH3)-CH=CH2),
et krøllete molekyl med indre spenninger som kan trekkes ut, men går tilbake
til opprinnelig form når den slippes igjen. Dette i tillegg til kautsjukens
slitestyrke og vannavstøtende egenskaper førte til at den raskt etter
oppdagelsen fikk en mengde anvendelsesområder, og gummitreet ble snart innført
i tropiske koloniplantasjer også i andre verdensdeler, særlig Ceylon (Sri
Lanka) og sørøst-Asia. Mektige handelsimperier bygdes på gummiproduksjonen,
noen av de unge søramerikanske republikkene opplevde fantastiske tilstander,
særlig da bilindustrien begynte å ta i bruk gummien til dekkene. I jungelens
dyp vokste det opp byer som skinte av gull og teater- og operascenene lokket
til seg verdensstjerner for drømmehonorarer. Særlig den andre verdenskrigen
førte mye rikdom til gummibaronene. Det var den første helmotoriserte krigen,
og bilgummi ble et nøkkelråstoff. De som ikke hadde tilgang til tropiske
områder fikk problemer. Ennå lever det folk som opplevde trafikken på Murmansk
med svære paller av dekk, som kunne bli redningen i tilfelle torpedering. Men
problemene førte til at det ble lagt hjerner i bløt for å finne løsninger, og
da den gryende polymerindustrien begynte å produserte syntetisk gummi av ting
som etylen, butadien og styren sank gummiimperiene sakte men sikkert bitterlig
i grus. Ufattelige tragedier utspilte seg, lianene og papegøyeflokkene inntok
bygatene. Snart våget bare eventyrlystne turister seg inn for å bese ruinene av
gummifyrstenes palasser.
Guttaperka og balata
utvinnes også av plantesaft fra tropiske trær. De kan ikke vulkaniseres og
brukes bare i naturtilstanden.
Syntetisk gummi var den
første plasten som ble produsert i større mengder. Natriumkatalysert
polybutadien (Buna) ble produsert i Tyskland under 1. verdenskrig da den
britiske sjøfartsblokaden hindret innførsel av naturgummi, men var dårlig
sammenliknet med den naturlige gummien. Under de fornyede krigsforberedelsene i
30-årene kom de et skritt videre da de fant på å polymerisere butadien og
styren. Denne kunstgummien som de kalte Buna S, hadde langt bedre egenskaper,
men ble ikke produsert i virkelig stor målestokk før amerikanerne fikk knapphet
på naturgummi under krigen. Senere har nye kunstige gummityper som nitrilgummi,
butylgummi og neopren overtatt en god del av markedet. Nitrilgummi er en
kopolymer av butadien og akrylnitril som er motstandsdyktig mot olje og mange
oppløsningsmidler og brukes i mange tekniske gummivarer. Butylgummi er et
kopolymerisat av isobutylen med litt isopren og har stor motstandskrat mot
oksydasjon. Neopren er polymerisert 2-klorbutadien (isopren er 2-metylbutadien)
og som andre klorforbindelser betydelig mer motstandsdyktig mot vær og vind og
olje. Andre varianter er silikongummi, tiokoll, hypalon.
Gummiens elastisitet,
slitestyrke, isolasjonsevne og luft- og vanntetthet gjør den uunnværlig på en
rekke områder, ikke minst i bilindustrien, hvor den ikke bare brukes til dekk,
men også vindusviskere, skvettlapper, slanger etc. Støvler, strikker, valser,
propper, pakninger, bordbein-"hæler" og isolasjonsmateriale er
eksempler på andre bruksområder. Skumgummi lages av oppisket latex, men
skumgummi og mange andre gummiprodukter er idag erstattet eller på vei til å
bli erstattet av plastprodukter eller andre materialer.
Krigens
hjernebløtlegging fikk fart på polymerindustrien. Allerede før krigen var slutt
hadde kunstfibre skaffet bransjen en ny markedssuksess, og kunstig ettergjøring
av naturlige tekstilprodukter som silke, bomull og ull kastet nye masser ut i
arbeidsløshetens elendighet og omkalfatret næringsstrukturen i store områder,
for eksempel i de amerikanske sørstatene, hvor bomullen ble produsert og i det
engelske Lancashire - Liverpool-Manchesterområdet, hvor den ved hjelp av den
tilgjengelige kull-energien og nærheten til atlanterhavshavnen Liverpool ble
forarbeidet. Tekstilindustrien i Lancashire tiltrakk enorme folkemengder før
århundreskiftet, og den engelske fotball-ligaen, som ble stiftet i 1888, hadde
12 medlemmer og av dem var Everton fra Liverpool, Bolton, Burnley, Preston,
Blackburn og Accrington Stanley, dvs. halvparten fra dette området. Fra før
romertiden hadde befolkningskonsentrasjonen i Britannia vært rundt sørkysten.
Lancashire-perioden var et avvik. Nå begynte det å normalisere seg igjen, også
fordi kullene begynte å få mindre betydning. Å vandre mellom de forlatte
mursteinsbygningene i de mindre Lancashire-byene gir et innblikk i en utrolig betydningsfull
industriell epoke.
Den nye plastindustrien
gikk med iver og gulltørst inn for å polymerisere alt de fikk lagt de klamme
hendene sine på. Det første kunstige polymerproduktet var bakelitt, fremstilt
første gang av amerikaneren Baekeland i 1909 ved å la en syrekatalysert
blanding av formaldehyd og fenol under trykk og oppvarming reagere og danne
kjeder. Bakelitten ble brukt en god del i stedet for porselen som isolerende
konstruksjonsmateriale i elektriske installasjoner og ledningsoppheng, brytere,
kontakter, støpsler og andre isolerende produkter, drikkebegere, askebegere.
Bakelitten og andre kunststoffer som lages av fenol er mørke i fargen.
Karbamid- og melaminplaster fås ved kondensasjon av formaldehyd og urinstoff
eller melamin. Produktet er fargeløst og gjennomsiktig og kan farges etter
forgodtbefinnende. Epoksyharpiksene inneholder ringer med oksygen i ringkjeden
og brukes til lim, støpematerialer etc. Alkydharpikser er
kondensasjonsprodukter mellom flerverdige syrer og alkoholer. Ofte er
utgangspunktet ftalsyreanhydrid og glyserol. De brukes særlig i lakk
(alkydlakk). Allylalkoholens estere med toverdige organiske syrer gir en
polymer som brukes til impregnering av papir og tekstiler. Med toverdige
alkoholer og karboksylsyrer med to syregrupper (dikarboksylsyrer) kan det lages
lange kjeder ved hjelp av esterifisering, såkalt polyester. Mettede polyestere
har lineære molekyler og blir termoplastiske og løselige i visse
løsningsmidler. Umettede polyestere kan polymeriseres videre med andre tilsetninger
og kan få tverrforbindelser mellom de lineære kjedene. Umettede polyestere
lages av etylenglykol, propylenglykol, butylenglykol eller en blanding av disse
samt aromatiske syrer som ftalsyre og maleinsyre. Adipinsyre og sebacinsyre er
tilsetninger som gi større fri dreibarhet innen molekylgruppene og dermed
høyere elastisitet. Brukes til båter, plater, karosserideler, tanker, kar,
stolseter, pontonger og rør. Mettede polyestere kan produseres med
para-ftalsyre og en glykol og brukes i tekstilfibre som dacron (para-ftalsyre
og etylenglykol), terylen etc. Med dietylenglykol og adipinsyre fås skumplast.
Andre polyestertyper kan benyttes som sekundære myknere for polyvinylklorid.
Polyamider kan lages ved
oppvarming av toverdige aminer og toverdige syrer, på samme måte som
polyestrene med syrer og alkoholer. Nylon er sammensatt av 1,6-heksandiamin, H2N(CH2)6NH2,
og adipinsyre, HOOC(CH2)4COOH. Hvis det inngår noen
treverdige syrer, alkoholer eller aminer i den blandingen som oppvarmes dannes
nettverkspolymerer som er harde og seige og som hverken vil smelte eller løse
seg opp i noen oppløsningsmidler. Slike stoffer kalles termoplaster og omfatter
også andre nettverkspolymerer slik som bakelitt og karbamid- og melaminplaster.
Lim lages tradisjonelt
ved å koke ut klebrige proteiner fra fettfrie knokler, hud og horn i vann under
trykk. Gelatin er det reneste animalske limet. Det lages ved å hydrolysere
kollagenet i bein med høyt kollageninnhold, f.eks. ribbein. Fiskelim fås ved å
koke fiskeskinn, svømmeblærer, fiskebein og annet fiskeavfall. Kaseinlim fås av
kasein fra melk. Stivelsesklister lages ved å varme opp stivelse eller mel i
vann til 80-100 °C, og har før vært mye brukt til klebing av papir, tapet o.l.
Dekstrinlim fås av polysakkaridet dekstrin, samt eddiksyre og alkohol og brukes
mye på frimerker og konvolutter. Gummilim fås ved å løse kautsjuk i organiske
løsningsmidler og er velegnet for liming av gummi.
Syntetisk lim finnes i
mange typer. Varmtklebende lim kan bestå av kunstharpikser som smelter og
kleber ved oppvarming. Varmtherdende lim er polymerer, ofte kunstharpikser, som
herdes ved å danne tverrforbindelser mellom kjedene ved oppvarming.
Kaldtherdende lim kommer ofte som to komponenter som skal blandes, polymerdelen
er ofte epoksyforbindelser eller umettede estre og herderen er en katalysater
som danner tverrforbindelser i polymeren. Løsningsmiddellim er polymerer løst i
organiske løsningsmidler og herdes når løsningsmidlet fordamper.
"Selvklebende" lim er klebrige polymerer som ikke herder. Limtre er
limt tremasse, spon eller sammenlimte småbiter av tre som kan brukes i store
konstruksjoner og kan ha større styrke og smidighet enn enkeltstykker av tre.
En naturlig polymer som
lenge har vært brukt er ostestoffet kasein, som finnes i melk. Kaseinet blandes
med farge, alun og vann, knas til en deig og støpes til knapper, spenner,
kammer, knivskaft etc. Finner du klær utenom det aller fineste slaget fra før
krigen kan du være ganske sikker på at knappene og spennene er laget av dette
materialet som kalles galalitt eller kunsthorn.
En annen naturlig
polymer er cellulose, et utgangsstoff for mange produkter, som nevnt.
Akrylatene, polymetylmetakrylat eller pleksiglass. Uknuselige, splintsikre
glass, som tidlig ble tatt i bruk i flyindustrien. Andre produkter er lakk og
plastmaling. Akrylater kan lede lys, også i krumme staver. Polystyren er
polymerisert styren, C6H5CH=CH2, som kan lages
av benzen og etylen eller benzen og etanol. Det har utmerkede elektrisk
isolerende egenskaper, og er et vannklart materiale. Polyvinylklorid lages av
acetylen og saltsyre, polyvinylacetat av acetylen og eddiksyre, ved hydrolyse
til polyvinylalkohol som ved reaksjon med aldehyder gir polyvinylacetaler,
bl.a. polyvinylbutyral, anv. til plastmaling. Med myknere blir klorid og acetat
gummiaktig, brukes til vanntette folier for regnkapper etc. PVC er et viktig
konstruksjonsmateriale, brukes til rør o.l. i kjemisk industri, motstår syrer
og baser. Polyetylen er meget bestandig mot kjemiske angrep og har utmerkede
elektrisk isolerende egenskaper, det spilte en viktig rolle for utviklingen av
radarteknikken. Polytetrafluoretylen eller teflon motstår kokende kongevann,
det angripes bare av smeltede alkalier. Silikonplaster består av kjeder av
silisium og oksygen forgrenet med organiske sidegrener. Konsistensen kan være
alt fra gummiliknende til vaselinaktige masser av oljer for smøreformål. Er
spesielt nyttig som smøremiddel i høyere luftlag p.g.a. mindre
temperaturavhengighet. Også brukt i lakk og formstykker.
Mange dyr får alt sitt
protein-, fett- og karbohydratbehov dekket av planteføde. Slik er det ikke med
menneskene. Vi står i en mellomstilling mellom de typiske planteeterne og de
typiske rovdyrene. Karbohydratene får vi mest fra plantene, men de to andre
skaffer vi oss mest fra dyreverdenen. Også fordøyelsesorganene våre gjenspeiler
dette. Vi har en kort blindtarm slik som rovdyrene og en lang tynntarm slik som
planteeterne, men heller ikke den er på langt nær så lang som hos de mest
typiske planteeterne. Mange apearters kosthold likner mye på vårt. De klatrer i
trærne og skaffer seg frukt og annet vegetabilsk fôr, men unnser seg heller
ikke for å innta animalsk føde når det byr seg anledning, for det meste i form
av smådyr, insekter og åtsler. Slik har nok også urmenneskenes kost vært i
lange tider. Det var ikke før vi begynte å utvikle våpen at vi ble effektive
jegere. Mange åtseletere har mistet mye av hår- og fjærbekledningen sin,
sannsynligvis fordi det er lettere å holde en hårløs hus ren og dermed beskytte
seg mot infeksjoner, og dette kan nok være en forklaring på apenes hårløse
hender og vår egen tilstand. (En alternativ forklaring er vår nære tilknytning
til havet. Det at spedbarn instinktivt svømmer og det faktum at de fleste
menneskesamfunn oppstår ved kystene har fått noen til å gjette at vi har en
periode som havdyr i vår fortid og derfor er hårløse slik som hvalene.)
Fett finnes det rikelig
av i alle dyr, siden det er den viktigste opplagsnæringen til dyrere. Men det
er også rikelig med fett i mange planter, særlig i frukter og frø. Plantene
produserer lett sukker på grunn av fotosyntesen, derfor bruker de stivelse som
opplagsenergi, men fettet har fortsatt den fordelen at det er mer
energikonsentrert enn sukkeret. Olivenfrukter og soyabønner har spesielt høyt fettinnhold
og brukes mye til matlaging, særlig i form av oljer som er mye brukt til
stekeolje. Linfrø avgir en fet olje med lav metningsgrad som størkner i luft
p.g.a. oksydering, og har derfor et vidt anvendelsesområde i malingindustrien
og også en viss betydning som kosttilskudd. Andre mye brukte planteoljer er
sagoolje, bomullsfrøoljer, sesamolje, jordnøttolje, palmeolje, palmekjerneolje
og kokosolje (kopra).
Plantefett utvinnes ofte
ved pressing, men hvis fettinnholdet ikke er så rikelig brukes ekstraksjon med
flyktige upolare løsningsmidler som bensin, trikloretylen e.l., som siden
fjernes fra fettet ved fordamping. Restene etter utvinningen er høyt
ettertraktet som kraftfôr p.g.a. den høye næringsverdien.
Alle pattedyrs melk har
et meget høyt fettinnhold, og melkeprodukter og melk fra ku, geit, sau, kamel,
hest m.m. er blant de viktigste næringsmidlene i alle kulturer på planeten.
Dyrefett fra slakt brukes til mat i mange forskjellige tilberedningsformer,
enten sammen med kjøttet eller atskilt fra det. Men det har også atskillige
andre bruksområder.
Fett eller olje fra dyr
eller planter kan kokes med lut til såper. Slik såpekoking spalter fettet til
glyserol og alkalisalter av fettsyrene (alkalisåper). Tradisjonell
såpefremstilling skjer i flere trinn. Etter utsmelting, og eventuelt bleking og
filtrering av fettråstoffene kokes fettet sammen med lut i en åpen kjele. Det
danner seg et såpelim, en gjennomsiktig, seig masse. Med kalilut og flytende
fett blir såpelimet salveaktig og forhandles som grønnsåpe. Med faste fettarter
og natronlut blir limsåpen stiv. Slik limsåpe forhandles ikke idag, men
gjennomgår utsalting, d.v.s. det smeltede såpelimet tilsettes alkalioverskudd i
form av salt, slik at såpene, d.v.s. fettsyresaltene av natrium felles ut av
løsningen og flyter opp som en kornet masse som kalles kjernen, mens
saltoverskuddet og en del forurensninger blir igjen i den såkalte underluten.
Kjernesåpe er derfor renere såpe enn limsåpen, og utsalting kan gjerne gjøres
flere ganger for å få den enda renere. Til slutt tilsettes eventuelt parfyme og
andre tilsetningsstoffer. Såpepulver gjennomgår til slutt forstøving for å
komme i pulverform. Flytende vaskemidler kan fås ved å løse såpe i mer eller
mindre vann. Men syntetiske vaskemidler har erstattet såper i noen grad idag.
De er bygd opp etter samme prinsipp med langstrakte molekyler med en polar og
en upolar ende, men COOH-enheten i den polare enden er erstattet med en annen
polar gruppe for å forhindre kalkutfelling når vannet er hardt. De første
suksessfulle syntetiske vaskemidlene var alkoholsulfatene, hvor et
svovelsyremolekyl var hektet på et langstrakt alkohol ved vannavspalting og
nøytralisert med lut, f.eks. CH3-CH2-...-CH2-O-SO2-ONa.
Mer vanlig idag er alkylarylsulfonatene, hvor kjernen er en benzenring som er
substituert med en langstrakt hydrokarbonrest på den ene enden og sulfonsyre,
d.v.s. en svovelsyreenhet hvor svovelatomet sitter direkte på karbonet, på den
andre, eksempelvis CH3-CH2-...-CH2-C6H4-SO2-ONa.
Mange kjente flytende vaskemidler, f.eks. Zalo er av denne typen. Pulvere er
også ofte syntetiske, da med litt lengre kjeder.
Glyserolen fra slike
spaltingsprosesser kan forestres med salpetersyre til "nitroglyserin"
(glyseroltrinitrat), et kraftig sprengstoff som har stor anvendelse i dynamitt.
Glyserol kan også fås ved gjæring av sukker, og en ser typisk at det blir
knapphet på slike varer som fett og sukker under krig.
Olje og fett i mange
former kan brenne og har vært brukt og brukes til belysning i mange land. Talg
er fett fra drøvtyggere og var tidligere mye brukt til lys (talglys) og siden
til margarinfremstilling. Det er fortsatt et av de vanligste utgangsproduktene
for fremstilling av stearin- og palmitinsyre til stearinlys. Talgen kokes med
20-40 % vann tilsatt et emulgeringsmiddel (Twitschelreagens) for å øke
blandbarheten, i 1-2 døgn for å spalte fettet. Glyserolen samler seg i et
vannlag som tappes fra. Etter utpressing av oljesyre og andre flytende
fettsyrer kan produktet som vesentlig består av palmitinsyre og stearinsyre,
støpes til lys. Oftest tilsettes et par prosent parafin.
Spekk er det faste
fettlaget mellom huden og kjøttet på griser, isbjørn og flere havdyr som hval,
sel m.m. Både spekk og tran, som er fiskefett, fortrinnsvis fremstilt ved
koking av torskelever (men også fra sei, hyse, lange, brosme o.a. magre
fiskeslag), har vært brukt i lamper mange steder. Tran brukes idag mye som
kostholdstilskudd p.g.a. det høye innholdet av fettløselige vitaminer og
flerumettede fettsyrer, men bruken begrenses mye av smaken. Ellers brukes den
til garving og lærimpregnering, malingsoljer m.m. Fete fiskeslag som sild,
makrell og lodde gir (mer eller mindre frivillig) oljer med meget lav
metningsgrad, fettsyrer som har opptil 6 dobbeltbindinger, og har derfor stor
betydning i kostholdet, men brukes også til veterinærtran og såpefabrikasjon.
De har også vært hydrogenert for å gjøre dem mettede og i den tilstand
("herdet fett") brukt til margarinproduksjon.
Fett harskner hvis det
blir stående, en prosess som foregår på flere forskjellige plan. Dels skyldes
den luftoksydasjon, som forsterkes kraftig av lysets katalytiske virkning.
Særlig flerumettede fettsyrer er utsatt for dette, de spaltes i
dobbeltbindingene og oksyderes til frie aldehyder og fettsyrer. Linoljebasert
maling og lakk størkner på grunn av slik harskning. Rå linolje tørker på 10
dager og blir derfor kokt og tilsatt harskningstilskyndende metallsalter med
katalytisk virkning før den kan brukes til malingbase.
Enzymer som kalles
lipaser kan spalte fett i frie fettsyrer og glyserol enten fordi de har fulgt
med fra dyre- eller plantevevet i utvinnngsfasen eller fordi de brukes av
mikroorganismer som f.eks. muggsopper, som også klarer å omdanne fett til
ketoner. Muggsoppene trenger vann og går bare på fettholdige varer som har et
visst vanninnhold. Fettherding ved hydrogenering slik at de umettede fettsyrene
får høyere metningsgrad har vært en utbredt måte å sinke harskning på. Høyere
metningsgrad gir større motstandskraft mot oksydasjon. Årsaken til den dårlige
aromaen til harskt smør og annet fett er de frie fettsyrene og dels ketoner.
Herding skjer med nikkelkatalysator ved 120-190° C og 6 atm. hydrogentrykk.
Prosessen stanses når fettet har fått smeltepunktet i det ønskede området. For
margarinproduksjon vil det oftest være 1-2 dobbeltbindinger igjen på
fettsyrekjedene.
Begrepet olje utdypes
tradisjonelt ved å dele det i vanlige og eteriske oljer. Alle oljer lager
flekker på papir, men de eteriske er flyktige nok til at de fordamper fra
papiret ved oppvarming. De andre lager varige flekker, som ikke kan fjernes ved
oppvarming uten å ødelegge papiret. Men ingen av disse eteriske oljene er
glyserider og har derfor ikke noe kjemisk slektskap med de andre oljene. De kan
ha høyst forskjellig kjemisk sammensetning, men mange av dem tilhører
terpenene. Som regel har de viktige aromamessige egenskaper. Viktige eteriske
oljer er kamfer (som er fast ved romtemperatur), rosenolje, karveolje,
sennepsolje, einerbærolje, peppermynteolje, terpentin, kanelolje o.s.v. De
fremstilles av blomster, frukter, ved eller bark enten ved destillasjon med
vann eller ved ekstraksjon med fett eller alkohol.
Hud som ikke garves til
lær vil råtne eller tørke inn og stivne, og løser seg opp i varmt vann og går
over til lim. Den består for det meste av proteinene kollagen, elastin og
keratin, og brukes til en rekke produkter etter en garveprosess hvor
forskjellige garvestoffer forbinder seg med kollagenet til den egentlige
lærsubstansen. Først legges huden i vann for å løse salt eller bløte opp huden hvis
den er tørket. Så kalkes huden for å svelle opp keratinet og løsne hår og
skille over- og underhuden fra hverandre. Hudene legges lagvis i kalkløsning,
gjerne tilsatt natriumsulfid som avhåringsmiddel. Etter kalkingen følger
skaving hvor hår, underhud og evt. kjøtt skrapes vekk. Avfallet brukes til
limproduksjon. Deretter fjernes kalken ved å vaske huden i haspler eller valker
med vann og en svak syre, f.eks. melkesyre. Huden beises så med et
enzympreparat (pankeratin), som inneholder proteinspaltende enzymer som trypsin
og også fettspaltende enzymer. Disse bryter ned elastinet og fettet slik at det
nesten bare er kollagen igjen, som samtidig sveller, slik at det reagerer
lettere med garvestoffene. I stedet for enzympreparatet ble det før brukt
ekstrakt av hunde- eller hønsegjødsel eller liknende.
Deretter følger selve
garvingen. Lo- eller rødgarving, vegetabilsk garving, gjøres ved å legge huden
i 'valker' i en løsning av garvestoffer som gradvis gjøres sterkere. Tidligere
bruktes opphugget bark. I dag brukes garvestoffer som er utvunnet av bark og
andre vegetabilske råvarer eller syntetiske alternativer. De består gjerne
estre eller glukosider av aromatiske syrer eller fenoler eller forskjellige mer
eller mindre kompliserte fenolkondensater. Mineralgarving gjøres med
forskjellige mineralsalter. Vanlig er kromgarving med krom(III)-salter eller
kromater som garvestoff. Kromgarving krever at huden først behandling med en
mineralsyre og salt for å surgjøre huden (pickling). Den gir gjerne en grønn
lærfarge. Til hvitgarving, ofte for pelsverk eller hansker, brukes alun, gjerne
en kombinasjon av krom- og aluminiumsalun. Semsking eller oljegarving gjøres
gjerne med tran som garvestoff og luftoksydasjon. Andre garveprosesser bruker
formalin, kinon eller lignin. Kombinasjonsgarving er ikke sjeldent, særlig
kombineres ofte rød- og kromgarving, for å kombinere styrken av det kromgarvede
læret med fyldigheten av det rødgarvede. Et ferdig garvet lær kan inneholde
40-60 % garvestoff.
Etter garvingen blir
læret fettet for at det skal holde seg smidig, og farget, gjerne mens det ennå
ligger i valkene. Deretter blir det tørket (spiling), myket opp (stolling) og
ferdigbehandles med falsing, sliping, spaltning, lakkering o.l.
Siden tidlig i
middelalderen har man også brukt garvestoffer til å lage blekk. Gallussyre kan
utvinnes av gallepler og danner fargeløse jern(II)gallater som oksyderes til
svarte jern(III)gallater når de strykes ned på papiret og utsettes for luft.
Det ble gjerne tilsatt et fargestoff for at skriften skulle være synlig mens
man skrev også, og litt fri syre for å hemme oksydasjonen. Nyere blekk
inneholder også gummi eller glyserol for at utfelt jern(III)gallat ikke skal
synke, og salicylsyre eller fenol mot mugg.
En gang i urtiden kom en
hårete villmann løpende hjem med en glo. Siden det har mennesker titt og ofte
tatt i bruk karbonholdig materie til å skaffe lys og varme. Ved var nok det
første man brente, men senere avanserte man til trekull, steinkull, koks og
olje. Det flammet opp bål, ord ble utvekslet og viser sunget utover kveldene og
man kunne anvende nettene. Man bygde seg lamper og ovner. Med ild ble mørkere
og kaldere deler av verden befolket.
Varmen som kan fås av 1
kg bjerkeved utgjør 15100 kJ. Til sammenlikning gir 1 kg gran- eller furuved
15500 kJ, 1 kg torv 14000 kJ, 1 kg trekull 26400 kJ, 1 kg koks 26800 kJ, 1 kg
steinkull 28000 kJ, 1 kg antrasitt 32600 kJ og 1 kg olje 42000 kJ ved
fullstendig forbrenning. Legg merke til at bjerkeveden gir mindre varme pr. kg
enn bartreveden. Hvis man regner volum blir det et annet forhold, siden
bjerkeveden er mye mer kompakt. 1 kubikkmeter granved gir 5270000 kJ mens samme
volum furuved gir 5480000 kJ, oreved 4940000 kJ og bjerkeved 6490000 kJ.
Furuved er billigere enn bjerkeved, men hvis det ikke er billigere enn 84 % av
bjerkevedprisen kjøper du det altså ikke. Liknende regnestykker kan du bruke på
de andre alternativene. 1 liter fyringsolje veier ca. 700 gram. Elektisk fyring
må også tas med i beregningen, og her kan du regne at 1 watt = 1 joule/sek.
Hvis du har en varmeovn stående på 1000 watt i 10 timer (10 kWh) har du altså
forbrukt 36000 kJ. I bjerkeved tilsvarer det i prinsippet 2,4 kg. Ikke mye, men
baserer du deg på forbrenningsvarme må du alltid regne med et effekttap p.g.a.
den varmen som forsvinner med avgassene. Moderne fyringsovner er alltid forsynt
med kanaler som røyken skal sive gjennom for å avgi varme før den forsvinner ut
i kulda. Det er opp til den som passer ilden å regulere trekken ned slik at
røyken ikke går for fort gjennom disse kanalene, men det må alltid være nok
trekk til å gjøre forbrenningen fullstendig. Uforbrent sot er bortkastede
fyringsutgifter og legger seg dessuten i kanalene som et varmeisolerende belegg
som hindrer varmen i å overføres til rommet. Sørg alltid for å få feid kanalene
og innsiden av ovnen.
Forkoksing er en slags
forkulling av kull, eller tørrdestillasjon ved å varme opp kullene til
1000-1300° C uten lufttilgang. Anleggene dette skjer i kalles koksverk eller
også gassverk p.g.a. biproduktene. Ved forkoksingen av kull (som nevnt før kan
også en del andre utgangsmaterialer benyttes) blir ca. 65 % av kullet overført
til koks, som er forholdsvis rent karbon. Men også resten har vidstrakt
utnyttelse. 29 % tas ut som lysgass, for det meste lette hydrokarboner, samt
ammoniakk, som vaskes ut. De gjenværende 6 % er steinkulltjære, som gir opphav
til en rekke nyttige produkter ved destillasjon. Det har vært vanlig å dele
produktene i følgende fraksjoner etter første grov-destillering: Lettolje som
koker under 170° C gir produkter som toluen, xylen, benzen, nafta og pyridin
ved ytterligere fraksjonering. Den brukes også ufraksjonert som
bestrykningsmidler som Black Varnish, jernlakk o.l. Mellomolje som koker mellom
170 og 230° C inneholder naftalen og fenol. Fjernes naftalenet fås såkalt
karbolineum, et fenolrikt impregneringsmiddel for tre. Tungolje koker mellom
230 og 280° C, kalles også kreosotolje. Den inneholder også naftalen og
dessuten kreosoter som er stormolekylære fenoler, og er mye brukt til
impregnering, tjærepapp, sprøyting av veidekke o.l. Antracenolje som koker fra
280 til 400° C inneholder vesentligst antracen, utgangspunkt for en rekke
fargestoffer, samt en del andre hydrokarboner og nitrogenholdige forbindelser
med samme bruk. Den udestillerte resten, bek, brukes i asfalt til veidekke, til
impregnering av takpapp, brikettering av kull, fremstilling av elektrodemasser
til metallurgiske prosesser. Den brukes også mye til tetning av trebåter og
-skuter.
Lavtemperaturforkoksing
ved rundt 500° C gir en lavtemperaturtjære som inneholder helt andre produkter
med mye høyere hydrogeninnhold enn høytemperaturtjæren. Det er få aromatiske
bestanddeler, men mange mettede, alifatiske, kjedeformede hydrokarboner og
mange mettede sykliske, ringformede av typen sykloheksan, slik at den likner
jordolje. Det er en stor del fenoler også. Forholdsvis nydannede kull med
lavere karboninnhold, som svalbardkullene, er best egnet for denne behandlingen.
Krutt består av
salpeter, svovel og kull. Forbrenning med salpeter som oksygenkilde var kjent
av kineserne allerede ved vår tidsregnings begynnelse. Araberne omtalte
salpeter som "kinesisk salt" eller "kinesisk snø". På
600-tallet tok det bysantinske riket i bruk en blanding av de tre ovennevnte
ingrediensene til å tenne fyr på tyrkiske skip under et angrep på
Konstantinopel. Oppfinnelsen var kjent som "gresk ild" og det ble
sagt at det var umulig å slukke en brann antent av den. Oppskriften ble bevart
i dypeste hemmelighet i flere århundrer. Først på 1300-tallet kom araberne fram
til en eksplosiv blanding av de tre bestanddelene (3/4 salpeter, 1/9 svovel og
5/36 trekull), som vi kjenner som krutt, et ord av samme opprinnelse som
krydder. Men araberne holdt ikke like godt på hemmeligheten, og allerede i 1339
ble oppfinnelsen tatt i bruk i Europa under forsvaret av den tyske (idag
franske) byen Cambrai, i begynnelsen av hundreårskrigene. Artilleriet (et
provencalsk ord - 'det som hører til festningsverket') var født. Mye har blitt
sprengt vekk fra jordens overflate siden det. Mange tonn fjell. Mangfoldige
millioner liv. Kruttet har gått til himmels, etterlatt seg lysende striper og
gått av med smell som har spredt knatrende fargeblomster over den mørke
himmelen. Imens har grå, eimende røyk drevet i dalene.
Svartkrutt ble sent på
1800-tallet avløst av røyksvakt krutt og senere enda mer moderne eksplosiver
til militære og sprengningstekniske formål, men brukes fremdeles i fyrverkeri
og i visse leker for barn. "Kruttlapper" inneholder imidlertid ikke
krutt, men bl.a. fosfor (s.d.)
Olje er det svarte gull,
en kilde til umåtelig rikdom for de som finner den, og den har gått det gule
gullet en høy gang når det gjelder storpolitisk betydning. Kriger har blitt
utkjempet for den, senest på nittennittitallet, og selv om ikke oljen har vært det
direkte målet for krigføringen, har oljerike områder som Baku i Azerbajdsjan,
Ploesti i Romania og ikke minst Persiagulfen vært mer etterstrebet enn det
meste i de store konfliktene i dette århundret. Ja, når et lite samfunn
oppdager olje på sitt territorium kan det få omfattende konsekvenser, ikke bare
av positiv art. Årsaken er selvsagt at oljen i motsetning til det gule gullet,
som kan brukes til litt mer enn pynt, kan brukes til mye mer enn pynt.
Den råoljen som pumpes
ut av jorden består for en stor del av mettede hydrokarboner, med et varierende
innslag av umettede hydrokarboner, organiske syrer, svovelforbindelser m.m. Den
fraksjoneres som steinkulltjæren til forskjellige produkter ved destillasjon,
for eksempel i et tårn hvor oljedampene stiger oppover mens de kjøles ned
underveis og fortettes til de forskjellige fraksjonene på forskjellige steder i
tårnet og oppsamles der. Noe av gassen passerer hele tårnet uten å fortettes,
men passerer så et kjøleanlegg hvor noe av den fortettes til petroleterfraksjonen,
hydrokarboner med kokepunkt under 70° C, heksan og lavere. Resten fortsetter og
samles opp som gassfraksjonen. Øverst i tårnet samles bensinfraksjonen med
kokepunkt under 150° C. Den består for det meste av hydrokarboner fra heptan
(med 7 karbonatomer) til dekan (med 10), og brukes som drivmiddel til en del
kjøretøyer og som løsnings-, ekstraksjons- og rensemiddel. Den neste fraksjonen
er petroleums- eller kerosinfraksjonen som koker under 280° C og består
vesentlig av dekan til heksadekan (16). Deretter kommer gassoljefraksjonen med
kokepunkt under 350° C og pentadekan (15) til dokosan (22), så smøreolje- eller
tungoljefraksjonen med enda høyere kokepunkter og hydrokarbonlengder fra
nonadekan (19) til pentatriakontan (35). Nederst i tårnet tappes det ut
vaselin, parafinvoks o.l., mens den resten som er igjen i kjelen etter kokingen
tappes ut som bitumen.
Etter denne
grovdestilleringen blir så de forskjellige fraksjonene raffinert ved
ytterligere destillasjon under redusert trykk til forskjellige produkter.
Bensinfraksjonen deles opp i lettbensin, flybensin, motorbensin og white spirit
med de første som de flyktigste. Petroleumsfraksjonen på samme måte i petroleum
og solarolje. Gassolje i dieselolje og fyringsolje og smøreoljefraksjonen i
transformatorolje, spindelolje, maskinolje og gearolje.
Petroleter brukes som
ekstraksjonsmiddel i gummi- og fettindustrien.
Den bensinen som kommer
i handelen består for det meste av en blanding mettede hydrokarboner fra heksan
til nonan med vekt på de letteste for lettbensinen og de tyngre for de andre.
Slike hydrokarboner kan enten fås direkte fra råoljedestillasjonen (straight
run-bensin) eller ved kjemisk behandling av de andre hydrokarbonfraksjonene.
Ved cracking utsettes de langkjedede hydrokarbonene med 15, 16 C e.l. for
kraftig opphetning under høyt trykk slik at de spaltes til ønsket lengde, mens
ved casinghead-produksjon utsettes de lettere hydrokarbonene for meget høyt
trykk, men lav temperatur i nærvær av en katalysator slik at de kobles sammen
til ønsket lengde. En del lette umettede hydrokarboner (etylen, propylen...)
som er biprodukter av crackingen brukes som råmaterialer i industriell kjemisk
syntese.
En viktig kvalitet ved
bensinen er oktantallet, et mål på i hvilken grad det unngås
"banking", d.v.s. ukontrollerte eksplosjoner i motoren som er svært
skadelig både for konstruksjonen og ytelsen. Ytelsen av en forgassermotor
stiger normalt med kompresjonsforholdet, d.v.s. hvor mye volumet i sylinderen
komprimeres når stempelet beveger seg mellom ytterposisjonene. Et
kompresjonsforhold på minst 7/1 må kreves for moderne bilmotorer og det er
langt mer enn den ubehandlede bensinen presterer uten banking. Ved fastsettelse
av oktantallet går man ut fra en skala hvor bankeegenskapene sammenliknes med
de til n-heptan, som settes til 0, og 2,2,4-trimetylpentan, en isomer av oktan,
som settes til 100. Generelt brenner forgrenede hydrokarboner ganske jevnt og
rolig mens de rettkjedede brenner mer eksplosivt. Å lage drivstoff av ren
isooktan ville regnes for å være for dyrt, og derfor har man vanligvis bedret
oktantallet ved forskjellige tilsetninger, bl.a. etanol og metanol. Det uhyre
giftige tetraetylbly viste seg å kunne kontrollere forbrenningen med en høy
grad av effektivitet og var populært lenge, men betenkeligheter med å slippe
denne giften rett ut i atmosfæren har omsider ført til at denne er i ferd med å
gå av bruk. Jernpentakarbonyl var et alternativ en tid. Jo større ytelse en
bilmotor har og jo større kompresjonsforhold den stiller med, jo høyere oktantall
kreves det på bensinen, og for billøpsmotorer, som opererer med
kompresjonsforhold på 12/1 og mer, blir all bensin for spedt. De kjører
vanligvis på metanol, som har et oktantall på 140. "Lettbentyl" som
bruktes mye som drivstoff i Sverige under og etter krigen besto av bensin med
25 % etanol.
Ligroin er hydrokarboner
med kokepunkt 100-180° C, heptan (med 7 C) til dekan (med 10) for det meste, og
brukes i store mengder som løsemiddel for "oljebasert" lakk og
ferniss.
Lysolje, med kokepunkt
150-300° C, nonan (med 9 C) til heptadekan (med 17), brukes i lysoljer og
fremfor alt til drivstoff for dieselmotorer. Det er viktig at den ikke
inneholder noen lettere og mer lettantennelig bestanddel enn nonan.
Petroleum brukes idag
mye til flybensin.
Smøreolje er et
mangfoldig kapittel. En uendelighet av forskjellige produkter er på markedet,
med de utroligste komposisjoner, blandinger av oljefraksjoner, fett, animalske
og vegetabilske oljer, fettsyrer, midler mot oksydasjon og rust o.s.v. Men som
regel er de laget på basis av jordolje, for det meste fraksjoner som har mellom
30 og 60 karbonatomer i molekylene. Teknisk skilles det mellom oljer på
parafinbasis, naftenbasis og blandbasis, en mellomting mellom de to.
Parafinbasis innebærer at hydrokarboner i åpne kjeder er dominerende, mens
naftenbasis betyr sykliske hydrokarboner, aromater (benzenringer) eller
naftener (5-ringer). Råolje fra forskjellige oljekilder har forskjellig
fordeling av parafin- og naftentypene.
Bitumen anvendes i stort
til permanent veidekke (asfalt) og impregnering av takpapp og forhudningspapp.
Oksydert, luftgjennomblåst bitumen med større elastisitetsområde og høyere
mykningspunkt brukes til klebende produkter hvor det er viktig at de er
vanntette og temperaturisolerende og mer luktfri og bestandig overfor
temmperaturforandringer enn steinkullbek. Bitumenlakk er bitumen oppløst i
flyktige løsningsmidler, og brukes til vannisolasjon og rustbeskyttelse, men er
følsom overfor sollys. Vannbaserte bitumenemulsjoner brukes til
overflatebehandling i veibygging og som klebemiddel når et nytt asfaltdekke
skal legges over et annet. Seige emulsjoner brukes til klebing av
isolasjonsplater.
Asfalt er naturlig
bitumen som er oppstått ved at de lettere bestanddelene av jordoljen har dampet
bort på naturlig vis. Den kan inneholde mineralske, silikatrike bestanddeler.
Trinidad-asfalten er kjent for dette, men vanligvis må den tilsettes grus for å
bli velegnet for veidekke. Asfaltlakk lages på samme måte som bitumenlakk og
har de samme bruksområdene.
Grafitt er et utmerket
smøremiddel som tåler høye temperaturer og kjemiske påvirkninger godt.
Smøreeffekten baserer seg på skiktenes evne til å gli forbi hverandre, noe som
går best når grafitten ikke er ren, slik at det er mange fremmede atomer mellom
skiktene. Smøregrafitt som utsettes for høy temperatur og vakuum mister disse
urenhetene, og dermed mye av smøreevnen. På grunn av den kjemiske
motstandsevnen brukes grafitten også mye som anodemateriale i mange
industrielle prosesser og i laboratorier. Og selvsagt brukes grafitt i
blyanter, hvor hardheten regulered med tilsetning av ulike mengder leire. Noen
atomreaktorer bruker også grafitt til moderatorer, fordi atomene er lette slik
at de bremser nøytronene godt, og samtidig har de svært lite tendens til å fange
inn nøytroner selv.
Aktivt kull er porøse,
forkullede materialer som trekull eller beinkull som har stor indre overflate
og uvanlig god absorpsjonsevne. Overflateskiktet har ledige kovalente
bindingsposisjoner som lett binder alle fremmede stoffer som passerer, og er i
tillegg "aktivisert" ved oksydering - innføring av oksygenholdige
grupper som øker absorpsjonsevnen ytterligere. Derfor brukes det aktive kullet
mye til luft- og vannrensing og andre renseoperasjoner, f.eks. i gassmasker.
Karbonmonoksyd, vann og etanol går imidlertid uhindret igjennom. Men urin
f.eks., som filtreres gjennom et aktivt karbonfilter, kommer ut igjen som rent
vann. Brennevin kan befris for fuseloljer med aktiv kullfiltrering og den
brukes også til å raffinere brunt sukker. Avtrekk i skolenes og universitetenes
kjemisaler er forsynt med aktive kullfiltre. Brent kaffe har tildels de samme
absorberende egenskapene som det aktive kullet og må oppbevares uten kontakt
med mulige luktstoffer som kan absorberes i kaffen og påvirke aromaen. Det
aktive kullet brukes også som fargestoff i matvarer (E153), bl.a. i iskrem,
hermetisk fisk og skalldyr, saus, kaker, fylte kjeks, hermetisk frukt og
grønnsaker, sukkertøy, saft og brus, samt kosttilskudd o.l. Ingen form for
skadevirkninger er påvist.
Karbonfiber fremstilles
av akrylfiber i tre trinn, hvor fibrene oftest holdes under strekk: 1. Fibrene
varmes opp til ca. 220 °C, som gjør at polymermolekylene får sykliske
strukturer i kjeden med tverrforbindelser, og oksyderes så ved 300 °C. Nå
smelter de ikke ved de senere temperaturene. 2. Fibrene forkulles i nitrogen
ved ca. 1300 °C. 3. En varmebehandling ved 1500-3000 °C i inert atmosfære gir
den ønskede grad av grafittisering. 1500 °C gir maksimal styrke, mens maksimal
stivhet fås ved høyere temperatur. De første karbonfibrene ble fremstilt av
Edison til glødelamper (med en noe enklere fremgangsmåte). De har en usedvanlig
styrke og fasthet og er idag tatt i bruk i utstrakt grad.
Richard Buckminster
Fuller het en amerikansk arkitekt som likte godt å eksperimentere med
selvbærende geometriske bjelkekonstruksjoner. Ved å studere krystallformer i
naturen fant han ut at det flate sekskantmønsteret i bikuber og andre steder
kunne foldes sammen til en kule ved å bytte ut noen av sekskantene med
femkanter, slik som i ikosaedrene som noen kubiske mineraler krystalliserer i,
f.eks. granater og vesuvian. Et slikt ikosaederbygg ble presentert på
verdensutstillingen i Los Angeles i 193?, og har siden blitt kopiert på
radarstasjoner hvor antennen trengte en kuleliknende beskyttelse, og som
monumentale byggkonstruksjoner på steder hvor byggherrene gjerne ville gjøre et
modernistisk, originalt inntrykk, f.eks. i Stockholm. Også et mye brukt mønster
i nyere tid til å sy sammen fotballer med.
I 1985 fikk Harold Kroto
lokket med seg Richard Smalley, som egentlig ikke var interessert i sot, til
Rice-universitetet i USA for å studere mulige interstellare kjemiske reaksjoner
med en laser som kunne fordampe materialer med svært høyt kokepunkt. Under et
av disse eksperimentene registrerte de noen merkelige molekyler som viste seg å
ha sammensetningen C60, og altså besto av rent karbon.
Strukturanalyser viste
at de var dannet av et sekskantskikt som i grafitt, men var foldet sammen til
en kuleform ved at noen av sekskantene var erstattet av femkanter, altså et
ikosaeder. På grunn av formen besluttet de å kalle stoffet buckminsterfulleren,
til minne om arkitekten med kulebygningene, som døde tidligere det året. Senere
er det oppdaget flere molekyler av samme type, som går under fellesbetegnelsen
fullerener, eller buckyballer om man vil. Hvert av disse fullerenene er en
allotrop av karbon, og siden det ikke er grenser for hvor mange slag det kan
fremstilles av dem, er også karbon det grunnstoffet som har flest allotroper.
Som enkelte teoretikere
hadde spådd så langt tilbake som 1971, viste disse fullerenene seg å være uhyre
stabile og motstandsdyktige. Bindingene i dem er av samme type som mellom
sekskantene i grafitt og i tetraedermønsteret i diamant. En annen interessant
egenskap er at de kan inneslutte forskjellige andre atomer med egenskaper som
kanskje kan utnyttes på forskjellige måter. Men ideene om utnyttelse av
fullerener skjøt ikke skikkelig fart før man fant ut at grafittsekskanter også
kunne rulles sammen som rør, gjerne med en halv buckminsterkule som tetter
igjen endene. Slike rør kalles gjerne buckytubes på internasjonalt, og er mye
sterkere enn noen andre kjente fiberstrukturer. Metoder er under utvikling for
produksjon av virkelig lange buckyrør, og hvis man lykkes, kan for eksempel
science-fiction-ideene om sirkulerende satellitter fortøyd med kabler bli til
virkelighet.
Ved tilstrekkelig trykk
og temperatur kan det lages kunstige diamanter av grafitt. For å øke omdanningshastigheten
brukes katalysator i form av overgangsmetaller som krom, platina og jern med
stor løselighet for karbon. Metallet smelter, legger seg over grafitten og
løser opp karbonet, men under de ekstreme temperatur- og trykkforholdene er
diamant mer stabilt og siden den er mindre løselig enn grafitten felles den ut
av løsningen. Med tilfeldig eller bevisst tilsetning av urenheter kan fargen
varieres, f.eks. gir nitrogen gul farge og bor blå. Omtrent 40 % av
verdensproduksjonen av diamanter til teknisk bruk er nå syntetisk. Også
smykkesteinskvaliteter på opptil 5 mm kan oppnås, men blir dyrere enn de
naturlige.
Karbondioksyd, CO2,
brukes mye i form av tørris som lagrings- og konserveringsmiddel for fisk,
frukt m.m., samt for tilsetning til mineralvann (E290) og til metallurgiske
formål, f.eks. krymping av metallstykker, støpeformer e.l. og til herding ved
bråkjøling av stål. Tørrisen lages ved "avspenning", dvs. ved å
slippe ut gass som står under trykk. Utvidelsen kjøler ned gassen og en del
faller ned som "kullsyresnø" som kan pakkes til tørrisblokker. Store
mengder karbondioksyd går også med til fabrikasjon av mineralvann samt til soda
og andre karbonater. Koffeinfri kaffe lages ved å ekstrahere koffein fra
kaffebønnene med flytende karbondioksyd ved 400 atmosfærers trykk, da koffein
er løselig i karbondioksyd i notsetning til de fleste organiske stoffer.
Karbondioksyd leveres ofte flytende på trykkflasker. Mestedelen av
karbondioksydet i handelen er et biprodukt fra bryggeri- og brenneriindustrien,
hvor gjæring av sukker produserer etanol og karbondioksyd: C6H12O6
= 2C2H5OH + 2CO2.
Karbonmonoksyd, CO,
brukes som brennmiddel i lysgass og vanngass, som reduksjonsmiddel i
metallurgien og til renfremstilling av nikkel og enkelte andre metaller ved hjelp
av karbonyler, samt til en del synteser, bl.a. av syntetisk bensin, metanol
(med hydrogen) og fosgen (med klor). Når karbondioksyd føres over glødende koks
fås såkalt generatorgass: CO2 + C = 2 CO. Fra toppen av masovnene i
jernverk fås såkalt giktgass med liknende sammensetning og dannelsesmåte. Begge
er sterkt forurenset av luftnitrogen. Vanngass består av karbonmonoksyd og
hydrogen og lages ved å føre vanndamp over glødende kull: H2O + C =
CO + H2. Den gir høy brennverdi og har vært populær til mange formål.
Blåsyre, HCN, er en
meget brukt giftgass som anvendes i diverse sammenheng, til
gasskammerhenrettelser, avlusing av boliger m.m. Den forhandles ofte i
metallbeholdere oppsugd i kiselgur.
Urinstoff, karbamid
eller urea, (NH2)2CO, har utstrakt bruk som
nitrogengjødsel, til fôr og i polymerkjemien til fremstilling av bl.a.
kunstharpikser. En tynn urealøsning kan opptas direkte gjennom plantenes
bladverk etter påsprøyting, noe som ofte utnyttes ved fruktplantasjer i varmere
land. Smaker søtt og brukes derfor også som søtstoff i sukkerfri tyggegummi.
Metylklorid, CH3Cl,
brukes som metyleringsmiddel og ekstraksjonsmiddel i kjemisk industri og har
tallrike anvendelser i teknikken.
Dijodmetan, CH2J2,
er den tyngste av alle organiske væsker (3,33 g/cm3) og brukes til
tetthetsbestemmelse og separasjon av mineralblandinger.
Kloroform, CHCl3,
har vært mye brukt som bedøvelsesmiddel, men har stor risiko for
skadevirkninger. Spaltes til saltsyre og det meget giftige fosgen ved
innvirkning av lys og luft. Mye brukt som ekstraksjons- og løsningsmiddel,
spesielt for harpikser og oljer.
Jodoform, CHJ3,
før mye brukt som strøpulver for sårdesinfeksjon.
Karbontetraklorid, CCl4,
også kalt tetraklormetan, tetraklorkullstoff, bensinoform eller
"tetra" er et mye brukt løsnings- og ekstraksjonsmiddel.
Diklordifluormetan, CCl2F2,
er det mest brukte av klorfluorkarbonene (KFK), som kan være avledet enten av
metan eller andre enkle hydrokarboner og også kalles freoner eller freon-gasser
med et fellesnavn. De har vært uhyre utbredt som kuldemedium i kjøleskap,
kunstisbaner o.l., samt som drivmiddel for aerosolbokser og som løsnings- og
ekstraksjonsmidler fordi de er stabile, ikke-korroderende, ikke brennbare og
ugiftige, men på grunn av stabiliteten vil de spre seg til de øvre
atmosfærelagene hvor de utsettes for fotokjemiske reaksjoner som danner
reaktive frie kloratomer og radikaler som er en fare for osonlaget selv i meget
lav konsentrasjon.
Etylen eller eten, C2H4,
er et nøkkelstoff i kjemiindustrien. Gjennom mellomstadier som 1,2-epoksyetan
(etylenoksyd) og 2-kloretanol (også kalt etylenklorhydrin) dannes bl.a.
produktene etylenglykol (1,2-etandiol) og etanolaminer. Etylenglykol er mye
brukt til frostvæske på bilradiatorer og danner utgangspunkt for glykoletere og
glykolestere som er viktige industrielle oppløsningsmidler. Etanolaminenes
salter med fettsyren oljesyre er løselige både i vann og olje og har utstrakt
bruk som rense- og vaskemidler. Ad andre veier fås en rekke mye brukte
substanser som emulsjonsmidler, oppløsningsmidler, legemidler, mykningsmidler,
eksplosiver, en rekke forskjellige polymerer. En polymer av etylen er den
viktige plasten polyetylen eller polyeten. Av andre etylenprodukter kan nevnes
vinylklorid som gir det overmåte viktige plaststoffet PVC, etylendiamin som gir
ionebytterharpikser, isotionsyre som via taurin gir visse fuktemidler og
vaskemidler. Visse oljerike land tilfredsstiller mesteparten av sitt
industrielle etanolbehov ved å lage den av etylen.
Trikloretylen, CHCl=CCl2,
blant venner "tri", brukes mye som løsnings- og ekstraksjonsmiddel.
Også acetylen, C2H2,
danner grunnlag for en mengde synteser. Det polymeriserer lett og kan ved enkle
prosesser danne slike viktige polymerer som neopren, en syntetisk gummi. Det
adderer klor til 1,1,2,2-tetrakloroetan og andre viktige løsningsmidler og vann
til acetaldehyd, som selv danner grunnlag for en rekke polymerer og for syntese
av eddiksyre og aceton. Tatt i betraktning alt det som kan lages av disse
forbindelsene kan acetylen også sies å være litt av et nøkkelstoff, men
eddiksyren og acetonet kan fås av andre ting enn acetylen også. Den vanligste
måten å lage vinylklorid, utgangspunktet for PVC-plast, på er ved å addere
saltsyre (hydrogenklorid) til acetylen.
Benzen, C6H6,
er et viktig teknisk oppløsningsmiddel for fett, harpiks og gummi. Det brukes
også som motordrivstoff og til syntese av en rekke viktige stoffer.
Toluen, C6H5CH3,
brukes som løsningsmiddel og til fremstilling av det viktige sprengstoffet
trinitrotoluen (TNT).
Xylen, C6H4(CH3)2,
brukes i flybensin og som løsningsmiddel. Hver av de tre isomerene orto-, meta-
og para-xylen er viktige råstoff for syntese i plast-, medikament- og
fargestoffproduksjon.
Bifenyl, C6H5-C6H5,
er et konserveringsmiddel som brukes til overflatebehandling av sitrusfrukter
(E230), og hemmer veksten av mugg og sopp.
Naftalen, C10H8,
brukes som møllmiddel og til fremstilling av kunstig indigofarge.
Kinolin, C9H7N,
er hovedbestanddelen i kinolingult, (E104) som brukes til farging av vin og
brennevin.
Antracen, C14H10,
er utgangspunkt for fremstilling av alizarin, som danner grunnlag for en hel
serie av fargestoffer.
Parafinolje og
parafinvoks fremstilles ved fraksjonering av råolje og består av langkjedede
hydrokarboner med lavt innhold av ringgrupper. Vaselin er et blandingsprodukt
av oljen og voksen. I ernæringsindustrien brukes parafinolje (E905a) og vaselin
som smøremiddel i maskiner, på bakeplater og andre overflater hvor maten kan
henge fast. Parafinvoks (E905b) brukes i tyggegummibase og til skorpe på ost.
Alle brukes til overflatebehandling for å gi en blank overflate eller en
spesiell konsistens. I store doser virker parafinolje som et mildt
avføringsmiddel. Parafin som kommer inn i tarmkanalen opptas i liten grad, men
vil avleires i lever, milt, lymfeknuter og fettvev, og det er påvist skader hos
forsøksdyr i disse organene. Brukes på sjokolade og sukkertøy,
kosttilskuddtabletter, rosiner, epler og finnes i konditorvarer og i
ferdigoppskåret brød hvis knivene er smurt med parafinolje.
 Indigofargestoffene er bygd opp
av to sammensatte indolgrupper, modifisert med forskjellige sidegrupper, f.eks.
hydroksyl i indigohvitt, keton i indigorødt, natriumsulfonat i indigokarmin.
Indigokarmin er et blått fargestoff som brukes til farging av vin og brennevin
(E132). Sikkerheten er dradd i tvil etter visse forsøk, men spørsmålet er
uavklart.
Indigofargestoffene er bygd opp
av to sammensatte indolgrupper, modifisert med forskjellige sidegrupper, f.eks.
hydroksyl i indigohvitt, keton i indigorødt, natriumsulfonat i indigokarmin.
Indigokarmin er et blått fargestoff som brukes til farging av vin og brennevin
(E132). Sikkerheten er dradd i tvil etter visse forsøk, men spørsmålet er
uavklart.
De mest utbredte
fargestoffene i naturen er karotenoider, og de brukes i utstrakt grad i
matvarer. Mange av dem kan spaltes til vitamin A i kroppen. I Norge er det ikke
tillatt å bruke syntetiske karotenoider i maten. Betakaroten (E160a) er et
hydrokarbon som spaltes og oksyderes til to enheter retinol (vitamin A) i
kroppen. Det er et gult fargestoff og brukes som tilsetningsstoff i en rekke
matvarer. Annattoekstrakt (E160b) er også gult og inneholder karotenoidene
bixin og neobixin, som mangler ringstrukturen i betakaroten og ikke kan
omdannes til retinol. Brukes i en rekke forskjellige matvarer. Oleoresin fra
paprika (E160c) er rødt og brukes i imiterte skalldyrprodukter basert på
fiskemasse. Det oransjerøde beta-apo-8-karotenal (E160e) og den gule/oransje
beta-apo-8-karoten-etylesteren (E160f) brukes i en rekke matvarer og kan
omdannes til retinol i kroppen.
Amarant er et rødt
azofargestoff som har vært mye brukt i matvarer (E123). Ble forbudt i mange
land etter 1970 da forsøk tydet på at det kunne fremkalle kreft og
fosterskader. Restriksjonene er nå lettere siden mange senere forsøk ikke har
kunnet reprodusere resultatene, men i Norge bare tillatt i vin og barmiks.
Tiabendazol brukes som
konserveringsmiddel eller plantevernmiddel (E233) mot visse bakterier, hemmer
også veksten av mugg og annen sopp. Finnes på skallet av sitrusfrukter, bananer
og epler. Brukes også som medisin mot innvollsorm hos dyr og mennesker, og
bruken på næringsmidler er derfor kontroversiell, siden jevnlig inntak av små
mengder gjennom maten vil øke motstandskraften til parasittene.
Polymetylsiloksan brukes
som skumdempningsmiddel og tilsetningsstoff i næringsmidler (E900).
Fenol, C6H5OH,
ble tatt i bruk av J.Lister i 1867 som det første av alle antiseptika. Danner
bakelitt sammen med formaldehyd. Ved nitrering fås sprengstoffet pikrinsyre.
2-fenylfenol eller
ortofenylfenol, C6H4(C6H5)OH,
brukes til sprøyting av frukt og grønnsaker for å hemme veksten av mugg og
annen sopp (E231). Tidlige forsøk viste kreftrisiko ved høye doser til
forsøksdyr, men dette er tilsynelatende ikke relevant for mennesker.
Butylhydroksyanisol
(BHA), (C4H9)(CH3O)C6H3OH,
tilsettes til matvarer som antioksydant (E320) for å hindre harskning av fett
og oljer, særlig til fettstoffer fra dyr som er fattige på naturlige
antioksydanter. Stoffet er svært effektivt og brukes derfor mye, men forsøk på
rotter har ført til kreft i formagen til rottene. Finnes i vakuumpakkede
kjøttvarer, halvkonserver av kjøtt, fiskehermetikk og mange fiskeprodukter,
brød, kaker, kjeks, peanøtter, potetmos, tørkede erter og bønner,
grønnsaksupper, snacks, sennep og ketchup samt tyggegummi.
Et liknende
tilsetningsstoff er butylhydroksytoluen (BHT), (C4H9)(CH3)C6H3OH,
E-kode E321. Også dette stoffet utvikler kreft hos rotter, men fordi det virker
antioksyderende beskytter det mot gifter og andre kreftfremkallende stoffer,
slik at rottene gjennomsnittlig får økt livslengde. Brukes i fettemulsjoner,
vakuumpakkede kjøttvarer, halvkonserver av kjøtt, fiskehermetikk og mange
fiskeprodukter - også røkelaks o.l., brød, kaker, kjeks, peanøtter, potetmos,
tørkede erter og bønner, grønnsaksupper og tyggegummi.
Naturlige tokoferoler,
også kjent som vitamin E, brukes som tilsetningsstoffer i mat (E306).
Alfa-tokoferol fremstilles syntetisk og brukes på samme måte (E307). De er
antioksydanter som hemmer harkning av olje og fett, de fungerer også som
næringsstoff og kan hemme dannelsen av kreftfremkallende nitrosaminer i kjøtt
som er tilsatt nitritt. Finnes i hermetikk, konserves og en rekke fettholdige
varer.
Glyserol, CH2OHCHOHCH2OH,
er en hovedbestanddel av fett og et biprodukt ved såpekoking, lages også systetisk.
Brukes i næringsmidler (E422) som konistensmiddel og tabletthjelpestoff og som
vannbindende middel i godterier, men ikke som søtstoff, selv om det smaker
søtt. Finnes i iskrem, sukkertøy, pølseskinn, brennevin, vitaminpiller og
tørket frukt og bær til frokostblandinger.
Sorbitol, CH2OH(CHOH)4CH2OH,
forekommer i mange frukter, men fremstilles syntetisk av stivelse og brukes i
matvarer som søtstoff og vannbindende middel (E420). Virker også som
stabilisator og bløtgjørende konsistensmiddel. Finnes i sukkerfrie godterier og
en rekke andre matvarer. Brytes ikke ned til syre av bakterier og er derfor bra
for tannhelsen. Gir like mange kalorier som sukker, samtidig som det er knapt
halvparten så søtt som sukkeret, og er derfor ikke slankende. Inntak av mer enn
20 gram på en gang kan gi diaré. Gir ikke samme blodsukkerøkning som sukker, og
kan derfor brukes av diabetikere, men ikke kritikkløst.
Mannitol, CH2OH(CHOH)4CH2OH,
skiller seg fra sorbitol i stereokjemien. Det fremstilles av mannose (manna) og
brukes i matvarer som søtstoff (E421). Det har samme egenskaper som sorbitol og
brukes i tyggegummi og drops, strøsukker og kosttilskudd.
Xylitol, CH2OH(CHOH)3CH2OH,
lages ved hydrogenering av xylose og brukes som søtstoff med omtrent samme
egenskaper som sorbitol og mannitol (E967). Stoffet er et ledd i kroppens
sukkerstoffskifte, og bør derfor ikke brukes av diabetikere. Finnes i
tyggegummi, pastiller, vitamintabletter og energiredusert sjokolade.
Isomalt er et søtstoff
som er litt mindre søtt enn sukker (E953). Det gir nesten like mange kalorier
som sukker, er ikke spesielt velegnet for diabetikere og kan gi diaré, men det
er tannvennlig. Finnes i drops, pastiller og tabletter.
Maltitol eller
hydrogenert glukosesirup er et søtstoff som lages ved kjemisk behandling av
stivelse og er litt mindre søtt enn sukker. Er tannvennlig, men energirikt,
ikke spesielt egnet for diabetikere og kan også gi diaré. Brukes i
brennevinsessens og en rekke sukkerfrie godterier (E965).
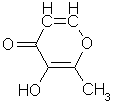 Maltol, larixinsyre eller
2-metyl-3-hydroksy-4-pyron, frem stilles av maltose og brukes i næringsmidler
(kode 636) som aromastoff og smaksforsterker som fremhever den søte smaken.
Finnes i diverse pulverprodukter.
Maltol, larixinsyre eller
2-metyl-3-hydroksy-4-pyron, frem stilles av maltose og brukes i næringsmidler
(kode 636) som aromastoff og smaksforsterker som fremhever den søte smaken.
Finnes i diverse pulverprodukter.
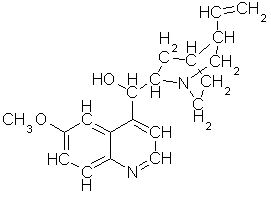 Kinin er et alkaloid som utvinnes
av barken av kinatreet og brukes i næringsmiddelindustrien som bittert
smaksstoff, vesentlig i brus og leskedrikker. Medisinsk virker det
febernedsettende og kinin var tidligere svært mye brukt mot malaria og andre
febertilstander.
Kinin er et alkaloid som utvinnes
av barken av kinatreet og brukes i næringsmiddelindustrien som bittert
smaksstoff, vesentlig i brus og leskedrikker. Medisinsk virker det
febernedsettende og kinin var tidligere svært mye brukt mot malaria og andre
febertilstander.
Stivelse utvinnes av
poteter, hvete, mais og ris og brukes mye i kostholdet og gjerne mer eller
mindre modifisert som tilsetninger i næringsmidler. Potetmel er ren
potetstivelse. De modifiserte stivelsene brukes gjerne som stabilisatorer og
fortykningsmidler og har hver sine egne egenskaper som gjør dem egnet for
forskjellige formål. Den rene stivelsen, dekstrinet, merkes E1400, mens syrebehandlet
stivelse er E1401, alkalibehandlet E1402, bleket E1403, oksydert E1404,
monostivelsesfosfat E1410, distivelsesfosfat ST E1411, distivelsesfosfat PO
E1412, fosfatert distivelsesfosfat E1413, acetylert distivelsesfosfat E1414,
stivelsesacetat AA E1420, stivelsesacetat VA E1421, acetylert distivelsesadipat
E1422, hydroksypropylstivelse E1440 og hydroksypropylstivelsesfosfat E1442.
Finnes i en mengde produkter.
Agar-agar er et
karbohydrat som utvinnes av tang og brukes i en rekke matvarer som emulgator, fortykningsmiddel
og stabilisator (E406) og til overflatebehandling av fiskeprodukter. Agar-agar
er også det vanligste dyrkningsmediet for bakterier i laboratoriet. Navnet er
malayisk og stoffet har vært i bruk i Asia siden 1600-tallet.
Karrageenan er et annet
karbohydrat som utvinnes av tang og brukes i en rekke matvarer som
stabilisator, fortyknings- og gelatineringsmiddel (E407). Det erstatter gjerne
gelatin i vegetarprodukter. Visse metaller som kalium og kalsium gjør at
gelatineringen går raskere, derfor tilsettes ofte kalsiumklorid. Navnet er irsk
og karragenan har vært i bruk i Irland i århundrer, bl.a. i puddinger og som
eget næringsmiddel, siden det i motsetning til agar-agar er fordøyelig for
mennesker. Karragenan som skal brukes i mat må være fersk og fri for
nedbrytningsprodukter, siden nedbrytningsproduktene har gitt kreft i dyreforsøk.
Johannesbrødkjernemel er
et karbohydrat som utvinnes av frøene til johannesbrødtreet, som vokser i
middelhavsområdet og har vært utnyttet siden oldtiden. Egypterne brukte det
bl.a. som lim da de balsamerte mumiene sine. Brukes i matvarer (E410) som
stabilisator og fortykningsmiddel og finnes i en mengde matvarer.
Guarkjernemel er et
annet karbohydrat som utvinnes av frøene til guarplanten, en belgvekst som
likner mye på soya. Brukes som fortykningsmiddel og stabilisator i en mengde
forskjellige matvarer (E412). Brukes også til maling, kosmetikk, tekstiler og
slankeprodukter. Siden guarkjernemelet er ufordøyelig og eser opp i magen og
tarmkanalen får man en metthetsfølelse uten inntak av næringsstoffer.
Tragant er et
karbohydrat som fremstilles av det tørkede ekstraktet av forskjellige
astralagusplanter, småbusker som vokser bl.a. i fjellområdene i Tyrkia og
Persia. Brukes som stabilisator og fortykningsmiddel i matvarer (E413). Er
stabil også i sure næringsmidler og brukes derfor i dressinger, ketchup o.l.,
men også en rekke andre næringsmidler.
Pektin er et karbohydrat
som finnes i mange frukter og grønnsaker, hvor det styrker celleveggene. At en
frukt blir bløt når den modner skyldes bl.a. at pektinet nedbrytes. Fremstilles
av sitron- og appelsinskall og brukes i matvarer (E440a) som fortyknings- og
gelateringsmiddel. Mesteparten brukes til marmelade, men det brukes også i en
mengde andre matvarer, ofte i syltetøy, og selges ofte til hjemmesylting. Av
det vanlige pektinet fremstilles også amidert pektin (E440b), som har samme
bruksområder.
Gummi arabicum er et
karbohydrat som utvinnes av akasietreet og brukes i matvarer som
stabiliserings- og fortykningsmiddel (E414). Løser seg mye lettere i vann enn
andre gummisorter og flittig brukt i godterier, pulverprodukter, majones,
limonade, brus, brennevin, tørr-røstede og dragerte nøtter. Er urgammelt
råstoff som bl.a. ble brukt i maling av de gamle egypterne.
Xantangummi er et
karbohydrat som fremstilles ved bakteriell gjæring av sukker. Brukes som
fortykningsmiddel og stabilisator i matvarer (E415). Danner temperaturstabile
geleer sammen med johannesbrødkjernemel. Brukes ofte i kryddersauser og
salatdressinger, men også en mengde andre produkter.
Tarakjernemel består av
polysakkarider med høy molekylvekt og fremstilles ved å knuse endospermene av
frøene til planten caesalpina. Brukes i tyggegummibase og glutenfritt mel
(E417).
Gellangummi er et gummiaktig
polysakkarid som fremstilles ved bakteriell gjæring av et karbohydrat. Brukes i
matvarer (E418) som geleringsmiddel, stabilisator og fortykningsmiddel og kan
finnes i desserter. Kan virke avførende ved høyt inntak.
Kombiasjoner av
polyoksyetylen- og polyoksypropylen-fettalkoholer og en blanding av alkoholer
med 10-20 karbonatomer brukes til skumdempning i alle næringsmidler unntatt
drikkevann.
Eter (dietyleter), (C2H5)2O,
brukes som ekstraksjons- og løsningsmiddel i en mengde forskjellige prosesser.
Det har også fortsatt en viss bruk til bedøvelse, bl.a. hos veterinærer.
Formaldehyd, CH2O,
er mye brukt til desinfeksjon og konservering. Formalin er en konsentrert
formaldehydløsning i vann, ca. 40 %. Det lar seg også lett polymerisere til
kortkjedete produkter som i noen tilfelle har anvendelse som
desinfeksjonsmidler, og til mer langkjedete som har betydning i plastindustrien.
Aceton, (CH3)2CO,
er et av de mest brukte organiske løsnings- og rensemidlene. Det er også
råstoff for pleksiglassproduksjon.
Curcumin, CH2(COCH:CHC6H4(OCH3)OH)2,
er hovedbestanddelen av gurkemeiefarge, E100, et gult fargestoff som
fremstilles av gurkemeierot, brukes i en mengde matvarer og også selges som
konditorfarge.
 Koffein, eller
1,3,7-trimetylxantin, finnes naturlig i te, kaffe og kolanøtter og utvinnes av
dem. Gir en svakt bitter smak og virker oppkvikkende. Brukes som
tilsetningsstoff i cola.
Koffein, eller
1,3,7-trimetylxantin, finnes naturlig i te, kaffe og kolanøtter og utvinnes av
dem. Gir en svakt bitter smak og virker oppkvikkende. Brukes som
tilsetningsstoff i cola.
Eddiksyre, CH3COOH,
brukes sammen med acetatene som tilsetningsstoff i matvarer (E260, Na-acetat
E262, K-acetat E261, Ca-acetat E263) som konserveringsmiddel mot bakterier, til
å gi smak og til å regulere pH.
Propionsyre, C2H5COOH,
brukes som konserveringsmiddel (E280), sammen med natrium- (E281), kalium-
(E283) og kalsium(E282)propionatene. Spesielt effektivt mot muggsopp, effektivt
også mot bakterier i brød (kalsiumpropionat). Brukes i alle typer bakervarer,
brød, kaker, lomper, lefser.
Stearinsyre, C16H31COOH,
brukes til overflatebehandling av tabletter og i fiber- og kosttilskudd (kode
570), samt til fremstilling av stearin. Magnesium- og kalsiumstearat brukes som
midler mot klumper i næringsmidler og hjelpestoffer i tabletter (kode 572).
Melkesyre, CH3CH(OH)COOH,
E270 som tilsetningsstoff i matvarer. Melkesyre og saltene av den (laktater)
brukes som konserveringsmiddel i brød og gjærbakst. Brukes også som smaksstoff
og pH-regulerende midler i en rekke varer. Kan binde metaller og virker
forsterkende på antioksydanter som brukes til å hindre harskning av fett.
Saltene av melkesyre brukes som surhetsregulerende midler som også forsterker
antioksydantenes virkning mot harskning og brunfarging. Natriumlaktat er E325,
kaliumlaktat E326 og kalsiumlaktat, som også brukes som kalktilskudd, E327.
Jern(III)laktat tilsettes til sopp som fargestabiliserende middel.
Vinsyre
HOOCCH(OH)CH(OH)COOH, biprodukt ved vinproduksjon. Den venstredreiende
stereoisomeren er den eneste naturlige. Syntetisk vinsyre er vanligvis
racemisk, d.v.s. en optisk inaktiv blanding av høyre- og venstredreiende. Bare
den naturlige brukes som tilsetning i maten (E334) som surhetsregulerende
middel som også virker forsterkende på antioksydanter. Saltene natrium- (E335),
kalium- (E336) og kalsiumtartrat (E337) brukes på samme måte. Finnes i imiterte
skalldyrprodukter, kakao, sjokolade og annet snacks, kaker og kjeks, vin og
brennevin. Vinsyre alene brukes i mineralvann.
Eplesyre, HOCH(CH2COOH)COOH,
brukes i en rekke matvarer (kode 296) som surhetsregulerende stoff, virker også
konserverende og forsterker antioksydantenes virkning på oljer, skrelt frukt og
grønnsaker. Den syntetiske formen som brukes som tilsetningsstoff er en
racemisk blanding, men det er bare de venstredreiende som forekommer i naturen.
Saltene natrium- (kode 350), kalium- (351) og kalsiummalat (352) brukes
surhetsregulerende og til å forsterke antioksydantene. Også utbredt, bortsett
fra at kaliummalat bare brukes i sauser til kjøttvarer.
Sitronsyre, HOC(CH2COOH)2COOH,
utvinnes av sitroner og brukes som tilsetningsstoff i matvarer (E330) for å
regulere pH og forsterke virkningen av antioksydanter ved at den binder
metaller som katalyserer oksydasjonen. Saltene natrium- (E331), kalium- (E332)
og kalsiumcitrat (E333) brukes på samme måte og sistnevnte også i kalktilskudd.
Finnes i en mengde forskjellige matvarer.
Sorbinsyre eller
2,4-heksadiensyre, CH3CH:CHCH:CHCOOH, brukes som konserveringsmiddel
(E200), spesielt mot mugg, i en mengde matvarer, gjerne de som er sure eller
syrlige, dessuten til å hindre ettergjæring i vin. Saltene natriumsorbat
(E201), kaliumsorbat (E202) og kalsiumsorbat (E203) har samme bruk.
Benzosyre, C6H5COOH,
brukes i en mengde matvarer som konserveringsmiddel (E210), spesielt mot gjær-
og muggsopper, men også bakterier. Virker bare i sure produkter, tilsettes
derfor ofte sitronsyre. Saltene natriumbenzoat (E211), kaliumbenzoat (E212) og
kalsiumbenzoat (E213) brukes tilsvarende. Natriumsaltet er et vanlig
konserveringsmiddel for syltetøy i husholdningen.
 Sakkarin eller
2-sulfo-benzosyreimid er det første syntetiske søtstoffet og har vært brukt i
mer enn 100 år. Er 400 ganger så søtt som sukker, men med en bitter ettersmak.
Gravide rotter bør ikke spise store doser sakkarin, da det er en risiko for at
ungene utvikler blærekreft. På grunn av dette prøvde man å forby stoffet i
mange land på 1970-tallet, men siden samme tilstand ikke er påvist hos
mennesker er det nå tillatt å bruke det igjen. Finnes i en mengde næringsmidler
og kosttilskuddpreparater (E954).
Sakkarin eller
2-sulfo-benzosyreimid er det første syntetiske søtstoffet og har vært brukt i
mer enn 100 år. Er 400 ganger så søtt som sukker, men med en bitter ettersmak.
Gravide rotter bør ikke spise store doser sakkarin, da det er en risiko for at
ungene utvikler blærekreft. På grunn av dette prøvde man å forby stoffet i
mange land på 1970-tallet, men siden samme tilstand ikke er påvist hos
mennesker er det nå tillatt å bruke det igjen. Finnes i en mengde næringsmidler
og kosttilskuddpreparater (E954).
4-hydroksybenzosyre
eller parahydroksybenzosyre, HOC6H4COOH, er
utgangspunktet for fremstillingen av en rekke konserveringsmidler ved at
hydroksylgruppen bindes til forskjellige alkoholer med en eterbinding. 4-metoksybenzosyre
(anissyre) er E218, natrium-4-metoksybenzoat E219, 4-etoksybenzosyre E214,
natriumsaltet E215, 4-propoksybenzosyre E216 og natriumsaltet E217. Sammen kalles de parabener og har
omtrent samme egenskaper og bruk som benzosyren og dens salter, men en viss bismak
gjør at bruken i matvarer er begrenset.
Glukonsyre, CH2OH(CHOH)4COOH,
fremstilles ved oksydasjon av glukose og brukes som pH-regulerende middel i
sjokolade og sjokolademousse (E574), mens glukono-delta-lakton (GDL, E575)
brukes i spekepølse, kaker, kjeks og kakemiks. Alkali- og jordalkalisaltene av
glukonsyre brukes som emulgator i sjokolade, sjokolademousse og tyggegummi
(Na-glukonat E576, K-glukonat E577, Ca-glukonat E578 og Mg-glukonat 580).
Natriumglukonat brukes i sterk lutløsning i meierier, bryggerier o.l. i
rengjøringsmaskiner for flasker fordi det forhindrer at det oppstår kjelestein
hvis vannet som brukes er hardt. Kalsiumsaltet brukes også i tabletter som
kalsiumtilskudd. Jernglukonat brukes som svart fargestoff i oliven (E579).
L-leucin, NH2CH(CH2CH(CH3)2)COOH,
en av de aminosyrene som inngår i proteiner og som menneskekroppen selv
produserer. Den naturlige l-formen brukes som overflatebehandlingsmiddel på
søtningstabletter.
L-cystein, NH2CH(CH2SH)COOH,
er en annen av de naturlige aminosyrene som inngår i proteiner. Cysteinet selv
og saltsyreforbindelsen l-cysteinhydroklorid brukes i melet til brød og annen
gjærbakst, konditorvarer og i kakemiks (E920). Gir bedre bakeegenskaper ved at
det gjør glutenet mykere og deigen løsere og mer strekkbar, og
deigutviklingstiden betydelig kortere.
Glutaminsyre, NH2CH(CH2CH2COOH)COOH,
er også en av de aminosyrene som inngår i proteiner. Den fremstilles av hvete,
soya eller spesielle bakterier og brukes som smaksforsterker ("det tredje
krydder) i kjøttvarer (E620) sammen med saltene natrium- (E621, MSG), kalium-
(E622) og kalsiumglutamat (E623). Noen individer begynner å rødme, får
varmefølelse i ansiktet og noen ganger hodepine ved høyt inntak av glutamat.
Siden stoffet har vært brukt lenge i østen kalles fenomenet gjerne
"kinarestaurant-syndromet". Ved dyreforsøk har helt nyfødte unger
fått hjerneskader ved høyt glutamatinntak, og stoffene er derfor forbudt i
spedbarnsmat.
Aspartam er et peptid
som består av de to aminosyrene asparaginsyre og fenylalanin. Det smaker 200
ganger så søtt som sukker og brukes derfor som søtstoff i matvarer (E951). Det
er ikke kalorifritt, men p.g.a. de små mengdene som skal til blir
kaloriinntaket minimalt, og aspartam finnes derfor i en mengde lettprodukter.
Pasienter med Føllings sykdom kan ikke bryte ned fenylalanin, og må derfor
unngå aspartam.
Amylase er en gruppe
enzymer som kan bryte ned stivelse til kortere oligosakkaridkjeder. Utvinnes av
korn, muggsopp eller bakterier og brukes i brøddeig for å bryte ned stivelsen i
melet noe og gi brødet bedre volum, skorpefarge, smak og aroma (kode 1100).
Proteaser er en gruppe
enzymer som bryter ned proteiner og dermed svekker glutennettverket i
hvetedeiger. De brukes som et alternativ til cystein for å øke brødvolumet,
korte ned eltetiden og bedre deigens egenskaper (E1101a). I Norge hovedsakelig
til kjeksproduksjon. Også til brød i USA, hvor hveteproteinene er sterkere. En
mye brukt protease er papain (E1101b).
Glukoseoksydase lages av
forskjellige typer muggsopp og oksyderer glukose til glukonsyre, som virker
pH-regulerende. Brukes i tørket egg, brød, kjeks, bakefettblandinger og
fettemulsjoner (E1102).
Natriumguanylat er
natriumsaltet av nukleotidet guanosinmonofosfat (GMP), som har to sure
hydrogener på fosfatgruppen. Det fremstilles syntetisk eller av gjærekstrakt og
brukes som smaksforsterker i proteinholdige næringsmidler (E627), spesielt
kjøtt og fisk. Virkningen er 10-20 ganger så sterk som for glutamat, og
tilsetningene er små i forhold til det naturlige innholdet av GMP og andre
guanidinforbindelser, men siden basen i GMP er et purinderivat, bør
giktpasienter som skal være forsiktige med puriner unngå stoffet. Finnes i
sauser til kjøtt- og fiskevarer, tørkede grønnsakprodukter, diverse
pulverprodukter samt marinert fjærfekjøtt.
Inosinsyre er et
nukleotid som likner GMP og brukes tilsvarende (E630). Forekommer i imiterte
skalldyrprodukter som lages av fiskemasse. Giktpasienter bør også holde seg
unna denne. Det samme gjelder dinatriuminosinat (E631), som brukes i sauser,
marinert fjærfekjøtt, tørkede grønnsakprodukter, pulverprodukter og imiterte
skalldyrprodukter.
Betain, (CH3)3N+CH2COO-,
finnes i rødbeter og er et av mange fargestoffer som trekkes ut av rødbeter og
brukes i matvareindustrien som rødbetfarge (E162), bl.a. i konfekt, sukkertøy,
iskrem, kaker, salater, lettprodukter, fiskesuppe og brus.
 Karminsyre er den virksomme
bestanddelen av karmin, et historisk høyt ettertraktet fargestoff som ble
utvunnet av en skjoldlus, cochenille, som lever på en bestemt kaktusart i
Mexico. Fremstilles nå syntetisk og brukes i akvarell- og malerfarger, blekk,
sminke og matvarer (E120). Karminsyre inngår først og fremst i karminrødt, men
andre karminfarger kan fremstilles ved kjemisk modifikasjon av molekylet.
Karminsyre er den virksomme
bestanddelen av karmin, et historisk høyt ettertraktet fargestoff som ble
utvunnet av en skjoldlus, cochenille, som lever på en bestemt kaktusart i
Mexico. Fremstilles nå syntetisk og brukes i akvarell- og malerfarger, blekk,
sminke og matvarer (E120). Karminsyre inngår først og fremst i karminrødt, men
andre karminfarger kan fremstilles ved kjemisk modifikasjon av molekylet.
 Erytrosin er en syre, og
natriumsaltet er i handelen som det røde fargestoffet erytrosin (E127), som
finnes i enkelte matvarer (i Norge hermetisk frukt, seilaks og
rognkjekskaviar). Noen forsøk har vist mistenkelige resultater, og anbefalt
daglig dose er satt lavt.
Erytrosin er en syre, og
natriumsaltet er i handelen som det røde fargestoffet erytrosin (E127), som
finnes i enkelte matvarer (i Norge hermetisk frukt, seilaks og
rognkjekskaviar). Noen forsøk har vist mistenkelige resultater, og anbefalt
daglig dose er satt lavt.
Alginsyre fremstilles av
algin, som finnes i celleveggene i tang. Brukes i matvarer (E400) som
stabilisator, emulgerings- og fortykningsmiddel. Saltene, alginatene, har samme
funksjon, og natriumalginatet (E401) er mer brukt enn syren. Natrium-, kalium-
(E402) og ammoniumalginat (E403) er i motsetning til syren og kalsiumalginatet
(E404) lettløselig i vann, og brukes derfor mest i vannbaserte næringsmidler.
For sure fruktsafter, visse leskedrikker og salatdressing er esteren
propylenglykolalginat (E405) mest brukt. Forøvrig er stoffene uhyre utbredt og
forekommer i en mengde produkter.
Lecitin er en klasse
fettstoffer (fosfolipider) som fremstilles av soyabønner og tilsettes til
matvarer (E322) som emulgeringsmiddel, antioksydant, næringsstoff og
hjelpestoff i tabletter. Finnes i kjøtt- og fiskesauser, fiskesupper, brød,
kaker og kjeks, nøtteprodukter (pålegg), grønnsaksupper, sennep og ketchup,
margarin, leskedrikker, kakao, sjokolade og andre godterier.
Ammoniumfosfatidat er et
ammoniumsalt av et fosfolipid som lages av rapsfrøolje og fosforforbindelser.
Likner lecitin kjemisk og kalles gjerne syntetisk lecitin. Brukes som
stabilisator og emulgeringsmiddel i sjokolade, drops og andre godterier (E442).
Mono- og diglyserider av
fettsyrer fås ved spalting av fett og brukes som emulgatorer i en rekke
matvarer (E471) og til å forlenge holdbarheten av brød.
Ved å forestre de ledige
alkoholgruppene på glyserolen i disse mono- og diglyseridene med forskjellige
syrer fås forskjellige estere som brukes i næringsmidler som emulgatorer og
stabilisatorer samt noen andre spesielle bruksområder. De øker volumet til
iskrem og gjør den lettere og luftigere ved at luftbobler i isen blir mer
bestandige. Samme funksjon har de i brød. De gir margarin bedre
stekeegenskaper, mindre sprut. Kodene angir hvilken syre som er forestret:
eddiksyre E472a, melkesyre E472b, sitronsyre E472c, vinsyre E472d,
diacetylvinsyre E472e. Spaltes som vanlig fett i kroppen, alle syrene unntatt
den siste er naturlige og går lett inn i stoffskiftet.
Polyglyserolestere av
fettsyrer fremstilles syntetisk av raffinerte fettsyrer og oljer og brukes i
sjokolade og margarin/fettblandinger som stabilisator og emulgator (R475). Gir
en bedre og mer stabil fettfordeling og sikrer mot uttørking.
Polyglyserolestere av
polykondenserte risinusoljefettsyrer fremstilles syntetisk av risinusolje og
glyserol og brukes som emulgator i sjokolade (E476) og i smørepålegg og
dressing med lavt eller meget lavt fettinnhold.
Propylenglykolestere av
fettsyrer brukes som emulgatorer i næringsmidler (E477), spesielt i kakemisk og
bakeråstoff for å gjøre det lettere å piske og til å gi kaker og kjeks en
sprøere overflate.
Propylgallat, C6H2(OH)3COOC3H7,
oktylgallat, C6H2(OH)3COOC8H17
og dodekylgallat, C6H2(OH)3COOC12H25,
er antioksydanter som motvirker harskning av fett og olje og brukes i matvarer
(h.h.v. E310, E311 og E312). Kan gi allergi og tilsettes i Norge derfor ikke
til mel, brød eller drikkevarer. Brukes (mest E310) i eggpulver,
kjøttkonserver, fersk uoppspedd fiskemasse, fiskehermetikk, peanøtter,
grønnsaksuppe, potetmos, fruktdesserter, kosttilskuddtabletter og smørkrokan.
Askorbylpalmitat er en
palmitinsyreester av askorbinsyre som er fettløselig og brukes som
tilsetningsstoff (E304a) mot fettharskning i snacksprodukter, potetmospulver og
andre tørrprodukter som morsmelkerstatning og nøds- og stridsrasjoner. Den
tilsvarende stearinsyreesteren askorbylstearat (E304b) brukes tilsvarende.
Polysorbat eller tween
er handelsnavn på en gruppe tilsetningsstoffer i næringsmidler:
polyoksyetylen(40)stearat (E431), polyoksyetylen(20)sorbitanmonolaurat (E432),
polyoksyetylen(20)sorbitanmonooleat (E433),
polyoksyetylen(20)sorbitanmonopalmitat (E434),
polyoksyetylen(20)sorbitanmonostearat (E435) og
polyoksyetylen(20)sorbitantristearat (E436). De fem siste kalles også h.h.v.
polysorbat 20, 80, 40, 60 og 65. Brukes som stabilisatorer og emulgatorer, mest
i produkter med høyt fettinnhold, som konditorvarer (kaker, kjeks, ferdige
deiger), kremer og fyll, peanøttsmør og andre homogeniserte nøtteprodukter, sauser,
bakefett, marinert fjærfekjøtt.
Av sorbitol og de
naturlige fettsyrene stearinsyre, oljesyre og palmitinsyre kan det fremstilles
forskjellige estere som brukes som stabilisatorer og emulgatorer til bruk i
matvarer. Sorbitanmonostearat er E491, tristearatet er E492, monolauratet E493,
monooleatet E494 og monopalmitatet E495. Kakaofettet i sjokoladeovertrekk
erstattes ofte med andre stoffer som smelter ved høyere temperatur. Når
sjokoladen utsettes for temperatursvingninger trekker noe av fettet ut i overflaten
og blir liggende som en grålig hinne. Stearatene av sorbitolen brukes mye til å
hindre slik misfarging. Finnes også i konditor- og bakervarer, kremer, fyll og
sukkertøy.
Mono-, di- og
trisukroseestere av palmitin- og stearinsyre brukes som prosesshjelpemiddel
sammen med polydimetylsiloksan ved produksjon av næringsmidler.
Av harpiks fra trær,
gummi og tallolje fremstilles glyserolestere som brukes til tyggegummibase og
fortykningsmiddel og aromastabilisator i leskedrikker (E445).
Bivoks er en blanding av
langkjedede hydrokarboner, fettsyrer og estere av fettsyrer og alkoholer,
gjerne 30-35 karboner pr. enhet. Den brukes som bonevoks, til salver og kremer,
og i matvarer (E901) til overflatebehandling, bærer for aromastoffer og
komponent i tyggegummibase.
Karnaubavoks utvinnes av
den brasilianske karnaubapalmen og består for det meste av estere av
langkjedede fettsyrer og alkoholer med noe hydrokarboner. Brukes til polervoks
og i matvarer (E902) til overflatebehandling.
Skjellakk dannes av
indiske fikentrær og en del andre planter når de blir stukket av skjoldlus. Det
brukes mest til møbelpolitur, som tilsetning til lakk og bonevoks og har lang
tradisjon til overflatebehandling av matvarer (E904). Har blitt brukt til å
dragere/lakke piller og sannsynligvis man man ønsker skal se fin ut. Brukes
særlig på sukkertøy og enkelte kaker og i noen land på epler og sitrusfrukter.
Riboflavin, E101, er det
samme som vitamin B2, et vannløselig vitamin som finnes bl.a. i melk, egg og
lever. Det fremstilles av naturprodukter eller ved biosyntese eller kjemisk
syntese og brukes som vitamintilskudd og som gult fargestoff i en rekke
matvarer.
Klorofyll brukes i
utstrakt grad som grønt fargestoff i matvarer (E140), bl.a. iskrem, ost, kaker,
fylte kjeks, hermetisk frukt og grønnsaker, sukkertøy, saft og brus samt i
kosttilskudd og konditorfarge. E141 er såkalt klorofyllin-kobberkompleks, hvor
magnesiumatomet er erstattet med kobber. Det gir blågrønne til blåsvarte farger
og har samme bruksområder som det vanlige klorofyllet, men på grunn av
kobberinnholdet kan det ikke brukes ubegrensede mengder av det.
Natamycin eller
primarcin er et antibiotikum som kan forekomme som tilsetningsstoff i maten
(E235), særlig mot mugg i osteproduksjonen. Har tidligere vært brukt mot bl.a.
underlivsbetennelse, men dette er det slutt med p.g.a. bruken i matvarer. Idag
anbefales det at stoffet bare brukes på de delene av matvarene som ikke spises,
f.eks. osteskorpe, hardt pølseskinn.
De fleste eksplosiver er
nitroforbindelser eller nitratestere av forskjellige organiske stoffer.
Drivende eksplosiver brukes til fremdrift av prosjektiler og kan bestå av
f.eks. svartkrutt eller røyksvakt krutt (nitratestere av cellulose). Brisante
eksplosiver brukes til sprengning (sprengstoffer). Dynamitt er klart mest brukt
til sivile formål og lages ved å suge opp nitroglyserol og nitroglykol i
kollodiumull (et cellulosenitratester med lavere nitreringsgrad).
For militære formål
finnes en mengde varianter, mest nitroforbindelser. TNT er det vanligste. Initierende
sprengstoffer brukes i fenghetter og andre anordninger til å bringe de brisante
til å eksplodere. De går lett av ved støt og varme og kan bestå av
kvikksølvcyanat (knallkvikksølv), Hg(OCN)2, eller blyazid, Pb(N3)2.
Såkalte sikkerhetssprengstoffer er oftest ikke karbonholdige og består gjerne
av nitrater, klorater og perklorater, men kan også være tilsatt sprengoljene
nitroglyserol og nitroglykol.
Organiske sprengstoffer
gir bare gassformige forbrenningsprodukter og derfor høyt sprengningstrykk og temperatur.
For typiske organiske sprengstoffer kan gassvolumet være 700-900 liter/kg
sprengstoff, trykket 50-100 tonn/kvadratcm og temperaturen 3500 til 5200° C.
Natriumformiat, HCOONa,
anvendes i øyedråper, ved kromgarving, i klorfrie erstatningsmiddel for koksalt
m.m.
Natriumacetat brukes i
fargerier og garverier, ved galvanisering, i kjemiske buffere, i fotografien
m.m.
Natriumpalmitat fås
temmelig rent ved lutkoking av kokosfett og brukes som nevnt i såpe og som
tykningsmiddel for bensinbrannbomber (napalm).
Fettsyresalter av
kalsium, natrium og kalium kan brukes som stabilisatorer og emulgatorer i
matvarer (E470).
Natrium- og
kalsiumstearoyllaktat fremstilles ved å forestre stearinsyre til
hydroksylgruppen i laktatene og brukes som stabilisatorer og emulgatorer i
næringsmidler (E481 og E482). Brukes mye i bakeribransjen, siden de gjør at
deigen tåler hardere mekanisk behandling og kaker blir mer holdbare, spesielt
hvis stoffene brukes sammen med mono- og triglyserider. Kalsiumsaltet brukes
også i en rekke andre produkter.
Natriumoksalat, (COONa)2,
brukes i kjemisk analyse, i spesialsementer, i fyrverkeri m.m.
Vinstein eller
kaliumhydrogentartrat er et biprodukt av vingjæring og brukes i bakepulver, som
beis i fargerier, ved galvanisering m.m.
Brekkvinstein,
kaliumantimonyltartrat, KOOC-CHOH-CHOH-COOSbO.3H2O, ble før brukt
som brekkmiddel for å fjerne giftstoffer fra mavesekken. Brukes nå som beis i
fargerier og i medisinen til intravenøse innsprøytninger mot visse
tropesykdommer.
Kaliumnatriumtartrat
eller seignettesalt, KOOC-CHOH-CHOH-COONa.4H2O, brukes til å
fremstille Fehlings væske, i medisinen og i næringsmiddelindustrien.
Handelsvaren
"syresalt" er kaliumhydrogenoksalat som er dimerisert med oksalsyre
og har to molekyler krystallvann: HOOCCOOK.(COOH)2.2H2O.
Brukes til å fjerne blekk- og rustflekker, som beis i tøytrykkerier, som
fremkallerløsning m.m. Kaliumhydrogenoksalat finnes i naturen i planter av
syrefamilien, bl.a. rabarbra.
Natrium- og
kalsiumcyklamat er et søtstoff som er ca. 30 ganger så søtt som sukker. Noen
forsøk på rotter i 1969 førte til mistanke om at de kunne være
kreftfremkallende, men forsøkene har ikke blitt bekreftet, og idag er stoffene
tillatt igjen og brukes flittig, spesielt i drikkevarer (E952).
Acesulfam K er et
søtstoff som er 150 ganger så søtt som vanlig sukker. Det er kalorifritt og
brukes i en mengde lettprodukter (E950), samt tyggegummi som bordsøtstoff og
fryse- og syltepulver. Hittil er det ikke funnet noen bivirkninger.
Natriumcyanid brukes i
sølv- og gullutvinning etter cyanidprosessen, til fremstilling av galvaniske
bad, særlig for edelmetallsalter, til organiske synteser, til rensing av
metaller, for fjerning av hår fra skinn, til insektgift m.m.
Kaliumcyanid, eller
cyankalium som det heter i gamle detektivbøker, brukes av de som har funnet seg
et skadedyr de vil bekjempe og forøvrig i fotografien og til galvanisk
metallbelegning.
Natriumheksacyanoferrat(II),
Na4Fe(CN)6.10H2O, brukes til fremstilling av
fargestoffer, til metallurgiske og fotografiske formål, i tekstilindustrien, i
fargerier og trykkerier, til fremstilling av visse typer spesialpapir og i
matvareindustrien (E535) sammen med kalium- (E536) og kalsiumsaltet (E538) som
middel mot klumper i sauser og pulverprodukter og fellingsmiddel i svake viner
og fruktviner.
Gult og rødt blodlutsalt
er h.h.v. Kaliumheksacyanoferrat(II) og kaliumheksacyanoferrat(III) (også kalt
h.h.v. kaliumferro- og ferricyanid og h.h.v. ferro- og ferricyankalium). Det
gule brukes til fremstilling av berlinerblått, som tilsetningsstoff i matvarer
(E536) m.m. I matvarer brukes også de tilsvarende natrium- (E535) og
kalsiumsaltene (E538). De brukes som middel mot klumping i forskjellige sauser
og pulverprodukter og som fellingsmiddel i svake viner, fruktviner, limonade og
brus. Det røde brukes som mildt oksydasjonsmiddel og ved fotofremkalling.
Kalsiumcyanamid, CaNCN2,
er et viktig industriprodukt som brukes til mange synteser i den kjemiske
industrien. Det kan enkelt fås ved å oppvarme kalsiumkarbid med nitrogen og er
utgangsprodukt for fremstilling av cyanider, dicyandiamid og melamin til
plastindustrien og sprengstoffet nitroguanidin.
Natriumtiocyanat eller
natriumrodanid, NaSCN, finner utnyttelse i medisinen, i fargerier, i
fotoindustrien, tekstilindustrien m.m.
Soda eller
natriumkarbonat har vært brukt som vaskemiddel siden oldtiden, og like lenge
som en av hovedbestanddelene i glass. Glassindustrien er nok det viktigste
idag, men andre storforbrukere er fargestoff-, cellulose-, vaskemiddel-, foto-,
lim- og harpiksindustrien. Soda brukes også idag i vaskerier, til avherding av
vann og til en rekke synteseprosesser. Lenge var Solvay-prosessen den eneste
viktige måten å fremskaffe soda på, med kalkstein og salt som utgangspunkt og
ammoniakk som katalyttisk hjelpemiddel. Soda er et av de første kjemikalier som
ble syntetisert i kommersiell målestokk, og det kan sies at sodafremstillingen
er grunnlaget for den kjemiske industri. I 1775 satte det franske akademi opp
en belønning til den som som klarte å fremstille soda av vanlig koksalt, fordi
de da tilgjengelige mineralkildene var i ferd med å bli uttømt. I 1790 klarte
Leblanc å utføre prosessen og vant prisen, men han fikk aldri noen glede av
den, for revolusjonskomiteen rasket til seg både pengene og originalarbeidene
hans. Leblanc levde i ussel fattigdom til han tok livet av seg i 1806. 70 år
senere utviklet belgieren Solvay en helt forskjellig metode, som er blitt brukt
til våre dager. Men idag hentes igjen det meste av den soda som brukes fra
mineralleier.
Kaliumkarbonat eller
pottaske brukes til fremstilling av glass (se artikkelen om silisium), emaljer,
keramikk og såper, som tørremiddel m.m. som hevemiddel i bakverk egner den seg
ikke siden den i motsetning til natron ikke avgir karbondioksyd ved oppvarming
til baketemperatur. Men sirup som brukes f.eks. i pepperkaker inneholder syrer
som frigjør gassen og mange pepperkakeoppskrifter inneholder pottaske (E501).
Kan også finnes i lutefisk, sjokolade og sukkertøy samt kosttilskudd for å
forbedre ionebalansen.
Ved Egeerhavets bredder
skinner hvite bygg i sommersolen. De består av kalsiumkarbonat, CaCO3,
millioner av døde dyrs kalkskall som har blitt lagret på havbunnen og foldet
ned av jordskorpebevegelser slik at kalksteinen har blitt lettere metamorfosert
til marmor. Ved siden av bygningsmateriale egner marmoren seg godt til
brynesteiner. Også andre former for kalsiumkarbonat har mye bruk. Spesielt
finkornede, umetamorfoserte kalkstein brukes til å skrive på tavler med. Men
kritt brukes også som metallpussemiddel og har vært brukt i tannkrem. Også
mindre edle former for kalkstein kan bygges med. Store mengder går med til
sement- og betongindustrien. Mye brukes også i jern- og stålindustrien, bl.a.
som tilsetning til kvartsrik malm for å senke smeltepunktet. Mye brukes til å
fremstille kunstgjødsel og fôr, som tilsetning til glass, porselen og annen
keramikk, i cellulose- og papirindustrien, til fremstilling av ildfaste
materialer, legemidler, hvite farger, bl.a. i mat (E170), også som
surhetsregulerende middel, antiklumpemiddel i salt og kalktilskudd. Men
kalkstein kjennes ved at den bruser i syre, og bygg av kalsiumkarbonat, om de
enn har stått i to tusen år eller mer, ødelegges av den nedbøren som bringer
det svovelet som de levende vesnene inkorporerte i proteinene sine og siden ble
brent i olje- eller kullovner, tilbake til jordoverflaten.
Magnesiumkarbonat, MgCO3,
fås fra mineralene magnesitt og dolomitt og brukes i medisinen til å
nøtralisere overskudd av magesyre (magnesia), og i ernæringsindustrien som
pH-regulerende middel og hevemiddel (E504).
Natron,
natriumbikarbonat eller -hydrogenkarbonat brukes i bakepulver, bruspulver,
brannslukningsapparater ("kullsyreapparater"), badesalt, i medisinen
mot syreoverskudd, ved konservering av sure frukter, som pH-regulerende middel
i matvarer (natron og soda benevnes begge E500) m.m.
Kaliumbikarbonat, KHCO3,
brukes i farmasøytisk industri, i brannslokningspulver, bakepulver, vaskemidler
m.m.
Ammoniumkarbonat, (NH4)2CO3,
brukes sammen med ammoniumbikarbonat som hevemiddel i bakervarer og i
sjokolade, sukkertøy, lutefisk og ved hobbyvinlegging (E503).
Hjortetakksalt til
baking er en blanding av ammoniumhydrogenkarbonat, NH4HCO3
og ammoniumkarbamat, NH4COONH2. Det har den fordelen
fremfor alkalikarbonater at det forgasses fullstendig ved oppvarming, slik at
det ikke blir igjen noe sterkt basisk alkali som gir 'lutsmak' i bakverket.
Derimot har det en tendens til å levne en viss salmiakksmak som imidlertid kan
utnyttes fordelaktig i noen kombinasjoner.
Sinktiokarbamater, Zn(CS2NR2)2,
hvor R er en organisk gruppe eller hydrogen, brukes som akselerator ved
vulkanisering av gummi. Tilsvarende jern- og mangansalter brukes sammen med
sinksaltet som middel mot sopp.
Silisiumkarbid, SiC,
sika eller karborundum lages ved å oppvarme kvarts med grafitt. Det er nesten
like hardt som diamant og uhyre kjemisk motstandsdyktig, har meget høyt
smeltepunkt, høy varmeledningsevne og lav varmeutvidelseskoeffisient. Derfor
brukes det til slipemiddel, som ildfast materiale og varmeisolasjonsmateriale
og i elektroteknikken p.g.a. sine halvlederegenskaper. Det brukes også til
stålproduksjon ved at silisiumet reagerer med metalloksyder og renser metallet.
Det brukes også som tilsetning til gulvmateriale som skal være slitesterkt og
glidefritt, f.eks. ved gulver og trapper i undergrunnsstasjoner, ved flyplasser
og ombord i båter. Silisiumkarbidet kan som grafitten fremstilles i fiberform
med de samme gode konstruksjonsegenskapene, og det pluss i tillegg at det har
ekstra god beskyttelse mot oksydasjon p.g.a. kvartsdannelse på overflaten.
Arendal smelteverk har vært den største produsernt av silisiumkarbid i Europa.
Hovedkilder:
Professor, dr. philos.
Haakon Haraldsen (Asch.konv.leks.5.utg.b.10).
Sverre Bruun, Lærebok i kjemi for naturfaglinjen, 2. utgave, Olaf Norlis
forlag, Oslo 1963.
Iwan Bolin, Kjemien i det praktiske liv, J.W.Cappelens forlag, Oslo 1932.
Joh. Dyring, Kortfattet fremstilling av kjemien, H. Joh. Dyrings forlag,
Porsgrund 1921.
Henri de Parville, Hvorfor?-Fordi, overs. L. Stange, Brødr. Salmonsens forlag,
Kjøbenhavn 1890.
Aamund Salveson, Kjemi, 3. utgave, Universitetsforlaget, Oslo 1966.
CRC Handbook of Chemistry and Physics, 57th ed.
1976-77.
Håkon Flood, Kjemi,
3. utgave, J.W. Cappelens forlag, Oslo 1962.
Per Kofstad, Uorganisk kjemi, Aschehoug, Oslo 1979.
Michell J Sienko & Robert A Plane, Chemical
Principles and Properties, McGraw-Hill, Tokyo 1974.
Gunnar Hägg, Allmän och Oorganisk Kemi, Almqvist & Wiksell, 1966.
F. Albert Cotton & Geoffrey Wilkinson, Advanced Inorganic Chemistry, Wiley,
New York 1988.
John L Kice & Elliot N Marvel, Modern Principles of Organic Chemistry, 2.
ed., Macmillan, New York - London, 1974.
Michael Fleischer, Glossary of Mineral Species, US Geological Survey, 1977.
Orla Zinck &
Torben Hallas-Møller, E-nummerboken, oversatt til norsk av Gunnar Bureid, 2.
utgave, Ex Libris Forlag, Oslo 1994.
Mary Elvira Weeks, Discovery of the Elements, Journal
of Chemical Education, Easton, Pennsylvania, 1956.
:-) LEF