ARGON
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
18 |
|
H |
2 |
|
|
|
|
|
|
|
|
|
|
13 |
14 |
15 |
16 |
17 |
He |
|
Li |
Be |
|
|
|
|
|
|
|
|
|
|
B |
C |
N |
O |
F |
Ne |
|
Na |
Mg |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
Al |
Si |
P |
S |
Cl |
Ar |
|
K |
Ca |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
Ga |
Ge |
As |
Se |
Br |
Kr |
|
Rb |
Sr |
Y |
Zr |
Nb |
Mo |
Tc |
Ru |
Rh |
Pd |
Ag |
Cd |
In |
Sn |
Sb |
Te |
I |
Xe |
|
Cs |
Ba |
La |
Hf |
Ta |
W |
Re |
Os |
Ir |
Pt |
Au |
Hg |
Tl |
Pb |
Bi |
Po |
At |
Rn |
|
Fr |
Ra |
Ac |
Rf |
Bh |
Sg |
Hs |
Mt |
? |
? |
? |
? |
|
? |
|
? |
|
? |
|
|
|
|
Ce |
Pr |
Nd |
Pm |
Sm |
Eu |
Gd |
Tb |
Dy |
Ho |
Er |
Tm |
Yb |
Lu |
|
|
|
|
|
Th |
Pa |
U |
Np |
Pu |
Am |
Cm |
Bk |
Cf |
Es |
Fm |
Md |
No |
Lr |
|
Ar, atomnr. 18, molvekt 39,948 g, elektronkonfigurasjon: (Ne)+3s2-3p6, smeltepunkt -189,2 °C, kokepunkt -185,77 °C, tetthet 1,7837 g/l ved romtemperatur, 1,40 g/ml som væske ved -186 °C og 1,65 g/cm3 som krystaller ved -233 °C. Argon hører til gruppe 18 i det periodiske systemet (også benevnt 8a eller VIII eller 0 eller hovedgruppe 8 og kjent som edelgassene), og har (1981) 15 kjente isotoper, hvorav tre, 36, 38 og 40, er stabile og forekommer i naturen. Av de radioaktive har 39 en halveringstid på 269 år, 42 har 33 år, 37 har 35,0 dager, mens de andre har fra to timer ned til noen millisekunder.
HISTORIE
Argon er et av de grunnstoffene som Henry Cavendish kunne krevd æren for å ha oppdaget hvis han hadde villet. Som det nå er, regnes han nå som oppdageren av hydrogen, men levde hele sitt 79-årige liv til ende uten å vedkjenne seg æren for det.
Den første europeer som hevdet at luft ikke var et grunnstoff (og den første i verden hvis vi skal mistro et kinesisk manuskript fra 700-tallet som noen forskere uttrykker sine tvil om) var Leonardo da Vinci i det 15. århundre. Han merket seg at luften ble forbrukt ved ånding og ved forbrenning, men ikke fullstendig, og uttrykte sammenhengen mellom de to prosessene i ordene: "Der hvor flammen ikke kan leve, kan heller ikke noe dyr som trekker pusten leve."
På 16- og 1700-tallet ble luften grundig undersøkt. Forestillingen om luft som et av de fire elementene hadde fremdeles stor makt, og mange forskere benevnte de forskjellige gassene som ble oppdaget som forskjellige typer luft.
Cavendish var ikke en teoretiker. Han trodde f.eks. på flogistonteorien fordi den var den mest innlysende. Men de praktiske eksperimentene hans som han utførte med en inntil da ukjent grundighet og med selvkomponerte instrumenter, var milelangt forut for sin tid. I 1785 var det allerede kjent at man kunne fjerne en bestanddel (som noen ganger ble kalt "forbrenningsluft", nå bedre kjent som oksygen) fra luften ved å la noe forbrenne i den. Cavendish fant ut at man kunne fjerne resten (noen ganger kalt "brent luft") ved å sende elektriske gnister gjennom luften, skylle utladningsproduktene (nitrogenoksyder) ned i alkalisk vann (hvor de dannet salter av salpetersyrling), tilføre mer forbrenningsluft, slå gnister, skylle ut, og gjenta til det ikke var noe igjen som reagerte med forbrenningsluften. Den overskytende forbrenningsluften kunne da lett fjernes ved å brenne fosfor i den. I beretningen om eksperimentet forteller han at: "Hvis det er noen del av den flogistoniserte (eller brente) luften i vår atmosfære som skiller seg fra det øvrige og ikke kan reduseres til salpetersyrling, kan vi trygt konkludere at det ikke er mer enn 1/120 del av det hele." Det skulle gå over hundre år før noen gikk videre med forsøkene.
Muligens på grunn av rapportens negative ordlyd gikk vitenskapen inn i det nye århundret i den tro at luften var ferdig utforsket og at det ikke kunne finnes noen nye bestanddeler i den. Den fikk derfor ligge i fred for forskerne, og tiår etter tiår passerte uten ny granskning.
Men i 1815-16 fremsatte William Prout, en almenpraktiserende lege i London, i to anonyme skrifter hypotesen om at alle atomvekter er et multippel av hydrogenets, og at hydrogenet er urstoffet som alle stoffer dannes av ved kondensasjon. Etterhvert som klor og magnesium og noen andre ble funnet å stemme lite overens med dette kom hypotesen hans i miskreditt, og det var kanskje for å avlive den en gang for alle at John William Strutt, den tredje Lord Rayleigh, i 1882 meldte at han ville undersøke tettheten til gasser (som er proporsjonal med atomvekten) for å finne ut om forholdet mellom f.eks. oksygen og hydrogen var nøyaktig 16 eller ikke.
Dette arbeidet tok tid, og mens vi venter på resultatene kan vi jo presentere ham litt. Rayleigh er en av de få fysikerne før vårt eget århundre som har prestert å oppdage et grunnstoff, men det er ikke så rart, for som fysiker var han mer allsidig enn det var vanlig. Han ga viktige bidrag innenfor fysikalsk kjemi, kapillærfysikk, optikk, akustikk, bølgelære, elektrisitet og hydrodynamikk. Hans viktigste fysiske arbeid er trolig grunnleggelsen av den moderne lydlæren, som han fremla i boken "Theory of Sound" 1877-78. Hertugfamilien Devonshire, som Henry Cavendish tilhørte, donerte 1871 midler til opprettelsen av et Cavendish-laboratorium ved Cambridge, hvor ikke ukjente James Clerk Maxwell var den første fysikkprofessoren og Rayleigh (fra 1879) den andre, etterfulgt av slike mirakelmenn som J.J. Thomson og Ernest Rutherford. Rayleigh var en uvanlig analytisk begavelse, en fremragende matematiker og unngikk aldri å bore seg inn til bunnen av problemene.
Det tok ti år før han offentliggjorde noen resultater. Oksygen/hydrogenforholdet var klarlagt til 15,882, tett opptil den moderne verdien 15,874. Men nitrogen hadde han litt problemer med. Oksygenprøver fremstilt på tre forskjellige måter hadde alle samme tetthet, men det var ikke tilfelle med nitrogenet. Det som kom fra ammoniakk var alltid fem promille lettere enn det som han fikk ved å absorbere oksygen, karbondioksyd og fuktighet fra lufta. I en artikkel i Nature, utgave 46, s.512-3 1892 ba han leserne om å sende inn forslag til forklaringer, men fikk ingen. Selv satte han opp fire hypoteser: 1) Det kunne fortsatt være litt oksygen i luftnitrogenet. 2) Det kunne være litt hydrogen i ammoniakknitrogenet. 3) Luftnitrogenet kunne inneholde trimerer av nitrogen tilsvarende oksygenets tendens til å danne oson. 4) Noen av nitrogenmolekylene fra ammoniakk kunne ha dekomponert til enkeltatomer.
Den første var usannsynlig, for det måtte være hele 3-4 % oksygen i nitrogenet for å øke tettheten så mye. Den tredje forkastet han etter å ha sendt gnister gjennom ammoniakknitrogen uten å observere tetthetsforandringer. Det var på dette stadiet at en annen ånd kom inn på arenaen.
William Ramsay er en av de få personlighetene som faktisk virkelig mister en dimensjon når de portretteres på flate fotografier. De brede gluggene til mannen ser spill levende og humrende på deg fra bildene og du angrer på at du er født på en tid som hindrer deg i å møte ham i levende samtale. Hans liv er uløselig knyttet til edelgassene. Han oppdaget fire av dem, påviste den femte for første gang på Jorda, og den sjette, radon, var han med på å bestemme egenskapene til og viste at den var et desintegrasjonsprodukt av radium.
Han var født i Glasgow i Skottland i 1852, av foreldre som hadde møtt hverandre sent i livet og giftet seg i førtiårsalderen. Han var deres eneste, hjertebarnet, og all den kjærlighet de hadde øste de over ham. Foreldrene var religiøse, men gutten viste tidlig glede over naturen, musikk og bøker, og utviklet en lidenskap for å lære nye språk. Han utmerket seg også i slike sunne aktiviteter som fotvandring, sykling, roing, svømming, stup, skøyteløp, sang, plystring og vitsefortelling, og vant seg derfor en svær mengde venner. Det fortelles fra et Parisopphold i 1876 at han tiltrakk store tilskuerskarer for sine flotte stup på et av de offentlig badene ved Seinen. Han kunne også forelese på perfekt tysk, fransk og italiensk. Han kunne riktignok ikke norsk, men siden han hadde lært seg gammelnorsk på grunn av interesse for sagaene, kunne han konversere med den norske kjemikeren Peter Waage (kjent for massevirkningsloven) på dette språket.
Hans interesse for kjemien ble vakt da han var elev ved Glasgow Academy, hvor faget ikke var på timeplanen, men han og noen venner møttes på soverommet hans, hvor de lekte seg med glassblåsing og enkle synteser av f.eks. oksygen, hydrogen og oksalsyre. Siden studerte han i Heidelberg under Robert Wilhelm Bunsen og i Tübingen under Rudolf Fittig. Deretter virket han som kjemilærer og i forskning i Glasgow og siden ved University College i Bristol, hvor han ble utnevnt til rektor i 1880, bare 28 år gammel. Men han flyttet til London i 1887, da han fikk et professorat ved University College der. I London traff han også Rayleigh, som samme år ble ansatt ved Royal Institution, og etter å ha hørt at han hadde problemer med det atmosfæriske nitrogenet sitt ba han om tillatelse til å få eksperimentere med det. Det fikk han.
Ramsay førte nitrogenet frem og tilbake over rødglødende magnesium, slik at det ble dannet fast magnesiumnitrid, og da omtrent 40 kubikkcentimeter var igjen, var tettheten 15/14 av det vanlige nitrogenet. Til slutt hadde han ikke mer igjen enn 1/80 av det opprinnelige nitrogenvolumet. Tettheten var nå nærmere 19/14 av nitrogen, nøyaktig bestemt av Rayleigh til 19,086. De trodde fremdeles at det var en modifikasjon av nitrogen, tilsvarende oson, men da Ramsay undersøkte spekteret, så han ikke bare de vanlige molekylære nitrogenbåndene, men også grupper av røde og grønne linjer som aldri hadde vært sett i noe gasspektrum. Rayleigh og Ramsay utvekslet brev nesten hver dag, og Ramsay spurte i et brev 24/5 1894 om Rayleigh hadde tenkt over at det kunne være plass til nye gassformige grunnstoffer i det periodiske systemet. Saken utviklet seg, og i et brev 7/8 skriver han: "I think that joint publication would be the best course, and I am much obliged to you for suggesting it, for I feel that a lucky chance has made me able to get Q (en foreløpig kode for den nye gassen) in quantity." Da British Association møttes samme måned, forbløffet de forsamlingen ved å annonsere oppdagelsen av en reaksjonstreg gass i atmosfæren. Etter forslag fra foreningens formann, H.G. Madan, kalte de den argon, den trege. I spektroskopien blir ofte R brukt som kode på argonlinjer til ære for oppdagerne.
Lecoq de Boisbaudran, fransk kjemiker som selv hadde flere grunnstoffoppdagelser bak seg, spådde etter nyhetene om argon at det ville eksistere en hel familie av reaksjonstrege gasser med atomvekter på 20,0945, 36,40, 84,01 og 132,71, noe som ikke stemmer så forbannet dårlig med dagens anerkjente på 20,179, 39,948, 83,80 og 131,30. I 1907 påviste Rayleigh argon i mange steinslag, bl.a. syenitt fra Norge.
Argon er gresk, intetkjønn av argos 'doven, treg', som er sammensatt av a- 'nektelse' og ergon 'verk, arbeide'. Nektelsesforstavelsen a- har også formen an-, og stammer fra indoeuropeisk (o)n-, som kommer av ne eller nei 'ikke'. Dette ordet kom til germansk som ne og derfra til norrønt som ne eller né, som ble brukt f.eks. i sammensetningen ne-eigi som i norsk ble til nei. Forstavelsen (o)n- ble un- i germansk og urnordisk, ó- eller ú- i norrønt og i norsk u-. Indoeuropeisk ne foreligger også i latin neuter og nullus, hvorav norsk nøytral, null.
Det greske ergon kommer av indoeuropeisk uergom 'verk', som i germansk er werka-, i norrønt verk og norsk det samme. En kausalform av werka- er (ga)werkia- 'arbeidsresultat', derav norrønt virki 'gjerning, festning' og norsk virke 'gjerning, tømmer'. Indoeuropeisk uergom ble verbalisert til uergio 'jeg virker, arbeider' derav germansk werkian 'å arbeide', oldhøytysk wirchan 'frembringe, virke, arbeide' og tysk wirken 'virke, øve, utrette' som er lånt til dansk og videre til norsk som virke 'arbeide, fungere'. En sideform av germansk werkian er wurkian, som i norrønt ble til yrkja 'virke, arbeide, makte', derav norsk yrke og ørkesløs. Det greske ordet ergon har vi også lånt, bl.a. i energi.
GEOLOGI
Argon er en av atmosfærens hovedbestanddeler. Den utgjør 0,934 volum-% av tørr luft ved jordoverflaten og er nr. 3 etter nitrogen og oksygen i hyppighet i atmosfæren. I jordskorpen som helhet (atmosfæren inkludert) er den heller ikke overvettes sjelden, med 0,0004 %, som gir den en 51. plass, mellom beryllium og uran. Likevel er det uvanlig lite argon på Jorda i forhold til nære naboer som kalsium, kalium, klor og svovel. I universet som helhet er forholdet et annet. Med 1,4 % av all masse utenom helium og hydrogen ligger argon der på en 11.-plass totalt, mellom svovel og nikkel, og fullt sammenliknbart med naboene. Dette misforholdet, som også gjelder for de andre edelgassene, skyldes formodentlig at edelgassene har mindre evne enn andre gasser til å binde seg til de faste partiklene som fortettet seg til planeter. Da Sola blaffet opp i de første voldsomme kjernereaksjonene blåste den bort alle gassene i atmosfæren, der edelgassene befant seg. Hele den nåværende atmosfæren stammer fra gasser som har kommet fra det indre gjennom vulkanutbrudd eller på andre måter er produsert siden Jordens fødsel.
Naturlig argon er en blanding av de tre isotopene 36 (0,337 atom-%), 38 (0,063 %) og 40 (99,600 %). Årsaken til den store overhyppigheten av 40 er at den er et nedbrytningsprodukt av det radioaktive kalium 40, som med en halveringstid på 1,28 milliarder år går over til Ar 40 i 11 % av desintegrasjonene. Hadde det ikke vært for dette tilskuddet, ville denne isotopen vært den klart sjeldneste av argonisotopene, siden den første (36) har den fordelen at den kan dannes ved sammenslåing av alfapartikler, slik som C 12, O 16, Ne 20, Mg 24, Si 28, S 32 og Ca 40, alle isotoper som dominerer isotopsammensetningen av disse grunnstoffene, og den andre (38) har et "magisk" antall nøytroner, (et "skall" av nøytroner er fylt i kjernen, noenlunde tilsvarende det som skjer når et elektronskall fylles) slik som f.eks. Cr 52, Sr 88 og Ba 138, også sterkt overhyppige isotoper. En "normal" isotopfordeling for argon ville vært 83 % 36, 15 % 38 og 2 % 40. En normal jordskorpehyppighet ville vært knappe 0,000002 %, d.v.s. 20 plasser nedover på lista og ned på samme nivå som ruthenium og osmium, og atmosfærehyppigheten 0,003 % - under karbondioksyd, men fortsatt foran neon, p.g.a. at det lettere neon i høyere grad har unnsluppet til universet. Bare ubetydelige mengder av det nydannede argon har unnsluppet til det interplanetariske rom siden Jordens fødsel.
Argon utvinnes bare av luft, men gassen finnes også i kildevann fra store dyp og i kaliumholdige mineraler, som overalt utgjør store deler av berggrunnen.
KJEMI
Argon er en enatomig gass uten farve, lukt eller smak. Den er tyngre enn luft og har en moderat løselighet i vann, 56 ml/liter vann ved 0 °C og 30,1 ml ved 50 °C, litt mer enn oksygen og omtrent dobbelt så mye som nitrogen. Frossent argon krystalliserer som de andre edelgassene (unntatt helium) i en kubisk flatesentrert struktur. Argon leder varme ganske dårlig, 0,1772 mW/cm/K ved 25 °C. Bare noen få, tyngre gasser av grunnstoffene er dårligere. Den har en lav magnetiserbarhet på -19,6 cgs-enheter ved romtemperatur. De sterkeste linjene for vanlig atomspektroskopi ligger på 1048, 1067, 6965, 7067, 7504 og 8115 Å.
Argon har få kjemiske egenskaper, og unngår hårdnakket å danne forbindelser med andre grunnstoffer. I ionisasjonskamre i massespektrometre og under andre ekstreme betingelser har det latt seg gjøre å påvise dannelsen av molekylære ioner som (NeAr)+, (ArKr)+ og (ArXe)+. Ved høyt trykk har det lykkes å frembringe et hydrat av sannsynlig formel Ar(H2O)6, som holdes sammen av van der Waalskrefter. Argon danner også en inneslutningsforbindelse eller såkalt klatrat med hydrokinon, som er ganske stabil og kan lagres under normale betingelser i lengre tid.
Ved fotokjemisk spaltning av flussyre i frosset argon er det nylig (2000) påvist et argonfluorohydrid, HArF, som ser ut til å ha en høy grad av stabilitet.
Edelgasser som er ionisert ved mer eller mindre kraftige virkemidler er atskillig mer reaktive enn de nøytrale gassene. Et eksempel er Ar+-ionet. Dette ionet vil svært gjerne plukke opp et hydrogenatom til ArH+. Dette molekylionet er faktisk isoelektronisk med HCl og har lukkede elektronskall, og det kan derfor overleve ganske lenge.
Analyse:
Argon har et karakteristisk spektrum med mange gode linjer i rødt, så spektralanalyse er velegnet, men de sterkeste linjene er i infrarødt og ultrafiolett. Evnen til å motstå kjemiske påvirkninger kan også benyttes til å skille det fra andre komponenter i prøven som skal analyseres. De fleste andre komponentene har noe de reagerer med ved alminnelige eller høye temperaturer.
Fremstilling:
Argon fremstilles ved å destillere flytende luft. Hvis luften er fortettet med flytende nitrogen vil den inneholde et mindre kvantum nitrogen selv. Dette koker av først, ved -196 °C, og slippes ut i det fri. Så stiger temperaturen til -183 °C, og oksygenet koker av samtidig med argonet. Dette samles opp så lenge temperaturen holder seg konstant. Oksygenet fjernes så ved å reageres med et eller annet, f.eks. hydrogen eller magnesium. Brukes hydrogen, må det ubrukte hydrogenet fjernes ved å la det reagere med kobberoksyd, deretter føres gassen gjennom et tørkemiddel, f.eks. svovelsyre, for å fjerne vannet som dannes ved de to reaksjonene med hydrogenet.
Demontrasjonsforsøk:
Har man klart å skaffe seg en prøve av gassen på ovenstående måte kan det passe godt å tappe en liten mengde av den over i et utladningsrør som på forhånd er pumpet lufttomt. Merk at det ikke skal brukes mye. Det skal fortsatt være et ganske godt vakuum i røret - noen få tusendeler av en atmosfæres trykk er nok. En spenning på ca. 3-6000 V er nødvendig, men argon gir ikke noe i nærheten av det imponerende røde neonlyset, bare en svak, rødlig glød. Ved en slik demonstrasjon kan det være en idé å vise fram alle edelgassene i utladningsrør for sammenlikningens skyld. Man behøver jo ikke å ha lagd og fylt utladningsrørene selv.
Argonforbindelser:
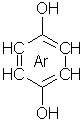
Eller Ar.HOC6H4OH. Argonhydrokinon. Et klatrat eller inneslutningsforbindelse som holdes sammen med van der Waalskrefter og har en krystallstruktur der argonatomer stenges inne mellom benzenringene av de to nærmeste hydrokinonmolekylene. Det eksisterer ingen virkelige kjemiske bindinger. Fremstilles ved å la argon under 40 atmosfærers trykk komme i kontakt med en løsning av hydrokinon i vann. Forbindelsen er relativt stabil og kan lagres i lengre tid under normale betingelser.
Argonhydrat. Fremstilles ved å utsette en løsning av argon i vann for et trykk på minst 105 atmosfærer. Dette er også et klatrat, og holdes ikke sammen av ioniske eller kovalente bindingskrefter, men av romlige forhold, fordi argonatomer er innestengt i et gitter av hydrogenbindinger og vanlige H-O-H-bindinger. Dette gitteret likner ikke krystallgitteret i vanlig is, men er tilpasset plasseringen av argonatomene. Forbindelsen er ustabil og kan ikke eksistere under vanlige trykk- og temperaturforhold.
Argonfluorohydrid. Lages ved innvirkning av lyset på flussyre i frosset argon. Kan ha en høy grad av indre stabilitet med både ioniske og kovalente bidrag til bindingen.
BIOLOGI
Argon er til stede i den lufta du puster inn. Den opptas lett i lungene dine og sirkulerer i blodet ditt, men uten å foreta seg noe særlig, og skilles like lett ut igjen samme vei som den kom. Også planter forholder seg på samme måten til argon.
UTNYTTELSE
Som den mest utbredte av edelgassene brukes argon mest for sine typiske edelgassegenskaper. Den brukes som beskyttende atmosfære ved buesveising og skjæring, ved produksjon av titan og andre reaktive grunnstoffer og ved dyrking av silisium og germaniumkrystaller. Den brukes også i glødelamper og lysrør o.a. belysningsteknikk. Ved å fylle glødelamper med argon i stedet for at de er lufttomme, dunster glødetråden bort saktere, og man kan dermed oppnå lengre levetid med samme glødetemperatur eller bedre (og hvitere) lysstyrke med høyere temperatur. I vanlige glødelamper er det ofte tilsatt litt nitrogen. Argon brukes også til å fylle ioniseringskamre og tellerør i en rekke forskjellige typer detektorer og måleinstrumenter.
Hovedkilder:
Prof.dr.phil. Haakon Haraldsen (Asch.konv.leks.5.utg.b.1)
CRC Handbook of Chemistry anf Physics, 57th ed. 1976-77.
Gunnar Hägg "Allmän och oorganisk kemi" Almqvist & Wiksell, Stockholm, 1966.
W. Seelmann-Eggebert, G. Pfennig, H. Münzel, H. Klewe-Nebenius Karlsruher Nuklidkarte, Institut für Radiochemie, Kernforschungszentrum Karlsruhe GmbH, 5. Auflage, Karlsruhe 1981.
Mary Elvira Weeks "Discovery of the Elements" 6. ed., Journal of Chemical Education, Easton, Pennsylvania, 1956.
:-) LEF